表达人源补体调节蛋白hCD55对异种胰岛移植的保护作用
李欣 潘登科 周佳 闫杰 陈军 杜嘉祥 龚曼琳
1型糖尿病是胰岛β细胞被破坏而导致胰岛素绝对缺乏的一种慢性自身免疫性疾病,是遗传因素、环境因素、微生物、代谢和免疫系统之间相互作用的结果[1-4]。糖尿病发展到后期会产生许多并发症,将严重影响患者的生活质量[5-9]。
胰腺移植和胰岛移植是治疗严重糖尿病患者的有效途径,胰岛移植相比于胰腺移植,具有创伤小、风险小等优势[10-13]。同种胰岛移植存在供者来源短缺的问题,异种胰岛移植是解决这一问题的有效途径[14-17]。猪被认为是最佳的异种胰岛供体,但当猪胰岛细胞暴露于受体的血液中会产生立即经血液介导的炎症反 应(instant blood-mediated inflammatory reaction,IBMIR),其中抗原抗体结合从而激活补体系统是触发IBMIR的一个关键因素[14,18-20]。α-1,3-半乳糖(α-1,3-galactose,αGal)是猪到人重要的异种抗原,由α-1,3-半乳糖基转移酶(α-1,3-galactosyltransferase,GGTA1)催化合成,用敲除该抗原的猪胰岛细胞进行异种移植能减少免疫排斥反应[21-22]。
补体是机体先天免疫系统的重要组成部分之一,已发现经典途径、旁路途径和凝集素途径3种激活方式,它们有共同的终末反应,最终形成攻膜复合物[23-27]。CD55通过抑制补体级联激活经典途径和替代途径中C3/C5转化酶活性,从而减少攻膜复合物的形成[28-29]。成都中科奥格生物科技有限公司自主制备了人类簇分化抗原55(human cluster of differentiation 55,hCD55)蛋白高表达小型猪,且已在外周血单核细胞上完成验证[30]。hCD55蛋白在猪胰岛细胞的表达情况及发挥抑制补体激活的作用效果尚未进行研究,由此本文设计相关实验,验证hCD55在猪胰岛细胞上的表达及其保护作用,为hCD55在异种胰岛移植中的应用提供理论依据。
1 材料与方法
1.1 实验动物与试剂
所用4只小型猪(18月龄及以上)均来自于成都中科奥格生物科技有限公司,饲养于普通级猪舍,自由进食与饮水。用于分离胰岛细胞的3只猪基因型分别为WT(野生型)、GTKO(GGTA1基因敲除)、GTKO/hCD55;用于采集猪耳组织样品的1只猪基因型为hCD55。本研究经成都中科奥格生物科技有限公司伦理委员会批准。
健康人混合新鲜血清的收集均在征求当事人同意的情况下采集,来源为A、B、O型血志愿者各3名,将3种血型血清等比混合。
主要试剂包括:Hank’s平衡盐溶液、RPMI 1640培养基(温州怡康公司),无糖DMEM培养基、Ham’s F10培养基、胎牛血清(美国Gibco公司),双硫棕(dithizone,DTZ)、猪胰岛素检测试剂盒(北京索莱宝公司),通用基因组DNA小量提取试剂盒、微量总RNA提取试剂盒(北京天漠公司),反转录试剂盒(北京全式金公司),小鼠抗人CD55-藻红蛋白(phycoerythrin,PE)标记单克隆抗体(美国Santa Cruz公司),兔抗人C3c-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记抗体、兔抗人C4c-FITC标记抗体(北京中杉金桥公司),小鼠抗人C5b-9单克隆抗体(丹麦DAKO公司),山羊抗鼠IgG-Dylight 488标记二抗(美国Abbkine公司)。
1.2 实验方法
1.2.1 成年猪胰岛细胞分离及纯度检测 成年猪麻醉后开腹,从猪左肾部位边的主动脉插入10 mL移液管放血,待放血接近完全时,找到胰腺组织,用4 ℃预冷生理盐水冲淋胰腺使其降温,用无菌钝弯剪小心剥离胰腺旁组织取出完整猪胰腺,置于预冷的Hank’s平衡盐溶液中。用无菌弯钝剪将胰腺上的脂肪、结缔组织等修剪干净后称重。将胶原酶灌注进猪胰腺直至充盈,灌注后的猪胰腺剪成大小均一的组织块进行消化,期间取样进行DTZ染色(DTZ可与胰岛β细胞中的锌离子螯合而使细胞显猩红色),显微镜下观察细胞染色,出现猩红色时终止消化。收集消化后的组织并用含10%胎牛血清的1640培养基洗涤,通过不连续密度梯度法对收集的组织进行纯化,最终离心管底部沉淀即为胰岛细胞。将胰岛细胞按照接种密度为1×104胰岛当量(islet equivalent,IEQ)/30 mL Ham’s F10培养基进行培养。
1.2.2 葡萄糖刺激的胰岛素分泌及其检测 分别取100 IEQ WT、GTKO、GTKO/hCD55 猪胰岛细胞,用无糖DMEM培养基重悬胰岛细胞,放入直径12 mm,孔径12 μm筛网中,将筛网置于无菌纱布上将无糖DMEM培养基吸干,随后放入2.6 mmol/L的低糖溶液中,置于37 ℃培养箱孵育1 h。低糖溶液孵育后,吸取低糖溶液于1.5 mL离心管中暂时保存于4 ℃冰箱,再用镊子将装有胰岛细胞的筛网放置于26 mmol/L的高糖溶液,37 ℃孵育1 h,高糖溶液刺激完以后同样操作将高糖溶液储存于4 ℃冰箱。采用猪胰岛素检测试剂盒测定高、低糖溶液中的猪胰岛素含量,糖刺激指数=A1/A2×100,其中A1为26 mmol/L高糖溶液刺激后的猪胰岛素含量,A2为2.6 mmol/L低糖溶液刺激后的猪胰岛素含量。
1.2.3 引物设计 在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)中查找已有猪β-actin基因(Gene ID:414396)序列、hCD55基因编码序列(coding sequence,CDS)(Gene ID:NM_000574)和猪β-actin基因CDS(Gene ID:XM_003124280),使用NCBI Primer-Blast在线软件设计特异性引物(表1),由北京擎科生物公司合成。

表1 引物序列信息Table1 Information of primer sequences
1.2.4 DNA水平鉴定 取分离培养GTKO、GTKO/hCD55猪胰岛细胞团和hCD55猪耳组织样品(耳部采用75%乙醇反复消毒后,剪取耳廓组织,大小约为1.0 cm×0.2 cm),按基因组DNA提取试剂盒操作说明书分别提取DNA,使用微量核酸测定仪测定DNA浓度,-20 ℃保存备用。取hCD55猪耳样DNA、WT猪胰岛DNA、GTKO/CD55猪胰岛DNA为模板,分别添加引物进行聚合酶链反应(polymerase chain reaction,PCR)扩增,产物经1%琼脂糖凝胶电泳、拍照。
1.2.5 RNA水平鉴定 取分离培养的GTKO、GTKO/hCD55猪胰岛细胞团,按总RNA提取试剂盒操作说明书分别提取总RNA,检测RNA的完整性,微量核酸测定仪测定,定量后分别取500 ng 总RNA,通过逆转录PCR(reverse transcription PCR,RT-PCR)反转录生成cDNA。分别添加引物进行PCR扩增,PCR产物经2%琼脂糖凝胶电泳、拍照。
1.2.6 蛋白水平鉴定 取分离培养的WT、GTKO、GTKO/hCD55猪胰岛细胞团,过70 μm细胞筛,磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗收集筛网上大于70 μm的细胞团,离心弃上清后加入0.05%的胰酶(不含乙二胺四乙酸),37 ℃消化5~8 min,期间用移液器轻柔吹打分散至单个细胞,加入含10%胎牛血清的PBS终止消化,离心弃上清,PBS重悬细胞,过40 μm细胞筛去除未消化的细胞团。将收集的胰岛单细胞离心弃上清,重悬,加入5 μL小鼠抗人CD55- PE标记单克隆抗体,4 ℃避光孵育30 min,重悬细胞后采用流式细胞仪进行检测。
1.2.7 补体依赖的细胞毒性实验 取分离培养的WT、GTKO、GTKO/hCD55猪胰岛细胞团,按1.2.6中所述分离单个胰岛细胞,分别加入各比例稀释的混合新鲜人血清(血清终浓度依次为1∶2、1∶4、1∶8)及空白对照组(加入PBS),37 ℃孵育30 min,PBS洗2次,重悬加入碘化丙啶溶液,4 ℃避光孵育8 min,采用流式细胞仪检测细胞死亡比例。独立实验重复6次。细胞毒性(%)=[(A-C)/(B-C)]×100%,其中A为细胞死亡比例,B为细胞最大死亡比例,一般为98%~100%,C为细胞最小死亡比例。
1.2.8 人补体沉积检测 取分离培养的WT、GTKO、GTKO/hCD55猪胰岛细胞团,按1.2.6中所述分离单个胰岛细胞,分别加入稀释后的混合新鲜人血清(血清终浓度为1∶6),37 ℃孵育30 min,PBS洗2次,分别加入兔抗人C3c-FITC标记抗体、兔抗人C4c-FITC标记抗体、小鼠抗人C5b-9单克隆抗体,4 ℃避光孵育30 min,C5b-9组再加入山羊抗鼠IgGDylight 488标记二抗,4 ℃避光孵育30 min,PBS洗涤细胞并重悬后,采用流式细胞仪进行检测。
1.3 统计学方法
采用GraphPad Prism 7.0软件进行统计学分析。计量资料以均数±标准差表示,组间比较采用单因素方差分析,组间两两比较采用Tukey多重比较检验。P<0.05为差异有统计学意义。
2 结 果
2.1 猪胰岛细胞团纯度和胰岛素分泌功能检测
分离WT、GTKO、GTKO/hCD55猪胰岛细胞团,DTZ染色结果显示猪胰岛细胞团纯度>75%(图1)。

图1 3种猪胰岛细胞团的纯度检测Figure 1 Purity detection of three porcine islet cell mass
特异性猪胰岛素试剂盒计算得到WT、GTKO、GTKO/hCD55猪胰岛细胞的糖刺激指数分别为1.20、1.08、1.06,结果表明分离的猪胰岛细胞具有分泌胰岛素的功能。
2.2 DNA、RNA及蛋白水平鉴定
取hCD55猪耳组织样品DNA为阳性对照,GTKO猪胰岛细胞DNA为阴性对照,PCR扩增结果如图2A所示,GTKO/hCD55猪胰岛细胞基因组上发生hCD55序列整合。RT-PCR扩增结果如图2B所示,在GTKO/hCD55猪胰岛细胞上检测到hCD55信使核糖核酸(messenger RNA,mRNA)表达。流式细胞仪检测结果如图2C所示,WT、GTKO猪胰岛细胞上未检测到hCD55蛋白表达,GTKO/hCD55猪胰岛细胞上检测到hCD55蛋白表达。
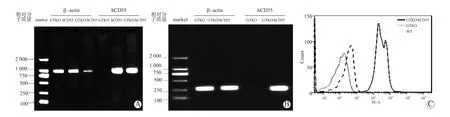
图2 hCD55 DNA、RNA及蛋白水平鉴定Figure 2 Identification of hCD55 DNA, RNA and protein level
2.3 补体依赖的细胞毒性实验
补体依赖的细胞毒性实验结果如图3所示,在新鲜人血清稀释比1∶2、1∶4和1∶8条件下,WT与GTKO、GTKO/hCD55猪胰岛细胞毒性比较,差异均有统计学意义(均为P<0.05);在新鲜人血清稀释比分别为1∶2和1∶4条件下,GTKO与GTKO/hCD55猪胰岛细胞毒性比较,差异均有统计学意义(均为P<0.05),而当新鲜人血清稀释比为1∶8时,GTKO与GTKO/hCD55猪胰岛细胞毒性比较,差异无统计学意义(P>0.05)。

图3 补体依赖的细胞毒性实验Figure 3 Complement dependent cytotoxicity test
2.4 人补体沉积检测
人补体沉积检测结果如图4所示,与WT、GTKO猪胰岛细胞相比,GTKO/hCD55猪胰岛细胞上人补体C3c和攻膜复合物C5b-9的沉积均减少,人补体C4c的沉积几乎不变。

图4 猪胰岛细胞上人补体沉积情况Figure 4 Human complement deposition in pig islet cells
3 讨 论
1型糖尿病患病人数逐年增加,并发症严重影响患者的生活质量,威胁生命安全。胰岛移植是治疗1型糖尿病合并严重并发症患者的有效途径之一。供者来源短缺是胰岛移植面临的一大难题,而猪与人的生理、解剖结构十分相似,可作为异种胰岛移植的理想供体,从而解决供体短缺问题。
当猪胰岛细胞经肝门静脉移植进入受体体内后,早期会发生IBMIR,它是一种复杂的先天免疫系统的非特异性反应,可激活补体、凝血级联反应和导致中性粒细胞浸润[31]。对供体进行基因修饰,表达补体调节蛋白,有助于减少IBMIR,提高异种胰岛细胞的存活率。hCD46是一种具有补体调节特性的蛋白,是因子Ⅰ介导的C3b和C4b裂解的唯一普遍表达的辅助因子[32]。van der Windt等[19]将hCD46转基因猪胰岛细胞移植给糖尿病模型猴,受体猴脱离外源胰岛素最长时间达396 d。hCD55与hCD46都属于补体调节蛋白,但是作用途径不同。国外研究用腺病毒转染的方法使得大白猪胰岛细胞表达hCD55蛋白,并取得一定效果[33]。体外腺病毒转染方法存在表达不均一、不稳定的问题,成都中科奥格生物科技有限公司在GGTA1基因敲除巴马小型猪耳成纤维细胞的基础上,利用CRISPR/Cas9技术成功建立了Rosa26位点敲入hCD55基因的耳成纤维细胞系[34]。笔者课题组前期研究已使用GTKO新生猪胰岛细胞移植到1型糖尿病猕猴进行异种胰岛移植,移植物在术后12周能检测到特异性猪C肽,且每日平均外源胰岛素用量减少[35]。
在此基础上本研究先对GTKO/hCD55猪胰岛细胞上hCD55的表达进行了验证,然后通过新鲜混合人血清与猪胰岛细胞共孵育,采用流式细胞术检测补体沉积和细胞毒性情况。结果显示3种基因型猪胰岛细胞与混合人血清孵育后,胰岛细胞毒性与人C3c、C5b-9在猪胰岛细胞上的沉积有差异,表明在体外实验中猪胰岛细胞上表达hCD55蛋白有助于抑制补体激活、减少C3c和攻膜复合物C5b-9的沉积,进而降低细胞毒性。在补体依赖的细胞毒性实验中,新鲜混合人血清稀释比分别为1∶2、1∶4、1∶8时,WT与GTKO猪胰岛细胞毒性差异显著,表明敲除αGal抗原有助于减少细胞死亡;新鲜混合人血清稀释比分别为1∶2、1∶4时,GTKO/hCD55与WT、GTKO猪胰岛细胞毒性差异显著,说明与GTKO基因型比较,GTKO/hCD55基因型在减少猪胰岛细胞死亡的效果方面进一步发挥了保护作用。但是当新鲜混合人血清稀释比为1∶8时,GTKO与GTKO/hCD55猪胰岛细胞毒性差异无统计学意义,有可能是因为当人血清稀释比为1∶8时血清中的人补体成分较少,GTKO、GTKO/hCD55猪胰岛细胞与人补体成分接触不够所导致的。由于猪胰腺细胞外基质蛋白相比于鼠、犬、人胰腺细胞外基质蛋白表达较弱,尤其是在胰岛周围[36],猪胰腺相对于其他物种的胰腺更容易被消化,在分离的过程中对温度与中止消化的时间更加敏感,分离难度更大,且猪的年龄不仅决定了胰腺的可分离性,也决定了胰岛的体内、体外生理功能[37],因此本研究选用18月龄及以上成年猪。本研究证实猪胰岛细胞上表达hCD55蛋白在体外实验中能够发挥保护作用,但移植到受体体内所发挥的作用仍需进一步验证。
综上所述,本文成功分离得到具有胰岛素分泌功能的猪胰岛细胞,完成hCD55的DNA、RNA和蛋白水平鉴定,在新鲜混合人血清孵育条件下,通过补体依赖的细胞毒性实验和人补体沉积检测,验证了hCD55蛋白在猪胰岛细胞上所发挥的补体保护效果,这为hCD55在异种胰岛移植中的应用提供了理论依据。

