TMSB10表达水平与胃癌患者淋巴结转移及早期进展的相关性
买尔旦·赛力木,金 钟,柯于必
(新疆医科大学第一附属医院综合外科,新疆 乌鲁木齐 830054)
2018年中国癌症数据表明,胃癌发病率和病死率高居我国癌症的第2位,且80%以上的患者为进展期胃癌[1]。淋巴结转移是胃癌最常见的转移方式,18%的患者在胃癌早期即出现淋巴结转移[2]。同时,淋巴结转移也是影响胃癌患者治疗方式选择及预后的重要因素。目前临床上多采用CT或者内镜活检的方式确定患者是否出现淋巴结转移,但CT效果不理想,内镜活检作为侵入性操作,患者接受度不高。临床上亟需寻求一种能够准确评估和预测胃癌患者淋巴结转移的生物学标志物。胸腺素β10(thymosin beta 10,TMSB10)作为胸腺素家族的一员,广泛分布于人体各组织器官中,其在细胞骨架组织和某些生物学行为中发挥重要作用,如细胞形态改变、细胞增殖和迁移[3]。近年来有研究表明,TMSB10与多种肿瘤进展密切相关,其在肺癌、结直肠癌、甲状腺癌组织中高表达会导致患者病变程度加重、术后生存期缩短[4-5]。另有研究报道,TMSB10可作为潜在生物学标志物用于预测胃癌患者预后[6]。但类似研究在国内尚未见开展,为了探讨TMSB10在胃癌组织中的表达是否与患者淋巴结转移及预后相关,本研究通过分析胃癌患者的TMSB10表达水平及其与淋巴结转移的关系,拟为其临床治疗提供参考。
1 资料与方法
1.1 临床资料
本研究为前瞻性随访研究,纳入2019年8月至2020年8月我院收治的行胃癌根治术的胃癌患者120例,年龄45~70岁,平均(57.22±8.13)岁。根据术后病理结果是否存在淋巴结转移将患者分为淋巴结转移组(LN组)和非淋巴结转移组(非LN组)。纳入标准:①符合《胃癌诊疗规范(2018年版)》[7]中胃癌的诊断标准;②具有手术指征,符合《中国腹腔镜胃癌根治手术质量控制专家共识(2017版)》[8]中的标准;③临床及随访资料完整。排除标准:①合并其他部位恶性肿瘤;②合并心、肝、肺、肾功能障碍,无法耐受手术;③术前接受过新辅助化疗。本研究经我院伦理委员会批准(k201907-04),患者及家属均签署知情同意书。
1.2 方法
1.2.1 治疗方法 所有患者完善术前准备后严格按照腹腔镜胃癌根治术规范进行操作。术后采用替吉奥联合顺铂方案化疗6个周期。
1.2.2 资料收集 收集所有患者性别、年龄、BMI、肿瘤浸润深度、肿瘤直径、组织学分型、大体分型、肿瘤位置、是否合并溃疡、癌胚抗原(carcinoembryonic antigen,CEA)水平、糖类抗原199(carbohydrate antigen 199,CA199)水平等指标。
1.3 TMSB10蛋白表达水平检测
采用组织芯片蜡块制备仪制备蜡块,8×4孔,间距1 mm,内径2.2 mm;将胃癌组织HE染色标本利用打孔针放置于制备好的蜡块中,加热,充分融合组织,制备胃癌组织石蜡切片标本;切片厚度为4 μm,利用3-氨丙基-3-甲氧基硅烷处理的载玻片捞取切片,全部敷贴完毕后放入70 ℃恒温箱中过夜。随后进行脱蜡、洗片、清洗、抗体孵育、清洗、抗体结合、清洗、染色、DAB显色、苏木素复染、脱水、封片。而后采用AperioCytoplasma 2.0软件扫描并分析组织芯片中TMSB10蛋白表达情况。
1.4 随访
所有患者均随访12个月,随访截止时间2021年8月31日。若患者术后出现复发、远处转移、癌因性死亡等,则定义为疾病进展。根据TMSB10蛋白表达中位数将患者分为TMSB10低表达组(60例)和TMSB10高表达组(60例),采用Log-rank生存分析检验分析2组患者术后12个月疾病进展风险。
1.5 统计学处理
2 结果
2.1 患者淋巴结转移情况及临床资料比较
术后病理检查结果示120例患者中共有89例患者出现淋巴结转移,据此将患者分为LN组(n=89)和非LN组(n=31)。LN组患者年龄、肿瘤浸润深度、组织学分型、是否合并溃疡、肿瘤直径与非LN组比较,差异具有统计学意义(P<0.05),见表1。
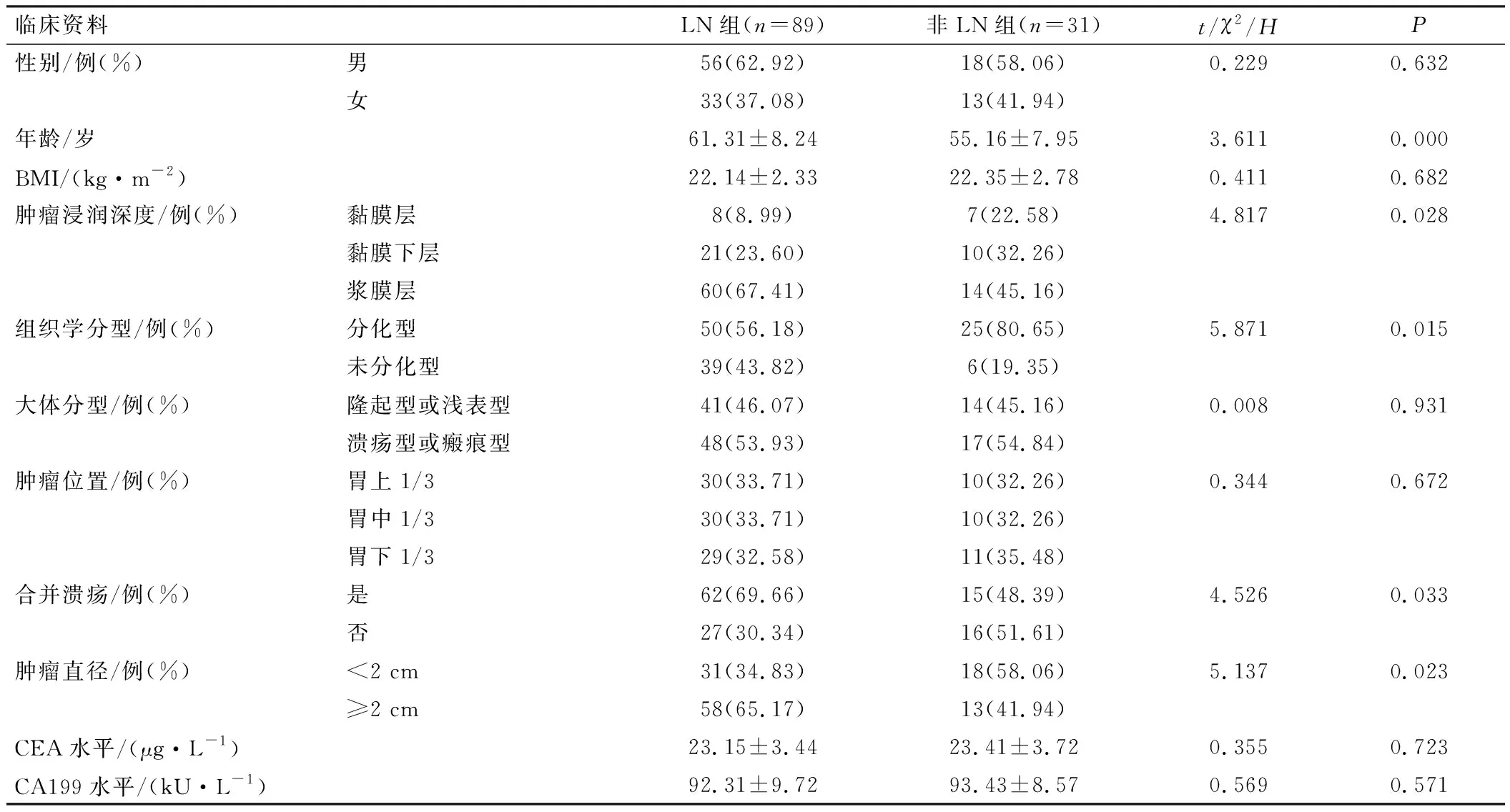
表1 患者临床资料比较
2.2 患者癌组织和癌旁组织TMSB10蛋白表达水平
2组患者癌旁组织中TMSB10蛋白表达水平均明显低于癌组织,且LN组癌组织中TMSB10蛋白表达水平高于非LN组,差异均具有统计学意义(P<0.05),见图1。
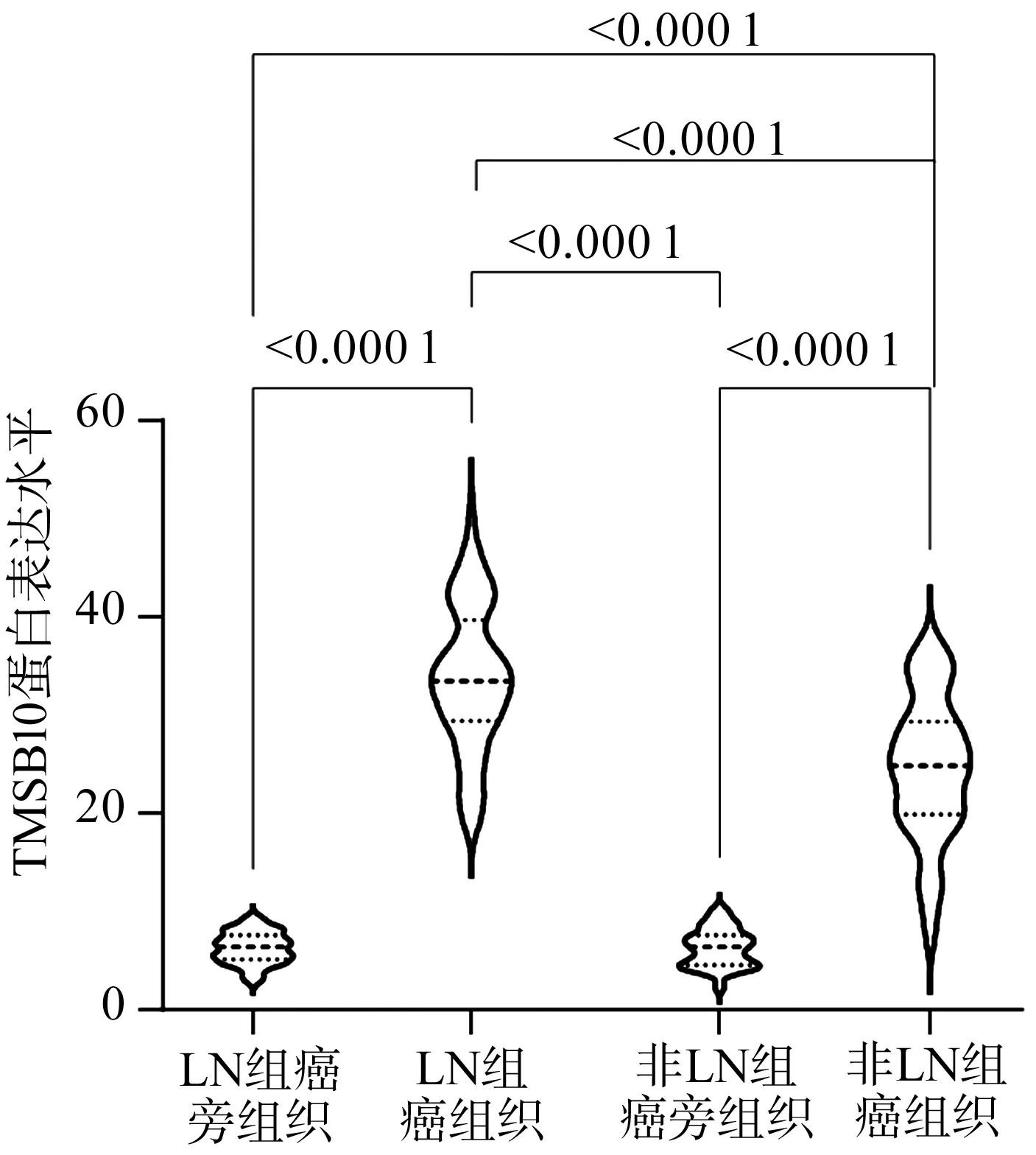
图1 患者TMSB10蛋白表达水平
2.3 影响胃癌患者淋巴结转移的危险因素分析
将表1及图1中差异有统计学意义的因素进行赋值后带入Logistic方程后分析,结果显示,肿瘤浸润至浆膜层(OR=3.607)、组织学分型为未分化型(OR=1.098)、合并溃疡(OR=3.824)及TMSB10高表达(OR=1.143)是导致胃癌患者出现淋巴结转移的独立危险因素(P<0.05);限制性立方条图显示,TMSB10蛋白表达水平与胃癌患者淋巴结转移风险呈显著线性关系(χ2=1.641,P>0.05),见表2、表3、图2。

图2 TMSB10蛋白表达水平与患者淋巴结转移风险的相关性
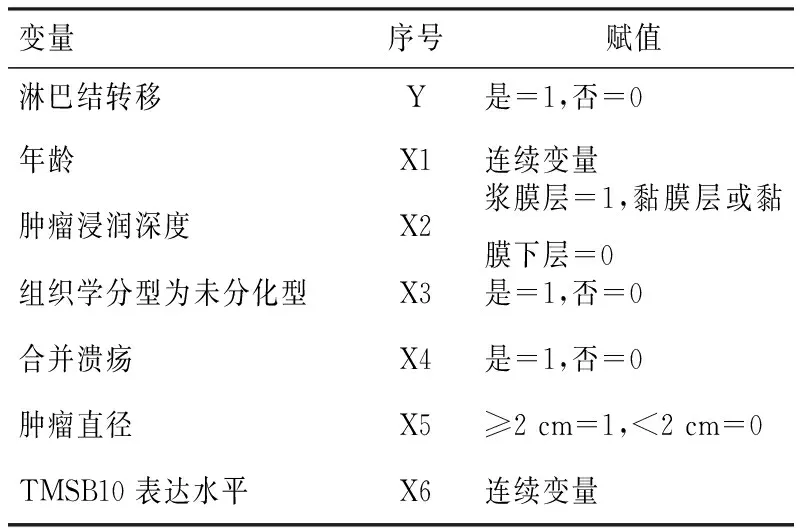
表2 相关因素赋值表

表3 影响胃癌患者淋巴结转移的Logistic回归分析
2.4 不同TMSB10蛋白表达水平患者早期进展风险
以120例胃癌患者TMSB10蛋白表达中位数29.31为界值,绘制生存分析曲线,结果显示,TMSB10高表达组患者术后早期进展风险明显高于TMSB10低表达组(Log-rankχ2=7.102,P=0.008),见图3。

图3 不同TMSB10蛋白表达水平患者生存曲线
3 讨论
β-胸腺素家族最初是从胸腺中鉴定出来的,主要包括胸腺素β4(TMSB4)、TMSB10和TMSB15[9],其在调节F-肌动蛋白的形成、抗炎、组织发育再生以及诱导胰岛素分泌方面起关键作用[10]。有研究表明,β-胸腺素家族参与了肿瘤的发生和进展,其中TMSB4在乳腺癌、结直肠癌和其他类型的癌症中充当致癌基因[11]。但对于TMSB10在癌症进展中起致癌还是抑癌作用尚不清楚。有研究显示,TMSB10在乳腺癌、甲状腺乳头状癌、肝细胞癌中过表达,并参与癌症的进展[12-13]。也有研究显示,TMSB10过表达能够抑制癌细胞增殖,并诱导胆管癌和卵巢癌细胞凋亡[14]。目前,TMSB10在胃癌中的作用及其对于预后的影响尚不明确。
本研究结果显示,肿瘤浸润至浆膜层、组织学分型为未分化型、合并溃疡及TMSB10高表达是导致胃癌患者出现淋巴结转移的独立危险因素。肿瘤浸润至浆膜层说明肿瘤已经到进展期,浸润深度较深,极易转移至胃周淋巴结。未分化型的肿瘤异型性较高,侵袭力较强,早期出现淋巴结转移的可能性大,且分化程度越低,患者出现淋巴结转移的时间越早,预后越差。研究显示,胃癌合并胃溃疡的患者早期淋巴结转移率明显高于无溃疡者,但其机制尚不明确[15]。关于TMSB10表达水平与胃癌细胞早期出现淋巴结转移之间的关系,研究表明,人为沉默TMSB10能够抑制胃癌细胞迁移、侵袭和血管生成[16]。TMSB10作为肌动蛋白结合蛋白,含有40~44个氨基酸残基,具有多种生理功能,如抑制炎症和骨髓干细胞增殖,增加金属蛋白酶的活性,促进肿瘤血管生成等,其作用机制可能与TMSB10作用于Ras系统有关[17]。研究指出,TMSB10通过抑制Ras系统进一步干扰肌动蛋白的聚合,从而调控肌动蛋白的运动,TMSB10促进肿瘤的转移可能是通过抑制Ras相关蛋白和肌动蛋白聚合,导致细胞连接丧失,进而促进肿瘤细胞扩散[18]。
相关研究表明,TMSB10的mRNA在许多肿瘤组织中呈高表达状态[19]。有研究报道,TMSB10在肺癌、肝癌、食管癌和结肠癌等多种恶性肿瘤组织中高表达,且与肿瘤的转移及侵袭密切相关[20]。同时,TMSB10在肿瘤转移、血管生成、细胞凋亡和创伤愈合等多种生理病理过程中发挥重要作用,能够影响癌症患者的预后[21]。本研究对行胃癌根治术的患者进行了12个月的随访,观察其是否出现进展,结果发现,TMSB10高表达组患者术后早期进展风险明显高于TMSB10低表达组,进一步证实了TMSB10高表达能够促进肿瘤细胞增殖转移。一项动物试验显示,敲除TMSB10会抑制大鼠早期胃癌细胞的增殖、迁移和侵袭,而过表达TMSB10则结果相反[22]。另有研究表明,抑制TMSB10可通过激活体内外AKT/FOXO信号通路抑制胃癌细胞的增殖和侵袭[23]。因此,TMSB10高表达为胃癌早期进展创造了有利的环境。
本研究为单中心研究,样本量有限,后期仍需要增大样本量,进行多中心进行论证;另外,本研究随访时间较短,TMSB10对患者总生存期以及远期进展的影响仍需进一步探讨。
综上所述,TMSB10在胃癌组织中高表达能够增加患者淋巴结转移的风险,且与胃癌患者术后早期进展高度相关。