茎瘤芥BjuEAR1-1的克隆与表达分析
程春红,游经番,蔡兆明,叶春宏,陈 丽
(长江师范学院 生命科学与技术学院,重庆 408100)
茎瘤芥(Brassicajunceavar.tumidaTsen et Lee)隶属双子叶植物纲十字花科芸苔属。茎瘤芥的茎在生长发育的过程中会呈瘤状膨大,而它膨大的瘤状茎正是制作榨菜的主要原料。榨菜在我国涪陵盛产,是我国出口国外的世界级名腌菜。涪陵是茎瘤芥主产区,被誉为我国“榨菜之乡”[1-2]。然而,茎瘤芥在生长过程中常受到霜冻、盐渍化和干旱等非生物逆境胁迫的影响,严重制约榨菜的产量和质量。因此,挖掘茎瘤芥抗逆基因、创制耐逆稳产的茎瘤芥新品种迫在眉睫。
植物在生长发育过程中具有不可移动性,易受自然环境的影响,导致植物的生长发育受阻,产量下降。盐胁迫导致植物生长率降低、生长发育减缓、植株矮小、叶片干枯等。植物主要通过根系来实现养料的吸取和与外界的物质交换,植物遭受盐胁迫时,土壤盐分升高,水分减少,根系吸水能力下降,从而导致植物根系细胞渗透压下降[3]。盐胁迫也影响种子萌发,盐分浓度相对较低时植物种子的萌发率较高,而与之相反,盐分浓度较高时植物种子的萌发率较低[3-5]。
温度胁迫主要以低温胁迫为主,温度降低会使植物的产量也随之下降,有时甚至过低的温度还会使植物直接死亡。研究表明,低温胁迫造成植物体内叶绿体的亚显微结构发生改变和酶活性改变,直接影响植物的能量代谢,而植物的能量代谢又与植物的光合作用相关,所以低温环境将会给植物的光合作用带来影响,从而使植物光合作用速率下降。与此同时,低温胁迫也会影响植物的呼吸作用[6-7]。
脱落酸(Abscisic acid,ABA)参与植物休眠、脱落和种子萌发等生理过程,在植物对外界环境胁迫的响应中也起着极其重要的作用,如盐胁迫、低温、渗透压胁迫等非生物胁迫[8-11]。在非生物胁迫下植物激素脱落酸(ABA)可以通过促使植物落叶、气孔关闭和产生抗逆蛋白等方式来增强植株对非生物逆境胁迫的抵御能力,在植物抗逆过程中,ABA信号通路发挥重要作用[12-13]。在ABA核心的信号通路中,主要含有4个组分,即ABA受体PYR1/PYLs/RCARs、A类蛋白磷酸酶PP2C( Protein phosphatase 2C)、蛋白激酶SnRKs以及下游ABA响应因子如ABI5等[14-15]。当植物遭受逆境胁迫时,植物体内大量合成ABA,ABA与其受体结合并抑制蛋白磷酸酶PP2C的活性,从而释放对蛋白激酶SnRK2的抑制,蛋白激酶磷酸化下游的转录因子,从而调控ABA响应基因的表达,ABA信号通路开启,调节植物对逆境胁迫的响应[16-17]。
在拟南芥中研究表明,EAR1(ENHANCER OF ABA CO-RECEPTOR 1)在ABA信号通路中起着负调控作用,其突变体ear1-1在气孔运动、种子萌发以及幼苗根生长方面都表现出对ABA更为敏感的表型,表明EAR1在调控植物对外界非生物逆境胁迫的响应中具有重要作用[18-19]。
本研究在茎瘤芥中筛选到拟南芥EAR1的同源基因BjuEAR1-1以及BjuEAR1-2。对BjuEAR1-1以及BjuEAR1-2的CDS序列进行PCR扩增,可以扩增到BjuEAR1-1的CDS序列,因此,本研究将采用酶切酶连载体构建方法构建植物过表达载体 35S∷PTF101-GFP-BjuEAR1-1,采用烟草叶片瞬时转化技术对其编码蛋白的亚细胞定位进行分析,并对其启动子顺式作用元件进行分析,以及采用荧光定量PCR技术分析BjuEAR1-1在非生物逆境胁迫和不同组织器官中的基因表达模式。研究结果将初步明确BjuEAR1-1在茎瘤芥抗逆过程中的功能,为进一步探究BjuEAR1-1的生物学功能奠定研究基础。
1 材料和方法
1.1 试验材料
本试验所需的茎瘤芥主栽品种永安小叶和本氏烟草由重庆市长江师范学院提供,KOD FX高保真酶购自TOYOBO公司。RNA提取试剂盒、RNA反转录试剂盒、PCR产物回收试剂盒、质粒提取试剂盒购自杭州新景生物试剂开发有限公司。限制性内切酶购自赛默飞世尔(中国)有限公司。
1.2 试验材料的培养
以永安小叶为试验材料,对田间生长的茎瘤芥(六叶期,生长1.5月苗)进行取样,所取样品为茎瘤芥的根、茎和叶;对田间生长的茎瘤芥(膨大旺盛期,生长4.5月苗)进行取样,所取样品为茎瘤芥的膨大瘤茎;对田间生长的茎瘤芥(抽薹开花期,生长5.5月苗)进行取样,所取样品为茎瘤芥的花和种荚。将生长条件为16 h/8 h(光照/黑暗),22 ℃的培养室中在MS培养基上生长7 d的茎瘤芥幼苗施加低温(4 ℃)、50 μmol/L ABA和100 mmol/L NaCl 3种逆境胁迫处理,3 h后进行取样,设置对照试验(水处理3 h)。低温处理即将茎瘤芥幼苗贴苗至铺有滤纸的培养皿中(水充分浸湿滤纸),分别置于培养室和4 ℃冰箱中,3 h后进行取样;50 μmol/L ABA处理即将茎瘤芥幼苗贴苗至铺有滤纸的培养皿中(分别用水和50 μmol/L ABA溶液充分浸湿滤纸),置于培养室中,3 h后进行取样;100 mmol/L NaCl处理即将茎瘤芥幼苗贴苗至铺有滤纸的培养皿中(分别用水和100 mmol/L NaCl溶液充分浸湿滤纸),置于培养室中,3 h后进行取样。采用锡箔纸取样,将各个处理的茎瘤芥幼苗迅速吸干水分后在液氮中速冻后置于-80 ℃条件下保存,以便后续基因表达分析使用。
1.3 试验方法
1.3.1BjuEAR1-1基因克隆及载体构建 在芸薹属数据库(http://brassicadb.cn/#/)中下载BjuEAR1-1基因序列(BjuB013004),其蛋白编码序列CDS长度为1 410 bp。参照BjuEAR1-1基因片段以及35S∷PTF101-GFP载体多克隆位点两侧序列,在软件Primer 5上对BjuEAR1-1基因序列进行引物设计,上游引物Primer F(SmaⅠ双下划线所示序列):CCCGGGATGATGGCTTGTGGCTTAAGCAAG(双下划线所示序列为限制性酶切位点);下游引物Primer R(BamH Ⅰ):GGATCCTGAAGTGGCAATGCAAAAAGCCTC(双下划线所示序列为限制性酶切位点),送至华大基因进行引物合成。使用艾德莱生物的EASY spin植物RNA快速提取试剂盒按其说明进行永安小叶的RNA提取,接着使用艾德莱生物的TRUEscript 1st Strand cDNA Synthesis Kit With gDNA Eraser试剂盒按其说明对提取的永安小叶RNA进行反转录得到cDNA,最后以cDNA为模板进行PCR扩增,使用上海生工生产的胶回收试剂盒进行PCR产物的纯化回收,将BjuEAR1-1的CDS序列连接到T载体。提取测序正确的BjuEAR1-1-T与大载体35S∷PTF101-GFP质粒,对BjuEAR1-1-T与大载体35S∷PTF101-GFP质粒进行双酶切,选用Thermo Scientific Fast Digest快切酶进行酶切反应。按照T4DNA连接酶体系进行连接反应,连接产物转化大肠杆菌 DH5α感受态,菌落PCR和酶切鉴定正确后,35S∷PTF101-GFP-BjuEAR1-1载体构建完成。
1.3.2 茎瘤芥BjuEAR1-1蛋白亚细胞定位分析 将构建成功的35S∷PTF101-GFP-BjuEAR1-1载体转化到农杆菌GV3101菌株中,将鉴定正确的菌株在28 ℃条件下摇培过夜,3 000 r/min离心10 min收集菌体。10 mmol/L MgCl2重悬菌体,吹吸混匀后,3 000 r/min离心10 min,弃掉上清液。用10 mmol/L MgCl2重悬菌体,至OD600=0.2~0.3,加AS至终浓度为200 μmol/L,室温下静置2 h。挑选烟草植株中部较大符合浸染条件的叶片,将注射器拔掉针头吸取菌液,选择无主叶脉的位置,缓慢注射转化菌液。注射后的烟草在光下继续培养48 h后,用荧光显微镜观察烟草表皮细胞,确定BjuEAR1的亚细胞定位情况。
1.3.3 启动子顺式作用元件分析 选取BjuEAR1-1基因序列ATG上游2 kb片段作为启动子序列,采用New PLACE(https://www.dna.affrc.go.jp/PLACE/?action=newplace)在线启动子分析软件,对茎瘤芥BjuEAR1-1基因启动子上的顺式作用元件进行分析。
1.3.4BjuEAR1-1在不同组织器官中表达模式分析 为探究BjuEAR1-1在茎瘤芥中的组织器官表达模式,对茎瘤芥的不同组织器官即根、茎、叶、花、种夹和膨大茎进行RNA提取,反转录为cDNA,采用荧光定量PCR技术分析BjuEAR1-1基因在不同组织器官中的时空表达模式,以BjuACTIN3作为内参基因,试验进行3次生物学重复,每次每个样品3次重复。
1.3.5BjuEAR1-1在非生物逆境胁迫处理下表达模式分析 为验证BjuEAR1-1是否参与调控茎瘤芥对逆境胁迫的响应,对萌发7 d的茎瘤芥(永安小叶)幼苗分别施加低温(4 ℃)、50 μmol/L ABA和100 mmol/L NaCl的胁迫处理,并于处理后3 h取样,将从茎瘤芥中提取得到的RNA进行反转录成为cDNA后,通过荧光定量PCR检测BjuEAR1-1基因表达情况,从而分析BjuEAR1-1在逆境胁迫处理下的表达模式。
2 结果与分析
2.1 茎瘤芥BjuEAR1-1基因的克隆及载体构建
提取茎瘤芥(永安小叶)总RNA,反转录得到cDNA后,通过PCR技术扩增得到BjuEAR1-1目的片段(图1-A),回收纯化目的片段连接到T载体上,将连接产物转化入大肠杆菌感受态DH5α(图1-B),将转化子用2×Taq Master Mix进行菌落PCR鉴定,选取2~3个阳性重组克隆进行序列测序(图1-C)。选择相应的限制性内切酶分别对测序成功的BjuEAR1-1-T载体及目的载体35S∷PTF101-GFP进行双酶切,回收酶切后的目的片段和线性化目的载体(图2-A),用T4DNA连接酶连接,连接产物转化大肠杆菌DH5α后对抗性平板上长出的阳性克隆菌落进行菌落PCR扩增鉴定(图2-B),将PCR阳性单克隆摇培过夜。收集培养后的菌体提取质粒,进行酶切鉴定,能够切下目的条带说明载体构建成功(图2-C)。
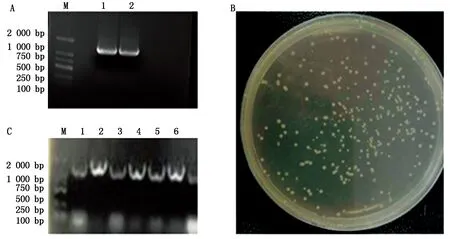
A.茎瘤芥BjuEAR1-1基因CDS序列扩增结果图:M.DL2000 DNA Marker;1—2.BjuEAR1-1基因CDS序列扩增。B.BjuEAR1-1-T转化子平板筛选图。C.BjuEAR1-1-T菌落PCR鉴定图:M.DL2000 DNA Marker;1—6.BjuEAR1-1-T菌落PCR鉴定结果。
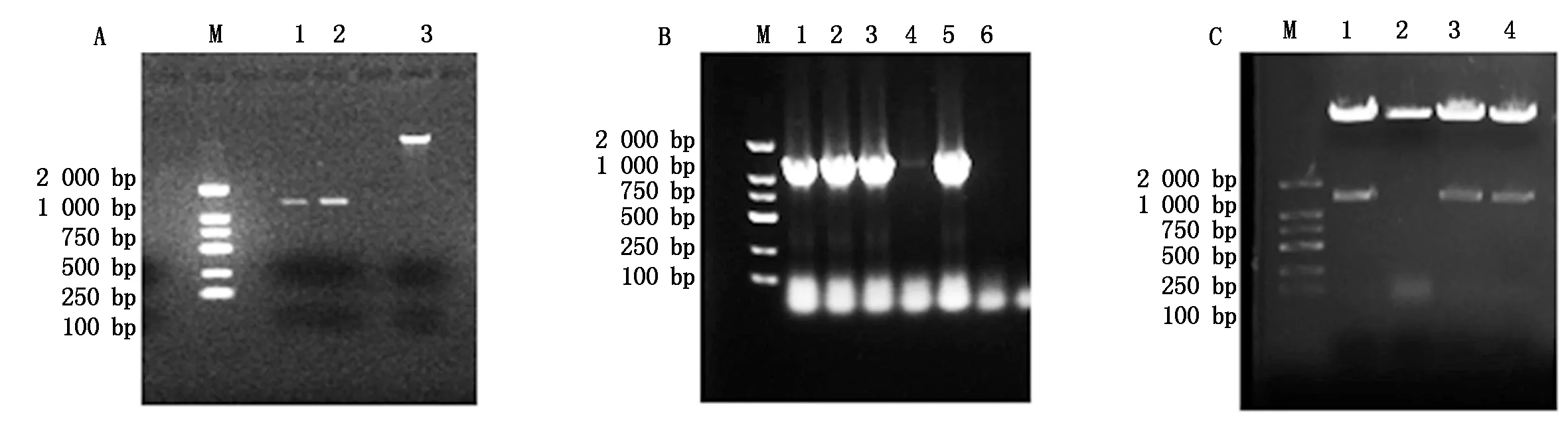
A.BjuEAR1-1-T和35S∷PTF101-GFP双酶切后目的片段胶回收检测图:M.DL2000 DNA Marker;1—2.BjuEAR1-1-T双酶切后目的片段回收;3.35S∷PTF101-GFP双酶切后目的片段回收。B.35S∷PTF101-GFP-BjuEAR1-1菌落PCR检测:M.DL2000 DNA Marker;1—6.菌落PCR凝胶检测。C.35S∷PTF101-GFP-BjuEAR1-1酶切鉴定:M.DL2000 DNA Marker;1—4.35S∷PTF101-GFP-BjuEAR1-1质粒酶切鉴定。
2.2 茎瘤芥BjuEAR1-1蛋白亚细胞定位分析
将构建成功的35S∷PTF101-GFP-BjuEAR1-1表达载体转化到农杆菌感受态GV3101菌株中,对阳性单克隆进行PCR鉴定,筛选可以扩增到目的条带的阳性单克隆。利用农杆菌介导的烟草叶片瞬时转化技术,在烟草叶片中观察BjuEAR1-1蛋白亚细胞定位情况,结果表明,在烟草细胞的细胞核和细胞质中均能检测到绿色荧光信号,表明BjuEAR1-1在细胞核和细胞质中发挥生物学功能(图3)。

图3 BjuEAR1-1蛋白亚细胞定位分析Fig.3 Subcellular localization analysis of BjuEAR1-1
2.3 茎瘤芥BjuEAR1-1启动子顺式作用元件分析
为了研究BjuEAR1-1基因在茎瘤芥中的功能,选取BjuEAR1-1基因序列ATG上游2 kb片段作为启动子序列,对茎瘤芥BjuEAR1-1基因启动子上的顺式作用元件进行分析,结果如图4所示,在BjuEAR1-1启动子上含有干旱响应元件MBS、MYBATRD22和LTRECOREATCOR15,脱水响应元件ACGTATERD1,盐胁迫响应元件GT1GMSCAM4,脱落酸响应元件ABRE、MYB2CONSENSUSAT、MYB1AT和DPBFCOREDCDC3,赤霉素响应元件WRKY71OS、MYBGAHV、GAREAT和GARE1OSREP1,生长素响应元件SURECOREATSULTR11,乙烯响应元件ERELEE4,茉莉酸甲酯响应元件CGTCA-motif和TGACG-motif(图4)。研究结果表明,BjuEAR1-1基因可能既参与了非生物胁迫的响应又参与了植物激素应答。

图4 BjuEAR1-1启动子顺式作用元件分析Fig.4 The cis-acting elements analysis of BjuEAR1-1 promoter
2.4 茎瘤芥BjuEAR1-1组织器官表达模式分析
利用荧光定量PCR法对BjuEAR1-1在茎瘤芥不同发育阶段的根、茎、叶、花、种荚和膨大茎中的表达模式进行分析,结果如图5所示。由图5可知,BjuEAR1-1在不同组织器官中均有表达,并且在根、茎、叶和种荚中的表达水平非常高,然而在膨大茎中表达量却很低。说明BjuEAR1-1可能调控瘤茎的膨大。
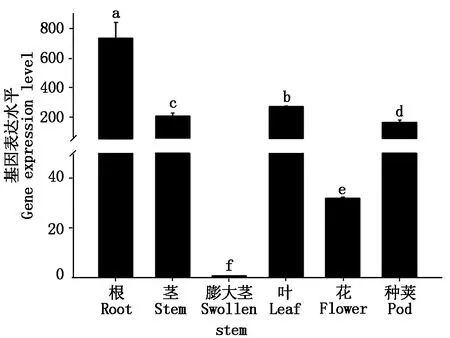
不同小写字母表示各个处理之间在0.05显著水平上存在显著性差异。图6同。The different normal letters indicate significant difference between treatments at the 0.05 level.The same as Fig.6.
2.5 茎瘤芥BjuEAR1-1在不同胁迫处理下基因表达模式分析
对萌发7 d的茎瘤芥(永安小叶)幼苗分别施加低温(4 ℃)、50 μmol/L ABA和100 mmol/L NaCl的胁迫处理,在处理后3 h进行取样,提取茎瘤芥的RNA反转录成为cDNA后,进行荧光定量PCR检测BjuEAR1-1基因表达情况。由图6可知,与对照组相比,ABA和低温均能显著诱导BjuEAR1-1表达(P<0.05),而NaCl处理下BjuEAR1-1的表达水平与对照组没有显著差异。表明茎瘤芥BjuEAR1-1的表达受ABA和低温的显著诱导。
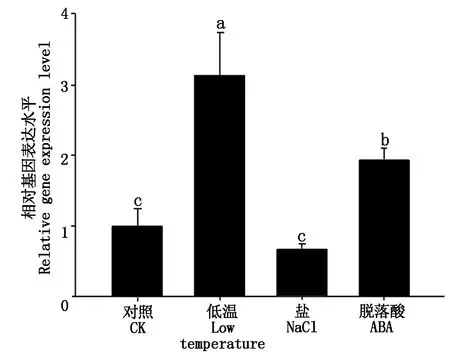
图6 不同胁迫处理下BjuEAR1-1的表达分析Fig.6 Expression analysis of BjuEAR1-1 under different stresses treatment
3 结论与讨论
本研究在茎瘤芥中克隆获得一个新的基因,根据生物信息学的分析,该基因属于EAR1家族,因此将其命名为BjuEAR1-1。BjuEAR1-1在拟南芥中的同源基因为AT5G22090,根据以往的研究结果,AT5G22090在植物抗逆过程中起着重要作用,而BjuEAR1-1是其在茎瘤芥中的同源基因,由此推测BjuEAR1-1在茎瘤芥抗逆过程中也具有一定的生物学功能。
启动子顺式作用元件的存在可以为基因在转录水平上调控机制的研究提供线索。如水稻转录因子OsOFP家族基因的组织表达分析表明,该家族基因可能参与水稻生长发育的全过程,特别是种子发育的调控[20]。本次试验对BjuEAR1-1基因启动子上顺式作用元件进行分析,发现启动子区含有参与应答脱落酸反应的顺式作用元件,表明该基因的表达可能受ABA的调控。此外,还发现了赤霉素应答元件、乙烯响应元件等,表明了BjuEAR1-1基因可能在激素信号通路中扮演着重要的角色。同时BjuEAR1-1基因的启动子区域中还有与逆境胁迫相关的顺式作用元件,表明该基因可能参与植物对非生物胁迫的响应。进而对BjuEAR1-1在不同胁迫处理下的基因表达模式进行了分析,研究发现,低温和ABA均能诱导该基因显著表达,表明BjuEAR1-1在茎瘤芥响应非生物逆境胁迫过程中具有一定的生物学功能。
榨菜的原材料来自茎瘤芥的膨大茎,且植物主要在根系吸取养料并进行物质交换,所以根是植物能正常生长的重要条件。拟南芥EAR1(Enhancer of ABA co-receptor 1,AT5G22090)在幼苗的根、萌发的种子、花器官、叶肉细胞以及保卫细胞中都有表达,并且在各个器官中表达量差异不大[18]。而本研究中,通过荧光定量PCR技术来检测在茎瘤芥幼苗不同组织器官中BjuEAR1-1的表达水平,发现BjuEAR1-1在茎瘤芥各个组织器官中均有表达,这与拟南芥中EAR1的表达一致,然而BjuEAR1-1在茎瘤芥各个组织器官中的表达量却有显著差异,BjuEAR1-1在茎瘤芥的根和茎中高表达,在膨大茎中表达量却极低,表明BjuEAR1-1可能调控植物的生长发育,尤其是对根的发育以及瘤茎膨大的过程。
蛋白质的亚细胞定位对于研究蛋白的生物学功能具有重要作用,细胞内的蛋白质需要运送至正确的位置才能行使其生物学功能。拟南芥EAR1大部分定位于内质网上,少部分蛋白定位于细胞核内[18]。而本研究中,茎瘤芥BjuEAR1在细胞质和细胞核内均有定位,表明茎瘤芥BjuEAR1在细胞质和细胞核内行使其生物学功能。
综上所述,本研究对BjuEAR1-1的蛋白编码序列进行了克隆,通过分析发现,BjuEAR1-1的启动子中含有响应激素、非生物胁迫的顺式作用元件。通过基因表达分析,发现BjuEAR1-1在不同组织器官即根、茎、叶、花、种荚、膨大茎中均有表达,但在根中的表达量极高,并且BjuEAR1-1受低温和ABA显著诱导表达。结果表明,BjuEAR1-1在器官发育和植物逆境胁迫响应中具有一定功能,研究结果为全面了解BjuEAR1-1的生物功能奠定了基础,为培育耐逆稳产的茎瘤芥新品种提供了理论依据。

