可溶性盐浓度影响南瓜幼苗生长和荧光响应特性
李嘉炜,陈 潇,常静静,宋 钊,何裕志,张白鸽
(广东省农业科学院蔬菜研究所,广东省蔬菜重点实验室,广州 510640)
0 引言
穴盘育苗以低成本、壮根好、省工省力等优点,在现代蔬菜育苗上有着广泛的应用[1],但在大规模应用上,由于浇水施肥等难以避免的人为因素影响,穴盘中央与边缘长势相差大,边际效应明显[2]。穴盘育苗应用最多的基质是草炭,但这种基质为不可再生资源,过度开采会破坏生态环境[3-5]。近年来出现了可以完全去掉传统工厂化育苗中基质使用的新育苗技术—无基质营养液育苗。该技术采用营养液栽培,使幼苗根系完全生长在营养液中[6]。这种育苗方法克服了传统穴盘基质育苗的弊端,并且苗齐、苗壮、发育快、易调控[7]。但由于无基质营养液育苗完全改变了传统穴盘育苗的水肥供给方式,幼苗根系直接处于营养液中,对营养液可溶性盐浓度(EC)的要求有别于传统育苗,因此,研究EC对无基质南瓜育苗的影响对无基质营养液南瓜育苗的应用有重要意义。研究证明,植物根系所需的最适营养液浓度并不是传统穴盘育苗研究中的浇灌浓度,而是由根系周围养分含量决定的[8]。传统穴盘育苗浇灌营养液的方式,植株根际养分含量远远高于所浇灌的营养液浓度[9]。实验发现,黄瓜栽培的最适浇灌营养液浓度为2.5 ms/cm,而土壤的电导率却高达5.41 ms/cm。如今营养液栽培在蔬菜成苗后的栽培体系已经很成熟[10-14],在南瓜栽培上的应用也有较多研究[15-16]。关于营养液浓度对基质育苗的研究也有一些[17-19],但对于完全由营养液进行育苗的研究较少,且鲜有关于南瓜方面的研究。而且,在当前数字农业发展的需求下,集约化育苗产业领域逐步应用了各种各样的表型获取技术[20],比如叶绿素荧光就是利用植物体内叶绿素a为天然探针,探测外界因子对植物光合作用影响信息的一项高新技术[21],它能无损地对植物的光合作用状态进行全面的检测,植物的各种生理状况几乎都能通过叶绿素荧光来体现[22]。研究证明叶绿素荧光对不同营养液浓度下黄瓜的光合特性有较好的相关性[23]。如果能将叶绿素荧光应用在育苗领域上,更早更全面的感知和调控种苗的光合信息,对自动化育苗有很大的意义。但叶绿素相关参数的生理意义还不明确,在监测南瓜生长上的应用也鲜有研究。据此,本实验以香蜜小南瓜品种南瓜作为材料,采用了5种各养分比例相同但浓度不同的营养液配方进行培养,通过测量南瓜幼苗的表型数据系统分析不同EC值对南瓜幼苗的具体影响,同时探讨叶绿素荧光的不同参数对EC诊断的有效性,为叶绿素荧光设备检测到的数据赋能,为无基质营养液育苗技术指导提供理论依据。
1 材料与方法
1.1 试验安排
试验于2021年1月—2021年3月在广东农业科学院蔬菜所栽培基础实验室的人工气候培养箱中进行。供试品种为‘香蜜’小南瓜。
对南瓜种子进行催芽使其长出根后,用定制棉将种子轻微夹住,露出下面的根,然后将该定制棉下半部分塞进装满纯水的50 mL离心管,保证种子根部能接触到水。放进人工气候箱中培养,气候箱设置为12 h光照、32℃、湿度55%,待子叶完全展开并露出第一真叶后,连着定制棉将苗转移进装有相应营养液的250 mL塑料瓶中,人工气候箱设置为12 h光照、20℃、55%湿度。之后每个处理选一棵代表性植株,每两天进行一次拍照观察生长速度。培育10天后,进行取样和测量数据
1.2 试验处理
营养液配制方法:提前配好A、B营养液100倍母液分别储存与A、B罐子中,每次从A、B罐子中吸取母液配制8倍浓度营养液[Ca(NO3)232 mmol/L、KNO340 mmol/L、(NH4)H2PO48 mmol/L、MgSO48 mmol/L、Fe-EDTA 120 μmol/L、H3BO3200 μmol/L、MnSO480 μmol/L、CuSO48 μmol/L、ZnSO440 μmol/L、(NH4)Mo7O240.56 μmol/L],再用8倍浓度营养液分别配置成5种梯度浓度的营养液,用磷酸调整pH为6.3~6.6,200 mL/株,各处理营养液的EC分别为2.5、5.0、7.5、10.0、12.5 ms/cm,每处理4个重复,共20个样品。
1.3 生长指标测定
每7天各处理选取1株具有代表性的植株,采用表型分析仪(MAXI-IMAGING-PAM)进行拍照,并利用仪器自带分析工具进行冠层投影面积计算。
在南瓜幼苗成长到两叶一心期,利用直尺测量株高(茎基部到生长点),用游标卡尺测量茎粗(茎基部),将植株叶、茎、根利用万分之一天枰分别称量鲜重,然后放进烘箱进行杀青风干后,分别称量干重。
1.4 叶面数据分析及根系形态分析
在南瓜幼苗成长到两叶一心期,将植株叶片剪下并放入叶面扫描分析仪进行扫描分析,并利用软件自带分析系统测出叶面相关数据,具体包括叶面积、叶周长、叶绿素参考值等
将植株根部剪下并放入根系扫描分析仪进行扫描分析,并利用软件自带分析系统测出根系相关数据、具体包括根长、根表面积、根体积、根尖数。
1.5 叶绿素荧光数据测定
在南瓜幼苗成长到两叶一心期,利用叶绿素荧光仪测定叶绿素荧光,选择第二片真叶,测定前将叶片暗适应1 h,测定时间为9:00—11:00。利用仪器自带软件自动计算各项叶绿素荧光参数。
1.6 数据分析
利用SPSS进行方差差异显著性分析。利用Origin来做快速光曲线拟合。
2 结果与分析
2.1 EC对南瓜幼苗生物量的影响
EC值对南瓜幼苗生物量影响显著。南瓜幼苗各器官生物量积累随EC值变化均呈现先增长后下降的趋势,并且都在EC值为5 ms/cm时达到最大值,不过EC为5时其生物量积累与EC为2.5时无显著差异。当EC为7.5 ms/cm时,除根干重外,其各器官生物量已经开始要低于EC值为2.5 ms/cm时的生物量。但各器官生物量积累随EC值影响的大小有所不同,在EC值为12.5 ms/cm时,南瓜幼苗的叶鲜重和叶干重分别比EC值为5时减少了50.9%和49.8%,茎鲜重和茎干重分别比EC值为5时减少了43.4%和39.4%,根鲜重和根干重分别比EC值为5 ms/cm时减少了28.6%和32.6%,南瓜幼苗叶生物量积累对EC值变化最敏感,其次为茎生物量积累,而根生物量积累对EC值变化最不敏感。计算出各处理干重根冠比,发现根冠比随EC浓度的增加而增大,证明高EC对地上部生物量影响要明显大于地下部生物量(表1)。

表1 南瓜幼苗在不同浓度营养液中的生物量及根冠比
2.2 EC值对南瓜幼苗基本表型的影响
EC值对南瓜幼苗株高影响无显著差异,EC值为5 ms/cm时株高最高;南瓜幼苗茎粗随EC值增长呈下降趋势,且EC值为12.5 ms/cm时,与EC值为2.5、5 ms/cm时有显著差异,茎粗分别比2.5 ms/cm和5 ms/cm下降了32.8%和30.1%。EC值对南瓜幼苗的壮苗指数有显著差异,壮苗指数随EC值增长呈现先上升后下降的趋势,并在EC值为5 ms/cm时达到最大值,在EC值为10 ms/cm以后,壮苗指数开始比EC值为2.5 ms/cm时低,EC值为10 ms/cm时的壮苗指数分别比EC值为2.5 ms/cm和5 ms/cm时小39.2%(表2)。
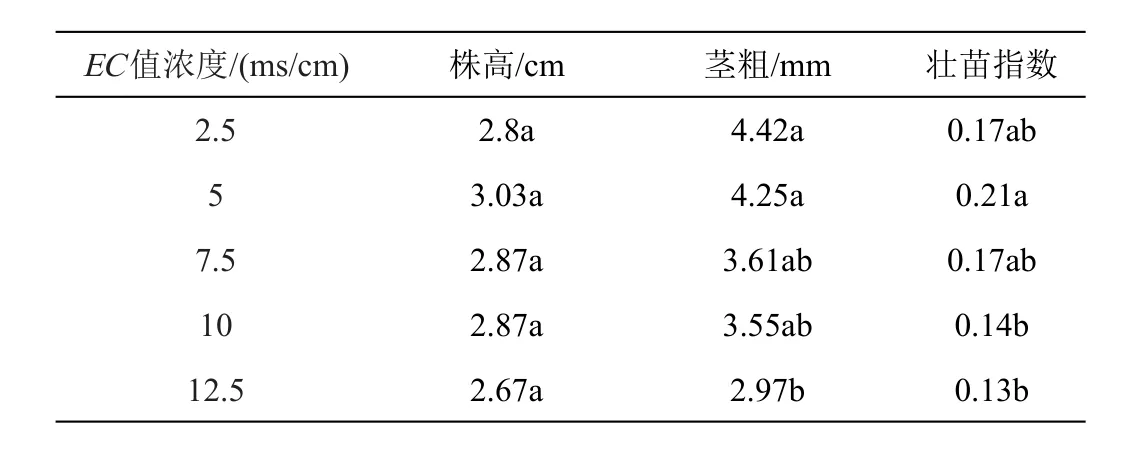
表2 南瓜幼苗不同浓度营养液基本表型数据
EC值对南瓜幼苗叶面积有显著影响,相似的,南瓜幼苗叶面积及叶总平均周长均随EC值增长呈现先上升后下降的趋势,并同样在EC为5 ms/cm时总叶面积达到最大值,EC为7.5 ms/cm时的总叶面积已经显著小于EC为2.5 ms/cm的总叶面积,小了18.7%。叶绿素参考值除EC为2.5 ms/cm时显著比EC为5 ms/cm时低外,其他均无显著差异。EC为5 ms/cm时,除叶绿素参考值外,其各项表型数据与EC为2.5 ms/cm时均无显著差异(图1)。

图1 南瓜幼苗不同浓度营养液的叶片相关参数
2.3 EC对南瓜幼苗根系及营养液吸收能力的影响
EC对南瓜幼苗根系影响差异显著,各项根系扫描指标均随EC值增长呈现先上升后下降的趋势,且都在EC为5 ms/cm时达到最大。除EC为5 ms/cm以外,其余3个高浓度的根系数据均与EC为2.5 ms/cm时无显著差异。EC为10 ms/cm时,根表面积、根体积和根尖数开始与EC值为5 ms/cm时有显著差异,分别比EC值为5 ms/cm时下降了23.5%、38.2%和26.9%,但根长无显著差异,只下降了14.7%。说明EC值对根系表型的影响主要体现在根分生上(图2)。
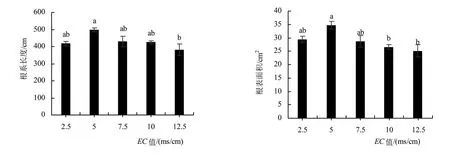
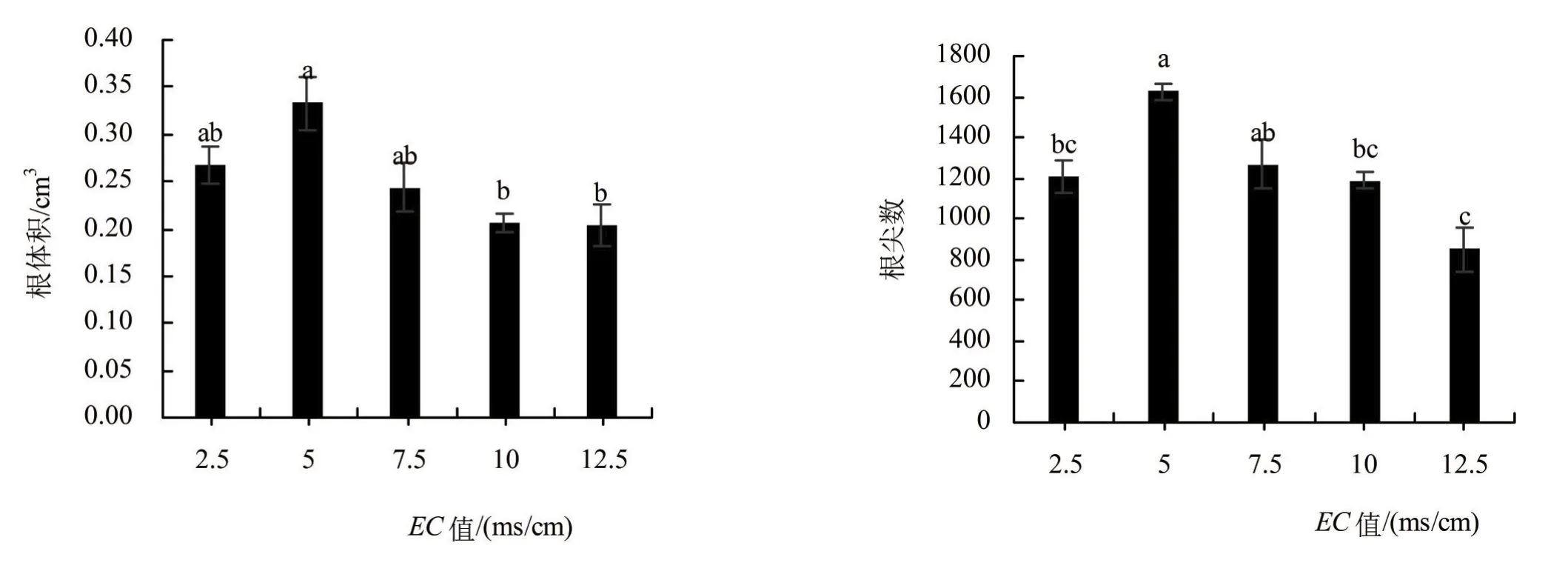
图2 南瓜幼苗不同浓度营养液的根系形态参数
2.4 EC对南瓜幼苗生长速度的影响
从南瓜幼苗两片子叶展开后,每隔2天进行拍摄,发现EC对南瓜幼苗生长速度有明显影响,且在EC为5 ms/cm时生长速度最快,EC为5 ms/cm和7.5 ms/cm的南瓜幼苗在进入两叶一心期和三叶一心期的时间分别为第4天和第8天;EC为2.5 ms/cm的南瓜幼苗进入两叶一心期和三叶一心期的时间分别为第6天第9天;EC为10 ms/cm的南瓜幼苗进入两叶一心期的时间分别为第7天和第10天;EC为12.5 ms/cm进入两叶一心期的时间为第8天(图4)。

图3 南瓜幼苗不同浓度营养液的根系扫描照片

图4 南瓜幼苗不同浓度营养液的生长图片
2.5 EC对快速光曲线指标的影响
快速光响应曲线,即通过叶绿素荧光仪测定不同光照度下叶绿素的电子传递速率或相对电子传递速率(rETR)并制成曲线进行评价[24-27]。
利用Origin来做快速光曲线拟合。其修正表达式为
通过对快速光曲线进行拟合,得到以下3个参数:快速光曲线初始斜率α,反映了光能利用效率。最小饱和光强IK,单位为μmol/(m2·s),反映了样品对强光的耐受能力。最大电子传递效率ETRmax,单位为μmol/(m2·s)。
由图5可以看出,5个处理的rETR差异不大,EC为12.5 ms/cm时的斜率明显要小于其他处理,说明EC为12.5 ms/cm时光能利用效率较低。而EC为2.5 ms/cm时曲线开始下降时的光强最小,表明此EC值下南瓜幼苗的强光耐受能力要低于其他处理。

图5 不同浓度营养液对南瓜幼苗快速光曲线的影响
对快速光曲线进行拟合,得到最大潜在相对电子传导速率(rETRmax)、半饱和光强(IK)、初始斜率(α)反映PSII电子传导信息的参数。可以看出不同EC对南瓜幼苗的rETRmax无显著影响;而EC为12.5 ms/cm时的α相较与其他处理有一个明显的下降,但差异不显著;EC为12.5 ms/cm时的IK较其他处理有明显的上升,且与EC为2.5 ms/cm时的IK有显著差异。Fv/Fm在7.5 ms/cm前无明显差异,在7.5 ms/cm后开始有明显下降趋势(图6)。
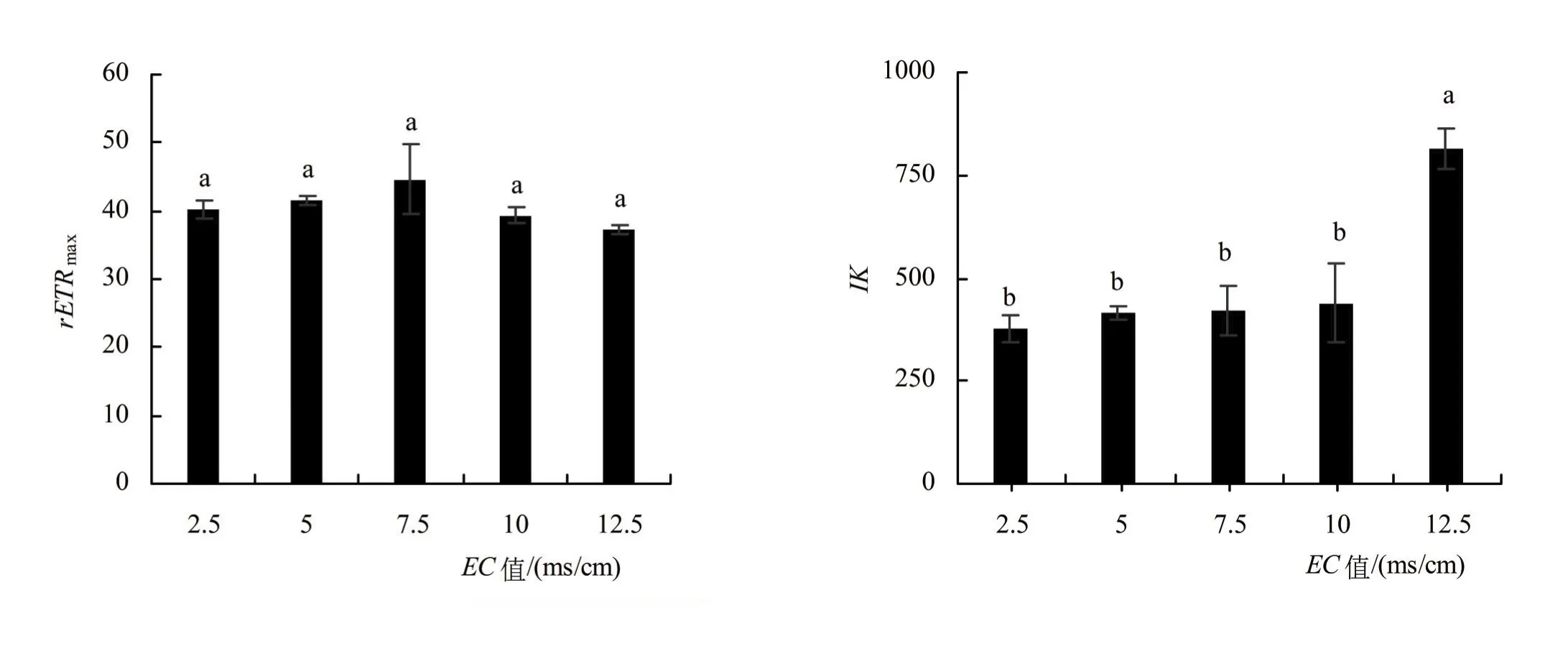

图6 南瓜幼苗不同浓度营养液的快速光曲线拟合参数及最大光合效率
2.6 EC对荧光参数的影响
反映的是光下叶片的实际光能转换效率;Y(NO)为非调节性能量耗散的量子产额,是光损伤的重要指标;Y(NPQ)为调节性能量耗散的量子产额,是光保护的重要指标。通过颜色标尺来判断对应参数的数值大小(小数值对应低频率颜色,大数值对应高频率颜色,颜色频率随数值增大而增大)。
Y(II)随着EC值的增长,呈现先上升后下降的趋势,并在EC为5 ms/cm时最高,EC为2.5 ms/cm时数值与10.0 ms/cm相当,EC值为12.5 ms/cm时Y(II)显著降低;Y(NO)随着EC值的增长,呈现先下降后上升的趋势,并在EC为5 ms/cm时达到最低,EC为2.5 ms/cm时数值与7.5 ms/cm相当,EC为12.5 ms/cm时Y(NO)显著增大;Y(NPQ)对EC变化不敏感(图7)。

图7 南瓜幼苗不同浓度营养液的叶绿素荧光参数成像图
3 讨论与结论
植株干鲜重能直观反映植株不同器官生物量和生长发育状况。在任瑞珍等[8]的研究中,随着营养液浓度的升高黄瓜幼苗生物积累量呈先升高后下降的趋势,并且在EC为3.3 ms/cm时生物量积累最优,根冠比差异不大。在韭菜实验中也观察到生物量积累随EC值升高而呈先升高后下降的现象[28]。本实验中南瓜幼苗各器官生物量随EC值升高均呈现先上升后下降的趋势,这与前人研究相一致。南瓜幼苗的在EC为5 ms/cm时生物量最大,比黄瓜的生物量最适EC3.3 ms/cm要大得多,可见南瓜幼苗对养分的需求要更大。南瓜的根冠比随EC值的增高而变大,这与黄瓜根冠比变化不一致,对南瓜幼苗各器官生物量进行对比可以发现,南瓜幼苗地上部与地下部对EC值敏感度存在明显差异,在EC较低至EC适合的区间,EC增大促进植株生物量的积累,且对地下部生物量积累的促进作用要大于地上部;而在EC适合至EC过高的区间,EC增大会抑制植株生物量的积累,且对地下部生物量积累的抑制作用要低于地上部,这暗示了在应对高EC胁迫时南瓜的反应与黄瓜存在差异。研究表明,EC值大小对黄瓜根系生长有显著影响,随着营养液浓度的升高,黄瓜幼苗的根体积、根系活力都有先上升后下降发展趋势[8]。本研究中南瓜根系指标也有相同的趋势。适宜EC的营养液可以促进南瓜幼苗根长增长,根毛数增多,根体积及根表面积的增大,过高EC抑制根系的生长,且主要表现在根毛数量上的抑制,对根长的影响较小。在本研究中,南瓜幼苗的生长速度随EC值增长,先升高后下降。有研究证明,高EC值会降低番茄对养分的吸收和分配,从而降慢番茄生长速度[29]。对本研究中南瓜幼苗营养液吸收量进行观察,确实与其生长速度具有一样的趋势,说明本实验中南瓜幼苗随EC值的变化也与番茄类似,EC值通过影响南瓜养分的吸收分配,从而影响生长速度的快慢。不过即使是在EC为12.5 ms/cm这种超量的EC环境下,南瓜幼苗除了生长速度明显慢于其他处理,叶面积明显小于其他处理外,没有表现出其他与大田栽培相似的因养分过量而造成的渗透胁迫造成叶片萎蔫的症状[30]。这可能与无基质营养液栽培时幼苗根部完全浸没于营养液中有关。
荧光图像和荧光参数是目前精准农业设备可以高通量获取的,但是目前对数据的解读需要室内的研究和反演[31]。本研究证明个别叶绿素荧光参数确实能直观反映EC值对植物的影响,Fv/Fm、Y(II)、Y(NO)以及快速光曲线随EC值的变化与南瓜幼苗的生物量参数及表型参数变化趋势一致(包括正向及反向),倪纪恒等[32]研究表明,轻微过量的养分供应能提高黄瓜单叶净光合效率,而从本研究发现,EC为7.5 ms/cm确实比最适EC5.5 ms/cm有更强的南瓜幼苗光能利用效率,而且即使到EC为10 ms/cm这种已经有点超量的养分,其光合能力才有略微下降,一直到EC为12.5 ms/cm这种超量的养分,其光合能力才开始有明显的下滑。周庐萍等认为高营养液电导率在高光照强度下有利于菊花种苗水分和养分的吸收,但光强强度降低时促进作用就会变得不明显[33]。而本实验中,在EC小于12.5 ms/cm,随着EC值的增加,南瓜幼苗半饱和光强呈上升趋势,推断在高光强环境下,高EC值营养液下的南瓜幼苗有可能比低EC值下的南瓜幼苗更有优势,需要进一步验证。
本研究探明了营养液EC值对南瓜幼苗表型的影响,南瓜幼苗的生长状况随着EC值的增大呈现先上升后下降的趋势,在EC值为5 ms/cm时生长最优,同时本研究证明叶绿素荧光参数能直观、快速地反映EC值对植物的影响。

