LPS对奶牛乳腺上皮细胞促炎症因子基因表达的影响
宋金婷,张金友,*,庄雨龙,李 伟,宋伟红,李长志
(1.黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319;2.黑龙江省农垦科学院畜牧兽医研究所,哈尔滨 150038)
乳腺炎是奶牛主要传染性疾病之一,严重影响产奶量和牛奶质量。乳腺炎会破坏牛奶合成组织,导致产奶量减少和牛奶成分改变。根据疾病的持续时间和严重程度,受感染奶牛的生产性能可能会在哺乳周期的剩余时间内下降[1]。研究表明,乳腺上皮细胞除了具有乳汁合成和分泌的功能之外,还在先天性免疫防御过程中发挥着不可替代的作用。先天免疫系统被认为是机体对抗感染的第一道防线,在受到感染的早期阶段能够及时作出免疫识别和反应[2]。在奶牛乳腺中,先天性免疫主要采取的是非特异性防御机制,包括乳头孔封闭、吞噬细胞(如中性粒细胞和巨噬细胞)、可溶性因子(如乳铁蛋白和细胞因子)等免疫防御方式。当机体受到感染,在先天性免疫机制无法满足抵御病原体入侵需要的情况下,机体才会激活并启动第二个层级的防御机制,即获得性免疫防御机制,从而产生特异性抗体以便清除病原体[3]。尽管如此,在奶牛的乳腺组织受到病原体入侵而感染时,非特异性的先天免疫机制却是处于优势地位的防御机制,对应对初期感染发挥着重要作用。先天免疫系统对大量病原体的固有反应能力是由其识别多种病原体共有的高度保守序列所介导的。这些序列通常被称为病原体相关分子模式(PAMPs),包括一些细菌细胞壁成分,如脂多糖(LPS)、肽聚糖和脂磷壁酸[4]。
已有的研究证实,乳腺上皮细胞在受到感染后,具有大量合成多种促炎症因子和乳铁蛋白等先天性免疫物质的能力。比如,泌乳期奶牛的乳腺组织受到LPS的刺激后会大量合成白细胞介素-1(interleukin-1,IL-1)和白细胞介素-6(interleukin-6,IL-6)[5]。在感染后的6 h内,乳腺细胞中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和乳铁蛋白(lactoferrin,LF)表达量的大量增加主要来自于乳腺上皮细胞[6]。相似的研究同样证实,LPS刺激乳腺上皮细胞后,会让后者产生大量LF、白细胞介素-8(interleukin-8,IL-8)和TNF-α[7-8]。这些证据表明,在乳腺感染初期先天免疫反应发挥了重要作用。因此,更好地了解与细菌入侵的最初识别和信号传导有关的介质,将有助于制订调节和提高与奶牛乳腺防御和抗感染能力有关的策略。为了研究和发现更多的乳腺上皮细胞感染信号、了解LPS与奶牛乳腺上皮细胞部分促炎症因子基因表达量之间的关系,也为进一步研究影响乳腺上皮细胞免疫反应的机制提供基础性依据,进行了LPS对奶牛乳腺上皮细胞促炎症因子基因表达的影响试验,现报道如下。
1 材料与方法
1.1 样品的采集
乳腺组织,采自哈尔滨地区屠宰企业新鲜宰杀的泌乳期荷斯坦奶牛的健康乳腺。
1.2 主要试剂和仪器
青霉素,购自哈药集团有限公司;硫酸链霉素,购自山东鲁抗医药股份有限公司;β-酪蛋白抗体,购自北京博奥森生物技术有限公司;抗荧光淬灭封片剂和DAPI,购自上海碧云天生物技术有限公司;无糖DMEM、高糖DMEM和鼠尾胶原,购自北京索莱宝科技有限公司;DMEM/F12、BODIPY493/503、Ⅰ型胶原酶和TRIzol,购自赛默飞世尔科技(中国)有限公司,胎牛血清(FBS)和胰蛋白酶,购自以色列BioInd公司;胰岛素、氢化可的松、催乳素和LPS,购自西格玛奥德里奇(Sigma-Aldrich)(上海)贸易有限公司;角蛋白18抗体和β-actin抗体,购自Santa Cruz Biotechnology公 司;Prime Script®RT reagent Kit和SYBR®Premix ExTaqTM,购自宝生物工程(大连)有限公司。
CO2细胞培养箱,Thermo Forma公司产品;倒置显微镜、激光扫描共聚焦显微镜、正置荧光显微镜,均为Leica公司产品;PCR仪,Eppendoff公司产品。以上仪器、设备均由东北农业大学细胞与遗传工程黑龙江省重点实验室提供。
1.3 乳腺上皮细胞的分离与纯化
奶牛乳腺上皮细胞分离、纯化方法详见前期报道[9],简要操作流程:乳腺组织→75%乙醇清洗2次→用含双抗的D-Hank’s溶液清洗3次→剔除多余组织→氟康唑注射液清洗3次→用含有双抗的D-Hank’s溶液清洗4次→剪碎成1 mm3左右的组织块→用不含双抗的D-Hank’s溶液清洗3次→放入胶原酶消化液中→37℃消化2~3 h,至形成组织混浊液→滤网过滤→收集滤液并离心→弃去上清液,向沉淀加入DMEM/F12吹打混匀,离心→重复前一步骤→第3次离心后弃去上清液→向沉淀中加入含有10%FBS的DMEM/F12培养液→将细胞悬液移入培养皿→37℃、5%CO2培养至80%铺满→进行细胞差异性贴壁纯化操作[9]。
1.4 乳腺上皮细胞的鉴定
乳腺上皮细胞的鉴定方法详见参考文献[9]。简要步骤:细胞爬片→甲醇固定→PBS清洗→用含5%牛血清白蛋白(BSA)的TBST(Tris buffered saline with tween)封闭→角蛋白18抗体孵育过夜→TBST溶液清洗→山羊抗兔二抗孵育→TBST清洗细胞→PI溶液避光孵育→TBST清洗,加抗荧光淬灭封片剂→共聚焦显微镜观察。
1.5 乳腺上皮细胞的培养与处理
经过纯化的乳腺上皮细胞分成两组进行葡萄糖饥饿培养1 h[9];弃去培养液,在对照组细胞中加入含有0.5 mg/mL葡萄糖的完全培养液[9]继续培养,在处理组细胞中加入含有0.5 mg/mL葡萄糖 +1 g/mL LPS(LPS组)的完全培养液[9]继续培养;两组细胞培养24 h后弃去培养液,收集细胞提取RNA,用于检测相关基因mRNA表达量,包括TNF-α、IL-6、LF、转化生长因子-β1(transforming growth factor-beta 1,TGF-β1)、诱导型一氧化氮合酶(induced nitric oxide synthase,iNOS)和IL-8。
1.6 引物的设计与合成
在GenBank上查询牛TNF-α、IL-6、LF、TGFβ1、iNOS和IL-8基因登录号、序列,利用Primer Premier 5.0软件设计引物,引物信息见表1。经过BLAST同源性分析,确定引物的专一性。

表1 引物信息Tab.1 Primer information bp
1.7 荧光定量PCR
提取总RNA后进行反转录,反转录体系参见表2。反应条件为37℃15 min,85℃5 s。

表2 反转录反应体系 Tab.2 Reverse transcription reaction system μL
实时荧光定量PCR扩增体系参见表3。扩增程序详见参考文献[9]。

表3 实时荧光定量PCR扩增体系Tab.3 Real time fluorescence quantitative PCR amplification system μL
1.8 数据的统计分析
数据统计采用SPSS 23.0软件中的Indendent-Samples t检验法进行差异显著性分析。
2 结果与分析
2.1 奶牛乳腺上皮细胞的培养与鉴定
试验采用差速贴壁法对乳腺上皮细胞进行纯化处理,经纯化后的乳腺上皮细胞形态为卵圆形,呈典型的铺路石样贴壁生长状态;在标志性蛋白鉴定方面,经过细胞免疫荧光染色法检测后显示,绝大部分贴壁生长的细胞呈现绿色荧光表达阳性,即角蛋白18阳性[10]。说明试验得到了纯度较高的原代乳腺上皮细胞。见图1。

图1 乳腺上皮细胞鉴定Fig.1 Identification of mammary epithelial cells
2.2 LPS对IL-8、TGF-β1和IL-6基因mRNA表达量的影响
采用荧光定量PCR对添加和不添加LPS的培养体系中乳腺上皮细胞的TGF-β1、IL-6和IL-8基因的mRNA相对表达量进行检测。结果表明:与对照组相比,LPS组TGF-β1基因的mRNA相对表达量没有显著提高(P>0.05),乳腺上皮细胞中IL-6和IL-8基因的mRNA相对表达量分别显著(P<0.05)和极显著(P<0.01)提高。
2.3 LPS对TNF-α、LF和iNOS基因mRNA表达量的影响
采用荧光定量PCR对添加和不添加LPS的培养体系中乳腺上皮细胞的TNF-α、LF和iNOS基因的mRNA相对表达量进行检测,结果表明,与对照组相比,LPS组TNF-α和iNOS基因的mRNA相对表达量极显著提高(P<0.01),LF基因的mRNA相对表达量显著提高(P<0.05)。
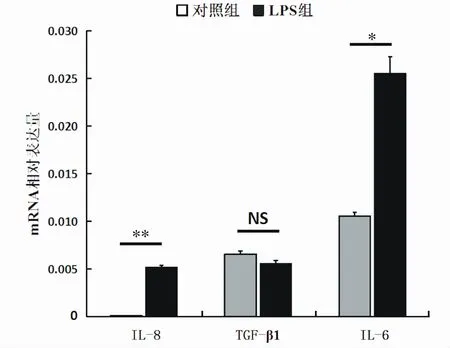
图2 LPS对IL-8、TGF-β1和IL-6基因mRNA相对表达量的影响Fig.2 Effect of LPSon mRNA expression of IL-8,TGF-β1 and IL-6
3 讨论
TGF-β1可以抑制T淋巴细胞的增殖和胸腺细胞生长[11-12]。TGF-β1缺陷的小鼠在新生儿期会出现明显的急性炎症反应[13]。在本试验中加入LPS刺激细胞后,其TGF-β1基因mRNA相对表达量并没有发生明显变化,这可能是保证乳腺细胞在感染后可以迅速启动免疫机制的原因之一。

图3 LPS对iNOS、TNF-α和LF基因mRNA相对表达量的影响Fig.3 Effect of LPSon mRNA expression of iNOS,TNF-αand LF
作为TNF/TNFR细胞因子超家族成员之一,TNF-α能够参与维持机体的免疫系统和防御机制。目前已知乳腺中TNF-α主要由乳腺上皮细胞合成,而且它还是中性粒细胞激活因子,因此TNF-α也是抵御乳房感染的重要细胞因子[14-15]。乳铁蛋白是一种单体糖蛋白,具有杀菌活性。乳腺上皮细胞可以合成乳铁蛋白,另外在受到感染的乳腺组织中也可由中性粒细胞合成并释放乳铁蛋白[15-17]。研究表明,如果动物拥有特定乳铁蛋白基因型,那么它的临床乳腺炎发病率会相对较低[18]。在机体免疫应答过程中,iNOS可以结合钙调素,释放出一氧化氮(NO)。后者作为免疫防御物质,在抵御感染过程中发挥作用[19]。由于激活iNOS基因的启动子是依赖于Ⅰ干扰素调节因子1(RF1)和核因子κB(NFκB)的,因此可以认为iNOS基因的转录是基于炎症介导过程的[20]。由此可知,被感染后的乳腺上皮细胞可以大量合成iNOS,参与抵御病菌[21-22]。当机体受到感染后,包括NF-κB在内的一系列信号通路被激活,刺激了IL-6的转录水平,提高了这种炎症细胞因子的合成能力[23]。参与先天免疫应答的细胞可以合成并分泌中性粒细胞趋化因子IL-8,该因子具有诱导很多靶细胞(比如中性粒细胞和其他粒细胞)趋化行为的功能,并诱导这些细胞向受到感染的部位迁移。很多研究已经证实,作为促炎症因子,IL-6和IL-8在乳腺上皮细胞受到炎症刺激后表达量显著提高[22,24-25]。此外,在多个乳腺上皮细胞体外炎症模型中,也检测到了TNF-α、IL-6、IL-1β和IL-8基因的表达[26-28]。在本试验中,乳腺细胞被LPS刺激后iNOS、LF、TNF-α、IL-8和IL-6基因的mRNA相对表达量与对照组相比均明显提高。由此可知,乳腺上皮细胞作为乳腺先天性免疫防御的重要屏障,在乳腺受到感染后通过大量产生免疫因子和促炎症因子等物质在免疫识别和信号传递等方面发挥着不可或缺的防御作用。
尽管如此,在奶牛产后的一段时间内乳腺炎的发病率相对较高。而这种生理性的代谢变化是如何影响奶牛的免疫反应能力,从而增加奶牛乳腺炎发病率的具体机制仍未明确。因此,对这个问题的深入研究对理解奶牛乳腺免疫防御机制和制订抗感染策略等方面具有重要的理论和实践意义。
4 结论
本试验结果表明,乳腺上皮细胞受到LPS刺激后可以通过大量产生iNOS、LF、TNF-α、IL-8和IL-6,迅速启动先天性免疫防御机制以抵抗病菌的入侵。

