链霉菌XG40的鉴定及其对琯溪蜜柚黑斑病的防效
赖宝春,戴瑞卿,吴振强,姚锦爱,曾天宝,王家瑞
(1.福建省漳州市农业科学研究所,漳州 363005;2.福建省作物有害生物监测与治理重点实验室/福建省农业科学院植物保护研究所,福州 350013)
琯溪蜜柚是福建省平和县的名牌水果,栽培历史悠久,因柚肉汁多皮薄、酸甜适中而深受消费者的喜爱[1]。目前,国内种植蜜柚的地区主要有福建、广东、四川、广西等南方省份。近年来,由于大规模、单一化种植及不合理使用农药,蜜柚病害的发生日益突出,已严重影响到蜜柚的品质和产量。由亚洲柑橘叶点霉PhyllostictacitriasianaWulandari引起的琯溪蜜柚黑斑病在主产区发生严重,主要危害果实,严重影响果实的外观品质[2]。蜜柚黑斑病病原与柑橘黑斑病病原属于不同的种,柑橘黑斑病病原其无性世代为柑橘叶点霉Phyllostictacitricarpa,有性世代为柑橘球座菌Guignardiacitricarpa[3]。但研究表明柑橘叶点霉P.citricarpa也能引起蜜柚发病,且与蜜柚黑斑病菌P.citriasiana引起的症状相似[2]。目前生产上防治该病主要依赖多次使用化学农药,长期大量使用会引发严重的农药残留、致病菌产生抗药性、生态环境污染等问题。生物防治因其高效、生态安全、专一性强等优点已成为植物病害防治的发展趋势[4]。由于琯溪蜜柚漫山遍野种植,从生态安全考虑,利用微生物防治蜜柚病害是实现蜜柚病害绿色可持续控制的有效方法,对蜜柚产业健康发展具有重要的意义。
目前有关蜜柚黑斑病生物防治的研究鲜见报道。郑域茹等[5]分离到一株短小芽胞杆菌BC12对蜜柚黑斑病菌的皿内抑制率为55.84%,但对该菌的防治研究未见报道。Lucon等[6]利用3株苏云金杆菌Bt-HD-567、Bt-Dimy和Bt-DiPel产生的挥发性化合物处理采后柑橘黑斑病G.citricarpa的防控研究,结果表明,经苏云金杆菌处理的柑橘果实黑斑病的病斑大小与对照相比分别减少了 70%、65%和 71%。Lombardo等[7]用14种香精油对采后柑橘黑斑病P.citricarpa进行防治试验,结果表明,14种精油对柑橘黑斑病菌抑制效果较好,其中Conyzabonaerensis精油能完全抑制黑斑病菌菌丝的生长。Kupper 等[8]研究了2株能产生抗真菌化合物的枯草芽胞杆菌ACB-AP3和ACB-83对橙黑斑病P.citricarpa的田间防治试验,结果表明2株枯草芽胞杆菌对橙黑斑病具有明显的控制作用。Mauricio等[9]用酵母产生的挥发性有机化合物对柑橘黑斑病菌菌丝的抑制率高达87.2%。
本研究从植物根际土壤筛选获得对琯溪蜜柚黑斑病菌拮抗作用显著的放线菌XG40菌株,通过形态观察、生理生化特征和16S rDNA、recA、rpoB、gyrB基因序列分析鉴定,并进行抑菌效果研究及防效评价,以期为琯溪蜜柚病害生物防治提供一定的理论基础和菌种资源,也为田间蜜柚病害绿色防控提供技术支撑。
1 材料与方法
1.1 供试材料
放线菌菌株:从蜜柚根际土壤、草莓根际土壤中分离、纯化和筛选获得放线菌菌株。
琯溪蜜柚黑斑病菌P.citriasiana由漳州市农业科学研究所植保研究室分离保存,用于放线菌菌株筛选及防效试验。
14种植物病原菌菌株:琯溪蜜柚炭疽病菌Colletotrichumgloeosporioides、琯溪蜜柚黑点病菌Diaporthe citri、辣椒枯萎病菌Fusariumoxysporiumf.sp.vasinfectum、香蕉枯萎病菌4号生理小种F.oxysporiumf.sp.cubenserace 4、番茄枯萎病菌F.oxysporiumf.sp.lycopersici、草莓根腐病尖孢镰刀菌F.oxysporum、草莓根腐病层出镰孢菌F.proliferatum、草莓根腐病茄病镰刀菌F.solan、番茄青枯病菌Ralstoniasolanacearum、虎皮兰叶斑病菌Paenibacilluspolymyxa由漳州市农业科学研究所植保研究室分离保存,榕树炭疽病菌C.gloeosporioides、多肉黑斑病菌Alternariaalternata、兰花茎腐病菌F.oxysporium、番茄叶霉病菌Fulviafulva由福建省农业科学院植物保护研究所提供。用于拮抗菌株抑菌谱测试。
供试药剂:10%苯醚甲环唑水分散粒剂,先正达(中国)投资有限公司,为果农防治琯溪蜜柚黑斑病常用药剂,用于防效研究。
供试培养基[10]:无机盐淀粉琼脂培养基、察氏琼脂培养基、甘油-天门冬酰胺琼脂培养基、燕麦粉琼脂培养基、葡萄糖-天门冬素琼脂培养基、酵母膏-葡萄糖琼脂培养基、明胶液化培养基、牛奶凝固与胨化培养基、淀粉水解琼脂培养基、硝酸盐还原培养基,碳、氮源基础培养基,用于拮抗菌株鉴定。高氏1号培养基:可溶性淀粉 20 g、KNO31 g、K2HPO40.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01 g、琼脂粉 18 g(液体培养基不加)、水1000 mL,pH 7.2~7.4,用于放线菌的分离纯化和鉴定;PDA培养基,用于靶标病原菌的培养;
1.2 拮抗菌株的分离与筛选
1.2.1 拮抗菌株的分离 采用稀释涂布分离法[11]分离放线菌。将采集的土样置于室内通风阴干后,称取5 g土壤倒入放有灭菌玻璃珠的50 mL无菌水中,置于180 r/min振荡培养箱振荡30 min后,取1 mL土壤混悬液,用无菌水进行梯度稀释,分别吸取10-3、10-4、10-5、10-6稀释液0.1 mL均匀涂布于高氏1号固体培养基上,28 ℃生化培养箱中培养2~3 d,挑取培养性状不同的单菌落转入高氏1号固体培养基上纯化培养,纯化3次后得到纯菌株,将纯菌株编号后置于4 ℃冰箱中保存,备用。
1.2.2 拮抗菌株的筛选 以琯溪蜜柚黑斑病菌为靶标菌,采用平板对峙培养法[12]对上述分离培养的放线菌进行初筛。将靶标菌接种到马铃薯葡萄糖琼脂培养基的中心,在距靶标菌20 mm处的2个点接种上述分离的放线菌,以只接靶标菌的平板为对照,置于28 ℃恒温培养,待对照组病原菌的菌落直径长到培养皿直径的3/4时,测量每株分离放线菌的抑菌带宽度。选择抑菌带宽,抑菌活性强且长势好的菌株进行后续试验。
1.3 拮抗菌株的鉴定
采用插片法[13],待拮抗菌株菌丝长上盖玻片后,取菌丝生长适中的盖玻片利用JEOL JSM-6380LV型扫描电镜(日本电子公司)观察拮抗菌株的气生菌丝、孢子丝和孢子的形态特征。拮抗菌株的培养特征和生理生化特征分析:参照中国科学院微生物研究所放线菌分类组编著的《链霉菌鉴定手册》[13]和关统伟等《放线菌系统分类技术》[10]。观察拮抗菌株培养特征的8种培养基见表3。用细菌基因组DNA快速提取试剂盒(天根生化科技(北京)有限公司)提取拮抗菌株的DNA,并扩增16S rDNA[14]、recA基因[15]、rpoB基因[16]和gyrB基因[17](四组基因片段的PCR反应程序及条件见表1)。PCR产物委托上海博尚生物技术有限公司进行测序。根据测序的基因序列登录NCBI(www.ncbi.nlm.nih.gov)进行BLAST比对,并从GenBank数据库获得同源性高的相关菌株的基因序列,利用MEGA 5.0软件进行序列多重比对,然后用邻位加入法(Neighbor-joining)构建系统发育进化树,最终确定拮抗菌株的分类地位。

表1 选择的基因引物和PCR程序Table 1 Sequence of the primers and PCR program used in this study
1.4 拮抗菌株的抑菌效果研究
1.4.1 拮抗菌株的抑菌谱测定 采用摇瓶发酵法[12]制备拮抗菌株发酵液。将100 mL高氏一号液体培养基加入250 mL三角瓶中,121 ℃高压灭菌30 min,待冷却后接入5 mm的拮抗菌株菌饼5块,于28 ℃、150 r/min振荡培养7 d,在无菌条件下将发酵液吸到灭菌离心管中,8000 r/min离心30 min,吸取上清液,置于-20 ℃冰箱中备用。采用平板对峙法[12]测定拮抗菌株发酵液对供试12种植物病原真菌的抑菌效果,以无菌水为对照,重复3次,28 ℃倒置培养7 d后测量抑菌带宽度。2种植物病原细菌则采用牛津杯法[18]测定,将100 μL培养好的供试细菌与培养基混匀后倒入放置牛津杯的平板,待凝固后取出牛津杯,在孔中加入100 μL的拮抗菌株发酵液,以无菌水为对照,重复3次,28 ℃培养48 h后测定透明抑菌圈的大小。
1.4.2 拮抗菌株对黑斑病菌菌丝的抑制作用 用无菌接种针挑取对照组黑斑病菌正常生长菌丝及处理组受拮抗菌株抑制的黑斑病菌菌丝制片,在光学显微镜下观察拮抗菌株对黑斑病菌菌丝形态的影响。
1.4.3 拮抗菌株发酵液对黑斑病菌孢子的影响 用无菌接种针挑取病原菌孢子囊接入滴有拮抗菌株发酵液的凹玻片中,置于28 ℃恒温培养箱保湿培养,设置无菌水和空白发酵液作为对照。分别于12、24、36和48 h观察病菌孢子的情况。
1.5 拮抗菌株发酵液对蜜柚黑斑病的防效
1.5.1 室内防效测定 取健康新鲜琯溪蜜柚桌球期果实,用75%酒精表面消毒,无菌水冲洗3次,自然风干,采用刺伤接种的方法,用无菌棉签涂抹拮抗菌株发酵上清液于果实伤口及其周围果面,涂抹后放入塑料盒置于28 ℃恒温箱中。24 h后在伤口处涂抹黑斑病菌孢子液(105孢子/mL),接种后放入塑料盒(相对湿度约90%)置于28 ℃恒温箱,测定拮抗菌株的预防效果;将黑斑病菌孢子液涂抹于果实伤口及其周围,24 h后在伤口处及其周围涂抹拮抗菌株发酵上清液,测定拮抗菌株的治疗效果。设10%苯醚甲环唑1500倍液为药剂对照,设无菌水为空白对照,每处理10个果实,重复3次。定期测量果实病斑大小并记录,计算病斑抑制率,病斑抑制率(%)=(对照组病斑大小-处理组病斑大小)/对照组病斑大小×100。
1.5.2 田间防效测定 选用8年生健康琯溪蜜柚树作为试验植物,在果实桌球期选取大小一致的果实进行防效测定,接种方法同1.5.1,用无菌棉签涂抹拮抗菌株发酵上清液于果实伤口及其周围,涂抹后保湿,套上蜜柚专用袋防止其他病、虫干扰。24 h后在伤口处涂抹黑斑病菌孢子液(105孢子/mL),接种后再套上蜜柚专用袋,7 d后取下,测定拮抗菌株的预防效果;将黑斑病菌孢子液涂抹于果实伤口及其周围,24 h后在伤口处及其周围涂抹拮抗菌株发酵上清液,测定拮抗菌株的治疗效果。设10%苯醚甲环唑1500倍液为药剂对照,设无菌水为空白对照,每处理10个果实,重复3次。定期测量果实病斑大小并记录,计算病斑抑制率。
2 结果与分析
2.1 拮抗放线菌的分离及筛选
从蜜柚根际土壤、草莓根际土壤中共分离纯化得到培养性状不同的放线菌 45株。采用平板对峙法对45株放线菌纯菌株进行琯溪蜜柚黑斑病菌抑制效果的初筛,筛选得到12株放线菌对琯溪蜜柚黑斑病菌的抑菌带宽度大于5.0 mm用于复筛(表2),复筛结果表明菌株编号为XG40的抑菌效果最好,抑菌带宽度达16.3 mm,且能很好抑制病原菌的双向生长(图1-B),因此将其作为后续试验菌株。
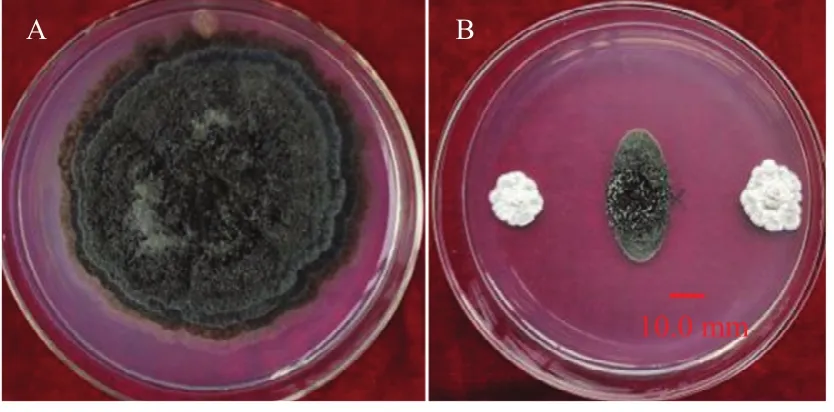
图1 菌株XG40对琯溪蜜柚黑斑病菌的拮抗作用Fig.1 Antagonistic effects of strain XG40 on P.citriasiana
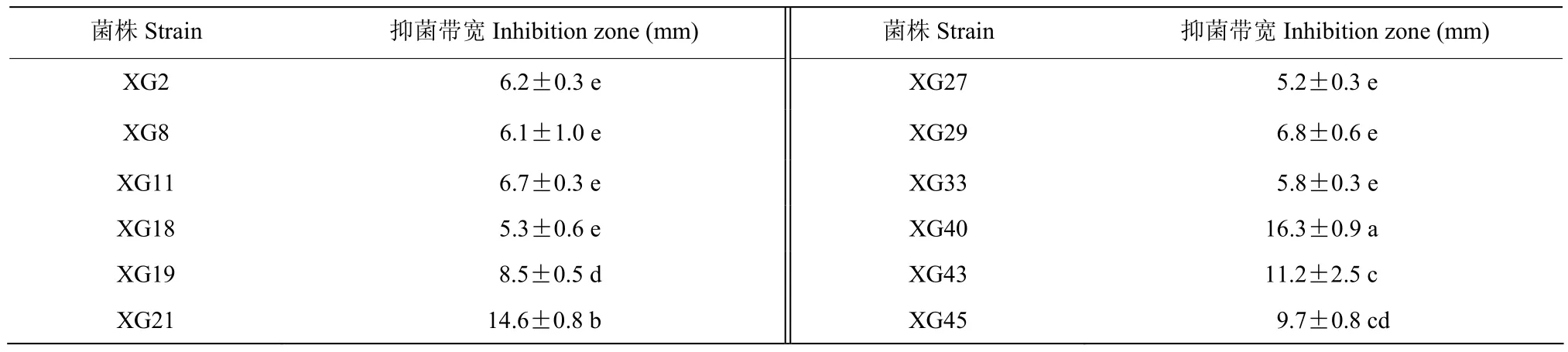
表2 12株放线菌对琯溪蜜柚黑斑病菌菌丝生长的抑制作用Table 2 Inhibiting effect of 12 actinomycete strains against P.citricapa
2.2 菌株XG40的分类鉴定
2.2.1 菌落形态及培养特征 菌株XG40在高氏一号培养基上生长旺盛,28 ℃黑暗条件下培养10 d,菌落小,中间褶皱,边缘光滑,易挑起,直径为0.65~0.70 cm,气生菌丝丰富,呈紫罗兰色粉状,边缘呈浅灰色,气生菌丝成熟后形成孢子丝,孢子丝呈浅紫罗兰色(图2A,B)。电子显微镜观察发现气生菌丝和孢子丝均高度分枝;孢子丝短,开环、钩形或松螺旋(图2C),少数直线型,时常不规则,丛生或单生,孢子丝成熟后形成串珠状的孢子链,孢子链发达,孢子链断裂后形成圆柱形或近圆柱形的孢子,孢子表面光滑,大小为(0.35~0.60)μm×(0.55~0.85)μm(图2D)。菌株XG40在8种培养基上均生长良好,无可溶性色素产生,其培养特征见表3。

表3 菌株XG40在8种培养基上的培养特征Table 3 Culture characteristics of strain XG40 in 8 media
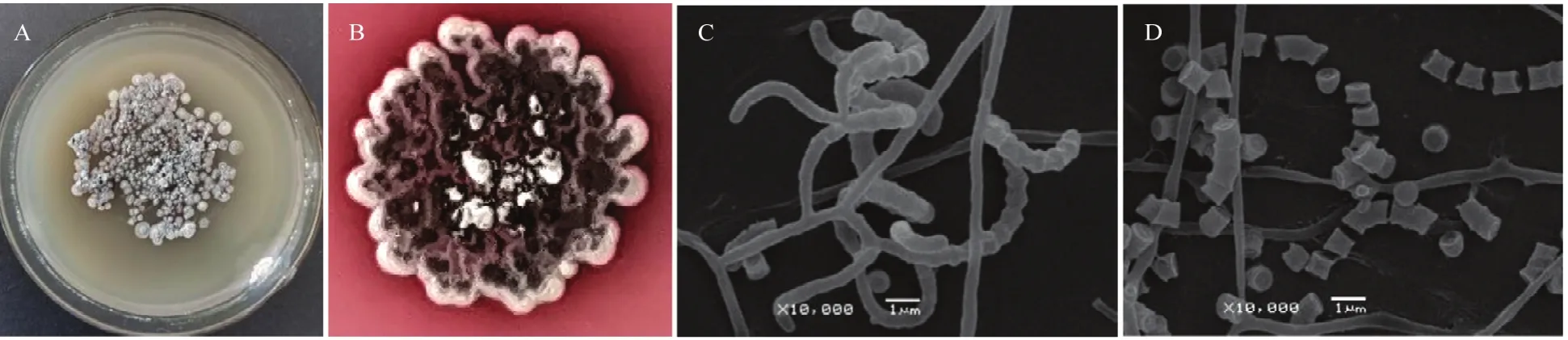
图2 菌株XG40的菌落特征及扫描电镜形态特征Fig.2 Colony characteristics and morphological characteristics under scanning electron microscope of strain XG40 on Kohl's No.1 medium
2.2.2 生理生化特性 生理生化试验结果(表 4)表明,菌株XG40可以利用蔗糖、麦芽糖、葡萄糖、甘油、棉子糖、D-果糖、D-甘露醇、α-半乳糖、肌醇、D-木糖作为碳源生长,不能利用D-阿拉伯糖、鼠李糖。可利用L-赖氨酸、L-组氨酸、天冬酰胺、L-酪氨酸、L-谷氨酸、氯化铵、硝酸钾作为氮源生长,不能利用L-色氨酸、甘氨酸、精氨酸。能使明胶液化、牛奶凝固而不胨化、淀粉水解、硝酸盐还原,不能使纤维素和色氨酸分解,也不能产生H2S和黑色素。综合该菌株的形态特征和生理生化特性,与阎逊初编著[19]的小串链霉菌描述对比结果相符,可以初步将该菌株鉴定为链霉菌属Streptomycessp.。

表4 菌株XG40的生理生化特征Table 4 Physiological and biochemical characteristics of strain XG40
2.2.3 分子鉴定 菌株XG40的16S rDNA基因片段测序后得到全长为1454 bp的序列,提交到GenBank数据库,获得登录号为MZ723951,并将该菌株的基因序列进行BLAST分析比对,发现与XG40同源性较高的菌株均属于链霉菌属,选择与菌株XG40同源性较高的16个典型菌株的16S rDNA序列用MEGA 5.0软件构建系统发育树(图3)。结果表明,菌株XG40的16S rDNA序列与小串链霉菌S.catenulaeFJ486481聚在同一个分支,与其相似性达到98.76%。为了更加准确的鉴定,将扩增的recA基因、rpoB基因和gyrB基因片段测序后得到全长分别为570、558和517 bp的序列,提交到GenBank获得的登录号分别为OM371085、OM371086、OM371087,经同源性比对后发现,菌株XG40的recA基因序列与小串链霉菌FJ406264和小枝链霉菌S.ramulosusMF581787聚在一支,如图4所示,相似性分别达99.21%和98.07%;rpoB基因序列与小串链霉菌FJ406320聚在一支,如图5所示,相似性达99.21%;gyrB基因序列与小串链霉菌FJ406208聚在一支,如图6所示,相似性达99.0%。因此,再结合菌株XG40的形态特征、培养特征及生理生化特征,最终将菌株XG40鉴定为小串链霉菌。
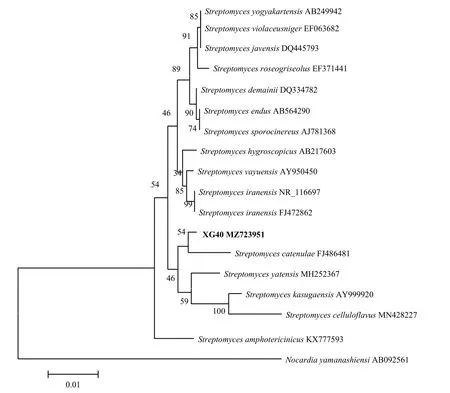
图3 基于16S rDNA基因序列构建菌株XG40的系统发育树Fig.3 Phylogenetic tree of strain XG40 based on the sequence of 16S rDNA
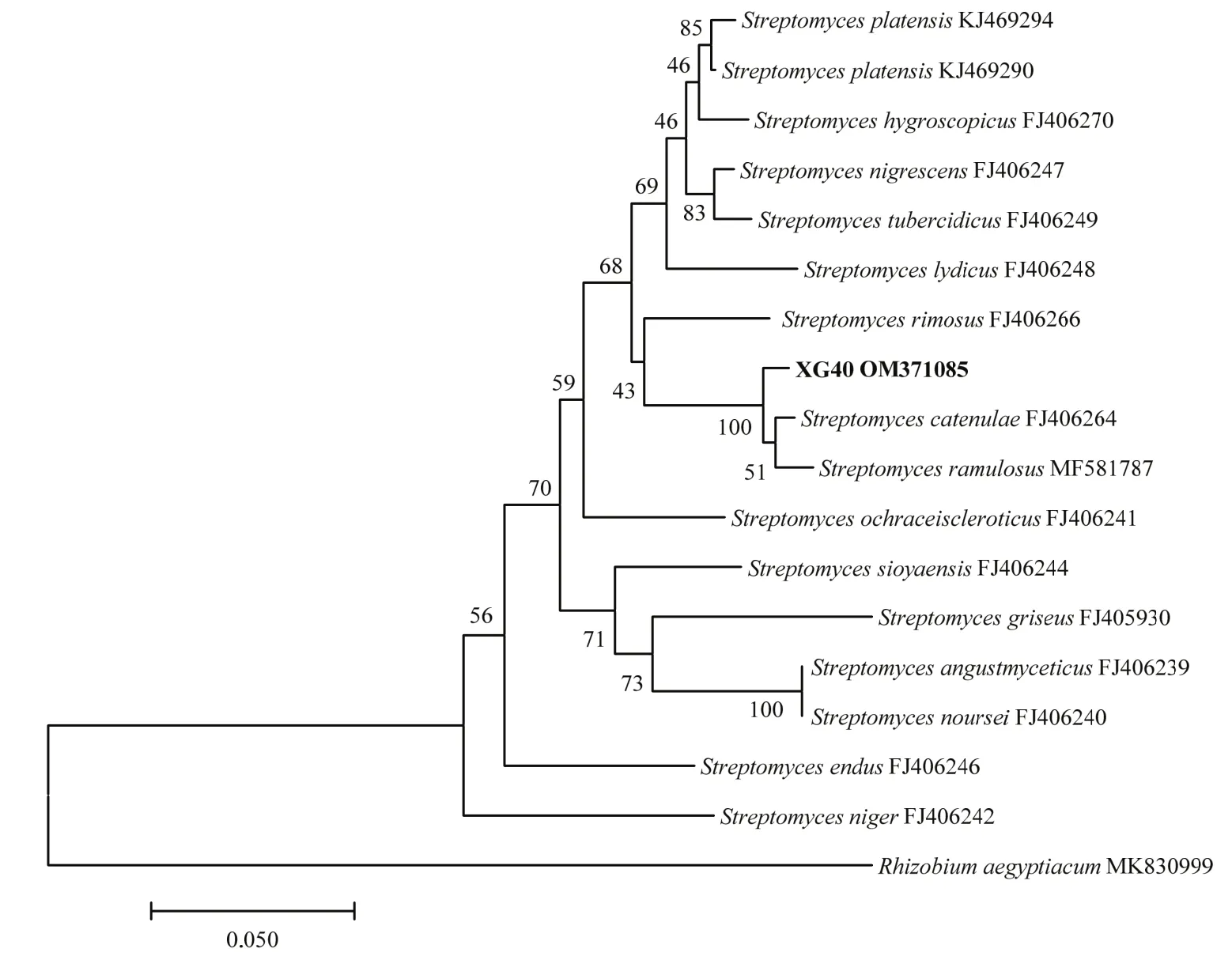
图4 基于recA基因序列构建菌株XG40的系统发育树Fig.4 Phylogenetic tree of strain XG40 based on the sequence of recA gene
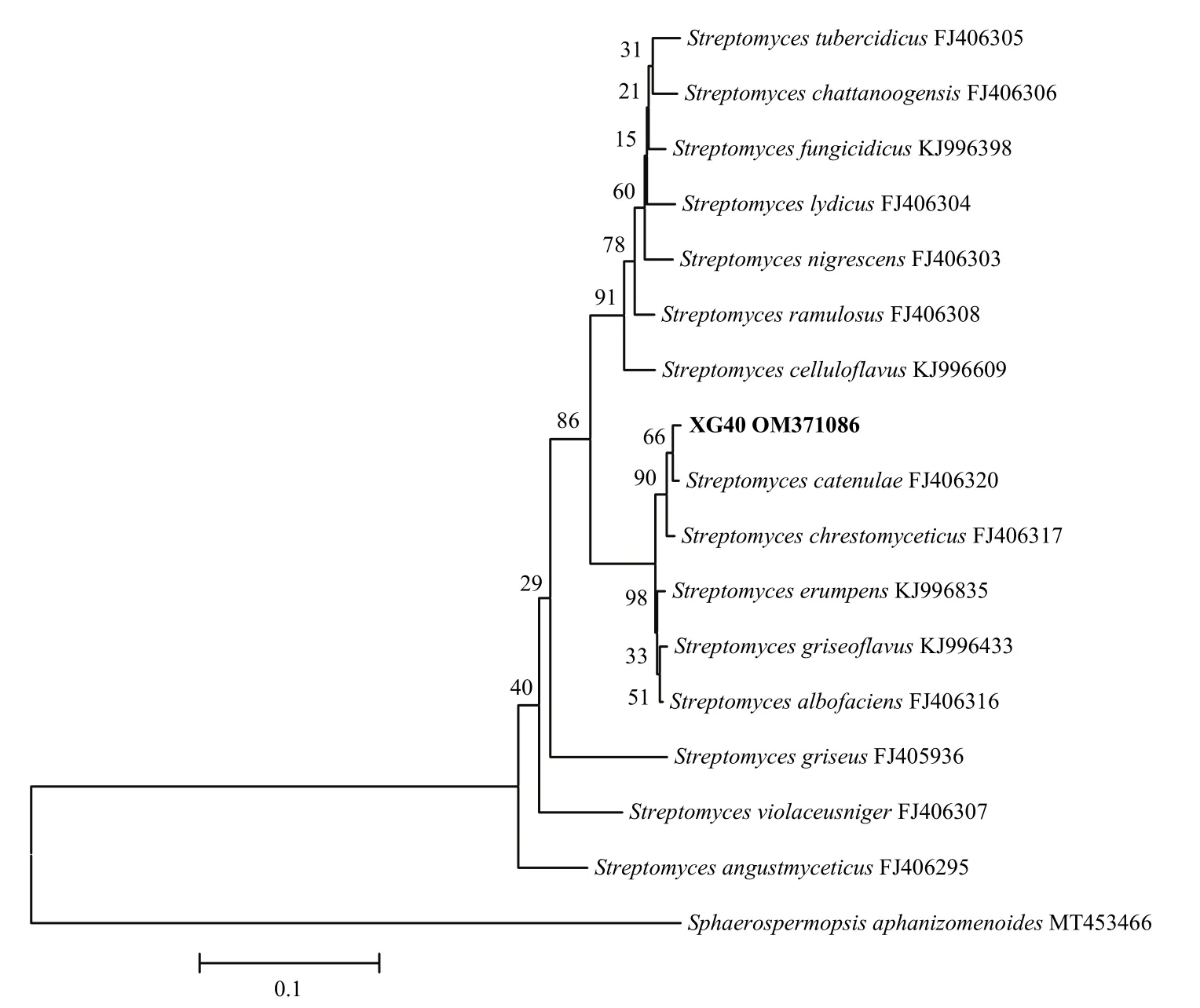
图5 基于rpoB基因序列构建菌株XG40的系统发育树Fig.5 Phylogenetic tree of strain XG40 based on the sequence of rpoB gene
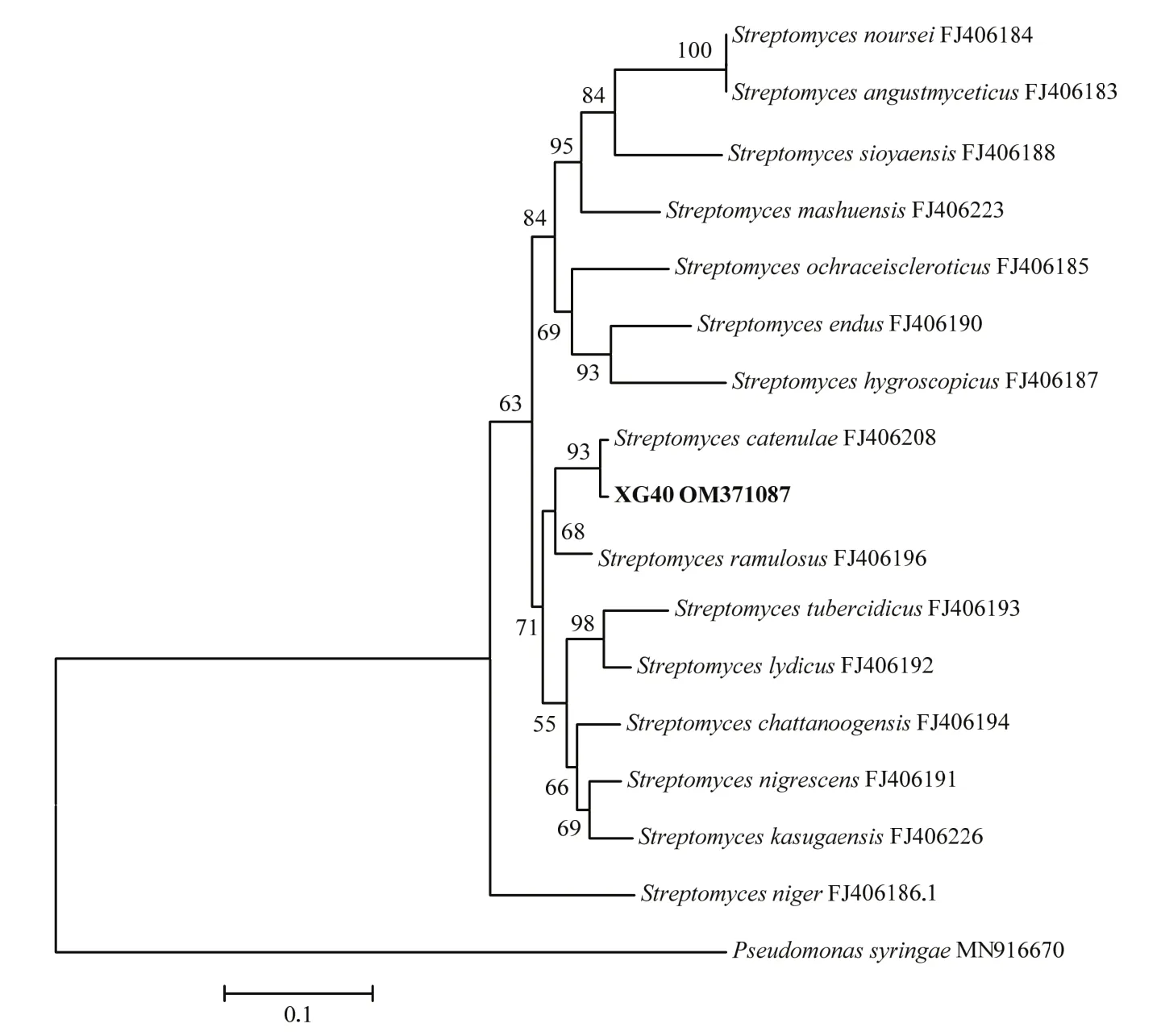
图6 基于gyrB基因序列构建菌株XG40的系统发育树Fig.6 Phylogenetic tree of strain XG40 based on the sequence of gyrB gene
2.3 菌株XG40的抑菌效果
2.3.1 菌株XG40的抑菌谱 抑菌谱测定结果(表5)表明,菌株XG40的发酵液对12种供试病原真菌均有抑制作用,其中对番茄叶霉病菌和蜜柚炭疽病菌抑制作用最强,抑菌带宽度达15.0 mm以上;其次是蜜柚黑点病菌,抑菌带宽度为14.1 mm;对香蕉枯萎病菌、多肉黑斑病菌的抑菌带宽度分别为11.9和10.1 mm;对辣椒枯萎病菌、草莓根腐病层出镰刀菌的抑制作用相对较弱,抑菌带宽度分别为 4.9和 5.2 mm;且菌株XG40对不同病原真菌的抑制作用存在显著差异。采用牛津杯法测定其发酵液对2种供试细菌均能产生一定的抑菌圈,对虎皮兰叶斑病菌的抑菌圈直径为32.5 mm,对番茄青枯病菌的抑菌圈直径为20.3 mm。说明菌株XG40具有良好的广谱抗菌特性。
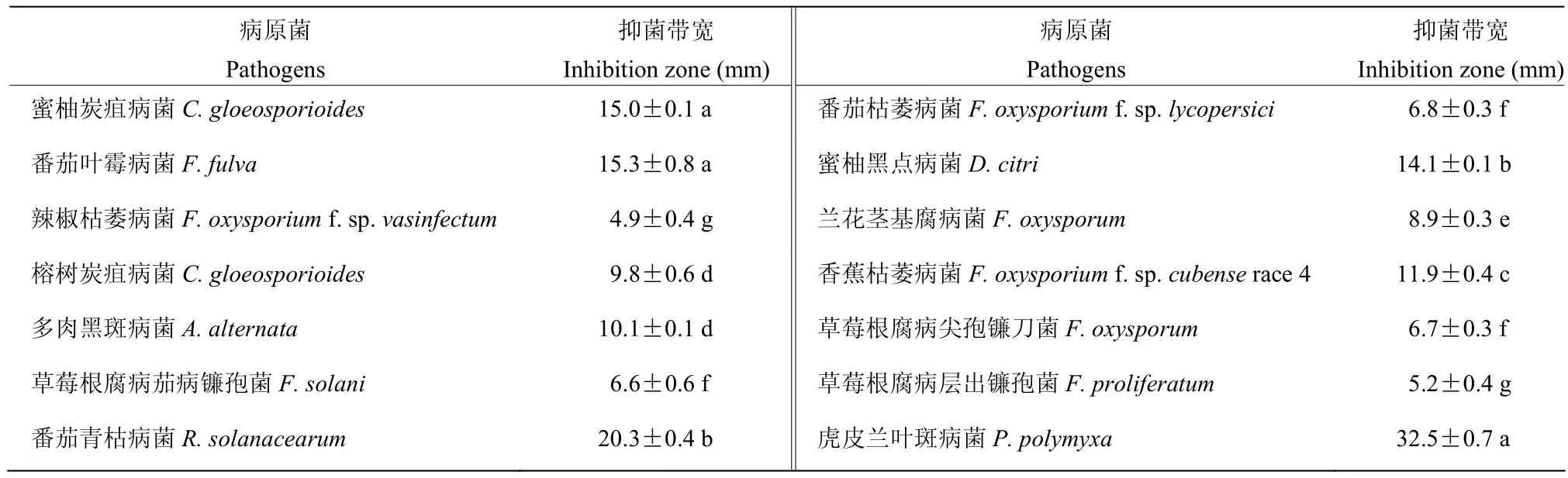
表5 菌株XG40发酵液对14种病原菌的抑菌带宽Table 5 The inhibiting zones of fermentative liquid of XG40 against 14 pathogens
2.3.2 菌株XG40对黑斑病菌菌丝的影响 在光学显微镜下检查发现,对照菌丝粗细均匀、细长而光滑(图7A)。菌株XG40对黑斑病菌菌丝的生长具有明显的破坏作用,受抑制菌丝大多数发生畸变、粗细不均匀、顶端膨大、节间缩短、易断裂,有菌丝碎屑产生(图7B)。
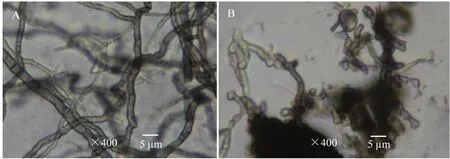
图7 菌株XG40对琯溪蜜柚黑斑病菌菌丝生长的抑制作用Fig.7 Inhibition of strain XG40 on hyphae of P.citriasiana
2.3.3 菌株XG40对黑斑病菌孢子的影响 在光学显微镜下观察发现,对照子囊及子囊孢子清晰,孢子光滑、饱满(图8A,B)。菌株XG40发酵液对黑斑病菌孢子具有明显的破坏作用,24 h后能看出孢子囊内的孢子内部结构发生了微小的变化,孢子内含物开始消解(图8C),72 h后可以清楚地观察到孢子内含物消解并产生液泡(图8D)。

图8 菌株XG40发酵液对琯溪蜜柚黑斑病菌孢子的影响Fig.8 Inhibition of fermentative liquid of XG40 against conidial of P.citriasiana
2.4 菌株XG40发酵液对蜜柚黑斑病的防效
2.4.1 室内防效 室内防效测定结果(表6)表明,菌株XG40发酵上清液对蜜柚黑斑病具有较好的预防效果,对蜜柚黑斑病的病斑抑制率为83.52%,与对照药剂10%苯醚甲环唑WG1500倍液无显著差异;菌株XG40发酵上清液10倍稀释液的预防效果相对较低,其对蜜柚黑斑病的病斑抑制率为66.24%,与对照药剂10%苯醚甲环唑WG1500倍液存在显著差异。治疗效果表明,菌株XG40发酵上清液及其10倍稀释液对蜜柚黑斑病的病斑抑制率分别为78.87%和56.62%,与对照药剂10%苯醚甲环唑WG1500倍液差异显著。

表6 菌株XG40对琯溪蜜柚黑斑病的防治效果Table 6 Control effects of strain XG40 on P.citriasiana
2.4.2 田间防效 从表6可以看出,菌株XG40发酵上清液对田间蜜柚黑斑病的病斑扩大具有较好的抑制作用,其预防效果与治疗效果分别为78.91%和71.15%,10倍稀释液的预防效果与治疗效果分别为58.95%和50.62%,说明XG40发酵上清液能够起到较好的预防和控制蜜柚黑斑病发生的作用。
3 讨论
由亚洲柑橘叶点霉引起的黑斑病是严重影响果实商品价值和出口创汇的重要病害之一,除了侵染琯溪蜜柚外,该菌还可侵染龙柚、坪山柚、葡萄柚、柠檬等芸香科植物[20]。目前琯溪蜜柚黑斑病的综合防治技术缺乏绿色可持续控制的有效手段。应用生防菌防治植物病害在农业可持续生产中潜力巨大,是植物病害防治的发展趋势[12]。链霉菌产生的活性物质不仅能拮抗植物病原菌的生长,还能促进植株生长,已广泛应用于植物病害的生物防治[21]。目前利用链霉菌生物防治蜜柚黑斑病的研究未见报道。本研究采用平板对峙法筛选得到一株拮抗P.citriasiana能力较强的XG40菌株,最终鉴定为小串链霉菌S.catenulae。该菌株的发酵液对供试的14种植物病原真菌和细菌均有较强的抑制作用,说明小串链霉菌XG40具有广谱的抑菌活性,可否用于新农用抗生素的来源,还有待进一步研究。
本研究发现,菌株XG40活菌及其发酵液产生的抗菌物质均能抑制黑斑病菌的生长,菌株XG40活菌对黑斑病菌菌丝具有较强的破坏作用,能使黑斑病菌菌丝发生畸变、粗细不均匀、顶端膨大、节间缩短、易断裂;其发酵液能使黑斑病菌的子囊孢子内含物发生消解,产生水泡。由于抗菌物质的分离提取过程比较繁琐,成本也较高,因此,可以考虑之后的应用开发使用菌株XG40的活体制剂,可以节省大量花费在分离菌株XG40所产生抗菌活性物质的时间。我国自产的“5406”细黄链霉菌S.microflavus活体制剂能分泌多种抗生素可抑制不同的植物病原真菌和细菌生长,且能分泌促进植物细胞分裂和伸长的激素[22]。菌株XG40的发酵液对蜜柚炭疽病菌和黑点病菌也具有较强的抑制作用,可为蜜柚病害的生物防治奠定菌种资源。但该菌株中起抗菌活性的物质尚未明确,下一步将对该菌株发酵液中抗菌活性物质进行分离纯化和结构分析。
目前针对小串链霉菌主要集中在生物、医药和化学领域方面的研究。有研究报道,小串链霉菌的发酵液中可分离纯化得到新的氨基酸[23]和纤维抑制素[24,25],还具有转化生育酚[26]及合成银纳米颗粒[27]的潜力。关于利用小串链霉菌防治植物病害的研究报道较少。蒋常德等[28]报道小串链霉菌与白长链霉菌、弯曲芽孢杆菌、阿耶波多氏芽孢杆菌、短密木霉制成复合微生物菌肥可用于防治小麦全蚀病。Hoda等[29]从被重金属污染的玉米根及土壤中筛选得到一株小串链霉菌,试验结果表明,该菌不仅具有较强耐受重金属(锌、锰、铁)的能力,还能促进植株生长,增加植物根系丛枝菌根孢子的数量,且在植物根际定殖能力强。本研究从植物根际土壤分离得到的小串链霉菌XG40菌株,其生长速度快,抑菌活性强。室内和田间防效测定结果表明,菌株XG40的发酵上清液能显著控制蜜柚黑斑病病斑的扩展,说明该菌株具有良好的应用开发潜力。后续将对菌株XG40的稳定性、发酵条件优化、促进植株生长作用及植株根际定殖能力等方面进一步研究。

