功能化SiO2纳米粒子的制备及其吸附脱除水中亚甲基蓝实验综述报告
王 斌,马祥梅,周 旋,刘丽敏
(安徽理工大学,安徽 淮南 232001)
研究型实验是一种把实验教学和科研训练相结合、融多样化教学形式为一体的教学环节,重在科研能力的训练和创新思维的培养。本文是依托于教师的研究课题,在相关教研项目的资助下为设计而成的研究型化学实验之一,经应用化学专业的开设,教学效果良好。
氯化3-7-双(二甲氨基)噻吩嗪-5-鎓是制备染料的一种原料,又被称为亚甲基蓝(methylene blue, MB),化学式为C16H18N3ClS,是一种噻吩嗪盐,在空气能够稳定存在,为深绿色具有青铜色光泽的晶体或者粉末,可溶于乙醇与水。其水溶液呈碱性且有毒,不加处理直接排放则会严重污染水体环境[1]。目前,水体中染料的去除方法虽然有多种,但吸附脱除法因成本低、操作简单、净化率高等优点而受到研究者的高度重视[2]。
本实验以纳米SiO2和对氨基苯磺酸为原料,经重氮化反应制备磺酸基团功能化的SiO2@SO3H吸附剂[3],红外光谱表征了产品的结构。通过紫外分光光度法探究了亚甲基蓝的初始浓度、吸附时间、水体pH等不同因素对亚甲基蓝吸附能力的影响。
1 实验目的
(1)掌握搅拌、滴加、过滤、高速离心、干燥等化学实验基本操作。
(2)熟悉低温反应操作以及紫外-可见分光光度计的原理和使用。
(3)学习用红外光谱表征产品的方法。
2 实验原理
基于纳米SiO2较大的比表面积,低化学交叉反应性、机械强度高和酸性硅烷醇官能团便于功能化等优点,利用其表面功能化的磺酸基团在水体中带副电荷,可对阳离子染料亚甲基蓝具有静电吸引的吸附机制而加以去除[4-5]。

3 实验步骤
3.1 吸附剂的制备
3.1.1 重氮化反应制备重氮盐
(1)100.0 mL圆底烧瓶中加入4.2 g对氨基苯磺酸和20.0 mL离子水,搅拌完全溶解。
(2)6 mL浓盐酸去离子水稀释至25 mL后加入到上述圆底烧瓶中,置于0-5 ℃冰水浴中搅拌反应1 h。
(3)称取1.6 g亚硝酸钠溶于10.0 mL去离子水,缓慢滴加至圆底烧瓶中的反应液,并在低温下继续搅拌反应5 h,得到重氮盐溶液。
3.1.2 制备SiO2@SO3H吸附剂
(1)100 mL的圆底烧瓶中加入0.2 g 纳米SiO2(本文以200 ± 20 nm为例) 和7.5 mL去离子水,超声分散均匀,制得纳米SiO2悬浮液并置于冰水浴中。
(2)将3.1.1制备的重氮盐溶液在30 min内滴加至纳米SiO2悬浮液中,继续低温下搅拌反应2 h,离心、20%的乙醇水溶液超声辅助洗涤、离心去除未反应的原料,置于真空烘箱中60 ℃干燥3 h。得到SiO2@SO3H吸附剂。
3.2 亚甲基蓝的脱除研究
吸附剂对MB的有效去除首先通过紫外可见光谱和溶液颜色的变化得到证实,随着MB溶液浓度的增大,其吸光度也在增加。根据郎伯-比尔定律:C/C0=A/A0,则吸附量qe:
式中:C0和C表示加入吸附剂前后溶液中MB的浓度(mg/L);A0和A为加入吸附剂前后MB溶液在波长664 nm处的吸光度;m为吸附剂的质量。
移取不同浓度亚甲基蓝标准溶液(稀释100倍,下同)测吸光度,绘制标准曲线。然后移取吸附剂吸附前后的溶液,测吸光度,由标准曲线求得溶液中亚甲基蓝的浓度。
(1)MB溶液起始浓度的影响
称取0.01 g吸附剂加入50 mL起始浓度分别为20,60,100,160,220,260 mg/L的MB溶液中,在室温低速(100 r/min,下同)搅拌30 min,离心分离,取上清液测定波长664 nm处的吸光度。
(2)吸附时间的影响
称取0.01 g吸附剂加入50 mL 160 mg/L MB溶液,分别在室温下搅拌10,20,30,40,50,60 min,离心后取上清液测定波长664 nm处的吸光度。
(3)pH的影响
称取0.01 g吸附剂加入50 mL 160 mg/L MB溶液(盐酸或氢氧化钠溶液调节pH分别为1.5,3.0,4.5,6.0,7.5,9.0,10.5,12.0),室温搅拌30 min,离心后取上清液测定紫外波长664 nm处的吸光度。
3.3 红外光谱表征
溴化钾压片法通过红外光谱分析的方法对所制得的产品进行简单的定性分析与表征。
4 实验结果与讨论
4.1 绘制亚甲基蓝浓度-吸光度标准曲线
4.2 MB溶液起始浓度对吸附量的影响
MB溶液起始浓度对吸附能力的影响如图1所示,图中可得20 ~160 mg/L浓度范围内,随着MB起始浓度的增加,吸附量逐渐增大,吸附极限值的浓度为160 mg/L,吸附量为190 mg/g。之后随着MB溶液浓度的增加,其吸附量反而呈下降的趋势。这是由于吸附剂的量保持不变,吸附效果存在一个阈值,当达到这一阈值时,即使MB溶液的浓度还在增加,但其吸附效果已经增达到极限。

图1 吸光度和亚甲基蓝含量的定量关系标准曲线
4.3 吸附时间对吸附量的影响
为考察吸附时间对吸附能力的影响,取不同吸附时间的溶液测其吸光度,结果如图2。从图2可以看出吸附时间对吸附剂的吸附能力影响较大:初始阶段随着吸附时间的延长,吸附能力快速增大,50 min时的吸附量为276 mg/g。之后则变化幅度较小,基本达到吸附平衡。

图2 MB溶液初始浓度对吸附能力的影响
4.4 pH对吸附量的影响
图3为不同酸、碱度水体对吸附剂吸附能力的影响结果,分析此图可以看出随着水体pH的改变,吸附能力呈不规则性变化,在pH=3-10.5的范围内,吸附能力保持相对稳定。这是因为MB是一种碱性染料,强酸条件下大量的H+,与MB溶液中其它的阳离子存在竞争关系[6];而当pH大于4.5之后,其酸性开始减弱,吸附剂与MB的静电引力也得到了增强的效果,因此当pH为碱性时,其吸附能力总体比酸性强。但当pH > 12时,溶液中大量的OH-与MB的阳离子发生相互作用,从而降低其吸附效果。这也说明了静电吸引不是影响吸附量的唯一因素,还可能受到氢键、范德华力和π-π相互作用等影响机制控制[7]。此外,这也是一个很好的现象,即在不同的pH值范围内去除效率保持相对稳定,因为该现象也意味着吸附剂可适用于较宽的pH范围去除亚甲基蓝。

图3 吸附时间对吸附能力的影响

图4 pH对吸附能力的影响
4.5 红外光谱分析
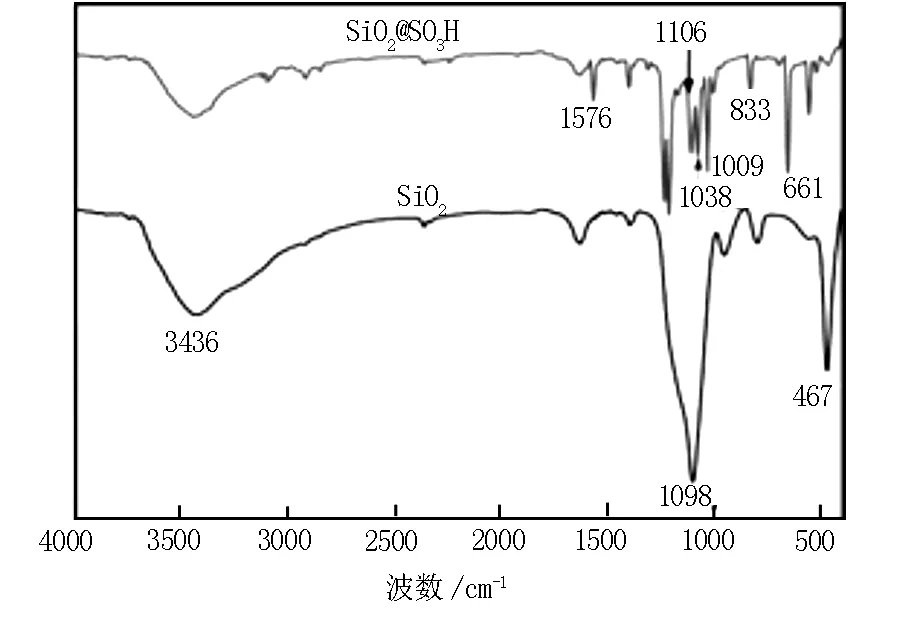
图5 吸附剂及纳米SiO2的红外光谱图
从SiO2的红外光谱图可以看出,3436 cm-1宽吸收峰推断为SiO2表面的羟基峰,467 cm-1处吸收峰为Si-O键弯曲振动和对称伸缩振动所引起的,1098 cm-1强吸收峰由Si-O-Si反对称伸缩振动引起。吸附剂的红外光谱图中出现几处新增的吸收峰如1106 和1038 cm-1处分别对应磺酸中 S-O 和 S-苯基特征振动峰;1576、1009 、661和 833 cm-1处分别对应苯环上C-H平面内弯曲振动峰和平面外C-H的特征振动峰[8]。这些吸收峰的出现说明对氨基苯磺酸成功实现对纳米SiO2的功能化。
5 实验总结
近年来,研究型教学逐渐成为培养创新型人才的重要途径。研究型实验是学生在课程老师的指导下,基于研究方向,结合查阅文献资料,选定合理可行的研究路线,反复修改、完善实验方案,完成研究内容,力争得到创新性结果的一种教学形式。本实验可操作性强,具有现实指导意义和一定的应用价值。通过这种实验方法不仅使学生掌握了实验条件的优化方法,实验数据的整理、分析和作图软件的使用,同时查阅文献和分析、解决问题的能力也得到了提升。

