食物源抗便秘因子保健机理的研究进展
毛 恺,雷 哲,杨 春,
(1.山西农业大学山西功能食品研究院,山西太原 030001;2.苏州大学基础医学与生物科学学院,江苏苏州 215000)
慢性便秘(Chronic constipation)是较为常见的 慢性疾病,但目前国内慢性便秘发病率的调查较为少见。根据2002 年和2004 年的地方调查数据,我国当时成人慢性便秘的患病率为4%~6%[1]。近年来,随着饮食结构、生活节奏、社会心理等因素变迁,慢性便秘发病率有上升趋势,加之慢性便秘因没有严重的疾病征象而就诊率偏低的现实,我国成人慢性便秘的患病率应远高于4%~6%。
功能性便秘(Functional constipation)是慢性便秘最主要的亚型,即狭义慢性便秘[2],有四个亚型:慢传输型(Slow transit constipation,STC)、排便障碍型(又称出口梗阻型Outlet obstruction constipation,OOC)、混合型和正常传输型(Normal transit constipation,NTC)。其中,慢传输型便秘(STC)和出口梗阻型便秘(OOC)是慢性便秘中最常见的类型,其病理生理学机制较为复杂,尚未完全阐明[3]。
确诊便秘类型后对症用药,是临床治疗功能型便秘的主要手段。即使对症用药,药物的副作用也不容忽视。例如不良用药反应、破坏肠神经、削减固有肠动力、诱导便秘患者电解质失调、诱发肠道炎症、长期用药加重肠道菌群失衡等[4]。
食物源抗便秘因子(Anti-constipation from food sources,AFS)与治疗功能性便秘药物相比有两个优点:效用温和,不对症也食之无害;副作用极小,仅在过量摄入时有极小副作用[5]。例如香蕉水溶性膳食纤维,其作用原理与甲基纤维素等药物类似,均是与肠壁细胞抢夺水分、刺激肠道蠕动,但其副作用小,只有在过量摄入时会造成结肠胀气[6]。所以,食物源抗便秘因子在功能性便秘预防和治疗中作为临床治疗的重要辅助手段,常见于医嘱中。
本综述整理了目前食物源抗便秘因子保健机理及其抗便秘功效评价方法的研究现状,并提出了按照不同保健机理对食物源抗便秘因子分型分类的方法,以期为其他学者完善食物源抗便秘因子研究体系提供参考。
1 食物源抗便秘因子的分型分类及其对症原理概述
医学上抗便秘药物研究较为深入,其依据抗便秘机理的不同将抗便秘药物分为泻药、促动力药物和栓类药物等,并且每一类药物均有其对症的功能性便秘亚型。本综述参考医学抗便秘药物的分类方法[7](见表1)及对症原则(见图1),依据不同的保健机理,将食物源抗便秘因子归纳为四大类:促泻因子、促动力因子、肠道润滑因子、益生元及益生菌因子。与抗便秘药物类似,各类型食物源抗便秘因子有其对症的功能性便秘亚型。

表1 治疗便秘药物的分类Table 1 The classification of drugs for constipation
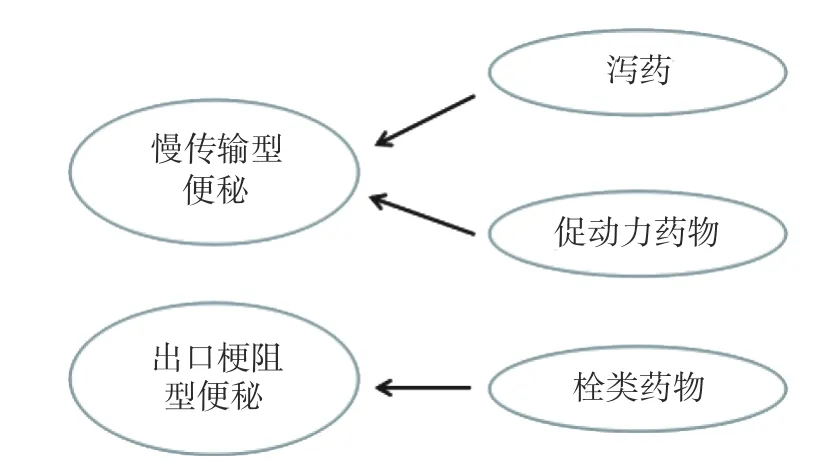
图1 治疗便秘的药物类型及其对症Fig.1 Types of constipation treatment drugs and their symptomatic treatment
结肠动力不足和直肠动力不足分别是慢传输型和出口梗阻型便秘的主要特征[8−9],所以食物源抗便秘因子能否到达结肠或直肠,将是评价其对症便秘类型的重要依据。结、直肠壁细胞结构相似[10−12],是各类型食物源抗便秘因子的靶向部位,抗便秘因子随肠道运输路径依次发挥功效并随之消耗,加之消化系统中消化酶和肠道微生物的分解吸收,加剧了抗便秘因子的“效用递减”规律。例如火麻仁油中含有γ-亚麻酸(γ-Linolenic acid,GLA),是前列腺素的前体物质,前列腺素参与肠壁细胞神经传导[13],有促动力效果,但是在消化系统作用下,其易被氧化为短链脂肪酸,其功效按照结肠、直肠的路径顺序衰减,所以火麻仁油主要作用于结肠,对症慢传输型便秘。
因此,绝大多数类型的食物源抗便秘因子对症慢传输型便秘,少数能到达直肠发挥作用,对症出口梗阻型便秘(如图2)。有缓释效果的肠道润滑因子能对症出口梗阻型便秘,例如火龙果和猕猴桃籽粒油脂含量超过30%[14−15],其结构不被消化系统消化,食用后籽粒分布于粪便及其表面,可以到达结肠和直肠,有缓释油脂的作用,能对症出口梗阻型便秘;不溶性膳食纤维不易被消化酶消化或肠道内微生物分解,在结、直肠中均可机械性地刺激肠壁引起便意,能对症出口梗阻性便秘,增加粪便的重量和体积,能使肠道蠕动加快,缩短食物残渣在肠内的通过时间[16];另外,利用现代缓释技术[17−18]强化的各类型抗便秘因子,能减缓“效用递减”速度,也可以到达直肠发挥作用,对症出口梗阻型便秘。

图2 不同类型食物源抗便秘因子对症Fig.2 The treatments according to symptoms with different AFS
2 各类型食物源抗便秘因子的保健机理
2.1 促泻因子及其保健机理
食物源抗便秘因子大多属于促泻因子。其作用机理是因子或其代谢产物刺激肠道蠕动,起轻泻作用。许多研究证明,该类型抗便秘因子刺激肠道方式具有多样性。
2.1.1 内容物机械刺激 不溶性膳食纤维(Insoluble dietary fiber,IDF)是典型的机械刺激促泻因子。不溶性膳食纤维有较强的吸水力和溶胀性,难被消化酶或微生物分解,形成较多的固体食物残渣,增加粪便质量和体积,提高粪便含水量[19]。粪便重量和体积的增加,能机械性地刺激肠壁引起便意,使肠道蠕动加快,缩短食物残渣在肠内的通过时间[16]。在临床实验中,顾清等[20−21]对诊断为功能性便秘的老年患者进行不溶性膳食纤维干预实验,发现试验组自身前后的排便次数、排便状况、粪便性状均改变且差异极显著,该结果表明通过定量增加不溶性膳食纤维的摄入可以达到改善老年人便秘的作用。王娟等[22]对香蕉不溶性膳食纤维持水性和膨胀性进行研究,其持水性、膨胀性、容积密度分别为11.91 g/g、9.66 mL/g 和0.345 g/mL,表明香蕉不溶性膳食纤维有较好的持水性和膨胀性;并通过小鼠小肠运动试验和排便试验,发现最佳剂量组比模型组的肠墨汁推进率提升23.1%,这表明香蕉不溶性膳食纤维有良好的润肠通便效果。程明明[23]对西番莲果皮不溶性膳食纤维润肠通便效果进行研究,发现各灌胃小组粪便含水率都显著增加,说明其可能具有一定预防便秘的功效。彭禛菲等[24]对野山杏不溶性膳食纤维的润肠通便功能进行研究,发现野山杏不溶性膳食纤维持水性和膨胀性分别为6.11 g/g、4.40 mL/g,持水性与溶胀性良好,动物实验表明其能明显提高小鼠小肠推进率、降低首粒排便时间、降低首粒排蓝便时间和增加小鼠6 h 排便总质量,有良好的润肠通便效果。乐卿清等[25]对羊栖菜中可溶性和不可溶性膳食纤维的润肠通便效果作比较,发现羊栖菜不溶性膳食纤维组小鼠小肠蠕动显著增强(P<0.05),而可溶性膳食纤维组墨汁推进率则无显著变化。
2.1.2 脱水刺激 蒽醌类是主要的脱水刺激促泻因子。蒽醌类是刺激类泻药的药效成分,能抢夺大肠水分,促进肠蠕动,但副作用大,而食物源天然蒽醌类却作用温和,未发现不良反应[26]。芦荟蒽醌(总蒽醌含量为0.1 g/100 g)由多种蒽醌类化合物组成,包括芦荟苷、芦荟大黄素、芦荟大黄酚、异芦荟大黄素苷和蒽酚等20 余种。研究表明,芦荟大黄素苷可被氧化为芦荟大黄素,后者能抢夺大肠水分,促进肠蠕动,产生刺激性泄下作用[27]。张春玲[28]在测定芦荟的有效成分芦荟苷含量的前提下,发现灌胃1.0 g/kg.bw 的芦荟即对正常小鼠表现出润肠通便效果,而灌胃0.17 g/kg.bw 的芦荟对便秘小鼠有显著的润肠通便效果。
2.1.3 降低肠道pH 可溶性膳食纤维、抗性淀粉和低聚糖等食物源因子均可以通过肠道菌群发酵产短链脂肪酸或者有机酸的方式,降低肠道pH,刺激肠道蠕动。
可溶性膳食纤维(Soluble dietary fiber,SDF)不能被消化酶分解但可被肠道中微生物利用,代谢产生丁酸、乙酸、丙酸等短链脂肪酸[4],也可被肠道内乳杆菌、双歧杆菌等益生菌利用产生乳酸[29],降低肠道内pH,刺激肠道蠕动。余拓等[30]研究香蕉可溶性膳食纤维时发现,低剂量实验组(1.0 g/kg.bw.d)能够显著缩短模型小鼠首粒黑色粪便出现的时间,同时显著提升小肠推进率。林文庭等[31]对胡萝卜渣水溶性膳食纤维润肠通便效果进行研究,结果显示高剂量实验组小鼠6 h 黑便粒数、6 h 黑便质量及小肠墨汁推进率均显著提高(P<0.05),说明胡萝卜渣水溶性膳食纤维通过增加粪便量、促进肠道蠕动、缩短粪便通过肠道时间实现润肠通便效果。聚葡萄糖是一种新型食品添加剂[32],也是一种优良的可溶性膳食纤维,王学敏等[33]研究了聚葡萄糖(Polydextrose)的润肠通便功效,在便秘动物模型试验中,聚葡萄糖高剂量组的小肠推进率、粪便重量和粒数均有极显著提高(P<0.01)。
抗性淀粉(Resistant starch,RS)不能被人体吸收,但是可以被肠道菌群利用,产生短链脂肪酸等,可以通过降低肠道内pH,有效刺激肠道蠕动。白永亮等[29]在体外模拟肠道内乳酸杆菌对抗性淀粉作用,发现香蕉抗性淀粉随着发酵时间的延长,乙酸、丙酸、丁酸、短链脂肪酸的总酸和乳酸含量均有明显提高。Munster 等[34]的研究表明,在日常饮食中添加45 g玉米抗性淀粉,粪便中短链脂肪酸含量能提升35%,说明富含抗性淀粉的食物可以提高肠道内短链脂肪酸的含量。唐健[35]研究发现,香蕉抗性淀粉的中、高剂量实验组小鼠比模型组小鼠的小肠推进率极显著提高(P<0.01),由此推测可能是抗性淀粉在肠道内分解为短链脂肪酸,刺激肠道蠕动从而提高小鼠小肠推进速率。
抗性淀粉的保健机理与膳食纤维相似,但克服了膳食纤维带来的口感差、影响食品品质等缺点。Sajilata 等[36]发表的论文支持了上述观点,其采用专业感官评审团队,对抗性淀粉和膳食纤维两组华夫饼干的初始松脆度及放置3 min 后松脆度进行评价,发现抗性淀粉组比膳食纤维组产品有更好的的脆性、延展性和口感。
低聚糖(Oligosaccharides)不能在人体消化道中分解吸收,但能被大肠内微生物利用,产生醋酸、乳酸等短链脂肪酸,降低肠内pH,促进肠道蠕动,增加粪便湿度,能达到防止便秘的功效[37]。刘丽媛[38]发现芦笋低聚糖低、中、高剂量组小肠推进率比模型对照组均有显著变化(P<0.05),表明芦笋低聚糖有润肠通便作用,并推测其润肠通便功效与促进有机酸产生有因果关系。
2.1.4 气体刺激 水溶性膳食纤维、抗性淀粉除了可以通过降低pH 促进肠道蠕动外,还可以通过代谢产生的二氧化碳、氢气、甲烷等气体,有刺激肠道蠕动及疏松粪便的功效。以往认为甲烷、氢气是生理惰性气体,不参与生物代谢过程,但随着一些研究的深入[39],发现甲烷等气体对肠道疾病的治疗具有潜在的临床应用价值。水溶性膳食纤维在肠道中代谢产物为二氧化碳、氢气、甲烷等气体,可以刺激肠道蠕动[4,40]。林文庭等[31]研究显示,胡萝卜膳食纤维发酵后产生二氧化碳、氢气、甲烷等气体,能刺激肠黏膜。唐健[35]研究发现,抗性淀粉在结肠内发酵可产生二氧化碳及甲烷气体,其中主要是二氧化碳,气体具有疏松粪便的功效,增加粪便体积,可起到预防便秘作用。
气体具有疏松粪便的功效,增加粪便体积,能预防便秘,但是过量摄入时会产生胀气[41],因此建议摄入优质富含水溶性膳食纤维及抗性淀粉的食物,同时注意适量原则。目前,我国食品行业所使用的膳食纤维多来自于麦麸[42],但有研究报道,与小麦麸皮相比,燕麦麸皮更能够减少胃肠不适并影响氢气、二氧化碳和甲烷等气体的产生[43]。
2.2 促动力因子及其保健机理
中国慢性便秘诊治指南[7]认为,功能性便秘的病理生理学机制尚未完全阐明,其最主要原因可能是结肠传输动力不足。目前,有部分学者对有促动力功效的食物源抗便秘因子进行研究,研究中所涉及促动力因子的保健机理大致有三种:促进肠壁细胞神经传导、增加Cajal 间质细胞和肠神经胶质细胞数量[12]、恢复结肠黏膜氯离子通道功能[44]。
2.2.1 促进肠壁细胞神经传导 神经传导是控制肠壁平滑肌收缩的最主要因素[9−11],目前研究显示,促进肠壁平滑肌节律收缩的直接评价指标主要有肠组织中胃动素(motilin,MTL)、血清中P 物质(substance P,SP)及NO 水平,血管活性肠肽(vasoaetive intestinal peptide,VlP)、前列腺素(prostaglandin,PG)等。
唐健[35]研究显示香蕉抗性淀粉显著提高了小鼠血浆、肠组织中的SP 含量。SP 是一种脑肠肽,常以神经递质的形式参与调节多种生理功能,或可以作为缓解肠道神经障碍的重要参考指标。张春玲等[27]研究芦荟的润肠通便功效时发现,摄入中高剂量芦荟的实验组小鼠比模型组的MTL、SP、VIP 含量均显著提高(P<0.05)。
火麻仁富含γ-亚麻酸(含量为0.2%~1.3%,常用食用油中不含γ-亚麻酸[45]),其是前列腺素的前体物质[46],而前列腺素与肠道神经传导有关。任汉阳等[47]研究火麻仁对润肠通便的功效,发现火麻仁中剂量组可以显著缩短便秘小鼠模型的首粒黑便时间,增加6 h 内排便粒数。由此推测火麻仁的润肠通便功效与γ-亚麻酸促进神经传导的促动力机理有关。此外,《中国药典》记载以火麻仁为原料的润肠通便成方较多,有麻仁丸、麻仁润肠丸、麻仁滋脾丸、通幽润燥丸、痔宁消颗粒等[11],也可间接说明火麻仁中活性成分的润肠通便功效尤为显著。
2.2.2 增加结肠Cajal 间质细胞数量 Cajal 间质细胞(interstitial cells of Cajal,ICC)数量减少被认为可能是肠道动力障碍的重要原因[48],c-kit/SCF 信号传导通路对ICC 生长发育及功能的维持至关重要。目前食物源抗便秘因子缺少此方向的研究,但是有学者对抗便秘药物进行该项研究。肖秋平等[49]研究了肠润方(其主要成分火麻仁和槟榔为食物源抗便秘因子)对功能性便秘大鼠结肠Cajal 间质细胞数量及ckit/SCF 信号传导通路的影响,发现肠润方高、中剂量组结肠组织c-kit、SCF 蛋白及其mRNA 表达水平相对于模型组显著提高(P<0.05),间接说明,肠润方通过调控c-kit、SCF 表达,恢复c-kit/SCF 信号转导通路,恢复ICC 对胃肠道节律的正常调控来治疗功能性便秘。
2.2.3 促进氯离子通道传递 参与肠道液体分泌和肠动力调节的氯离子通道主要有两种,分别是囊性纤维化跨膜电导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)[50]和钙激活氯离子通道(calcium-activated chloride channels,CaCCs)[51−52]。孙亮[53]研究了白杨素、川陈皮素等四种黄酮类化合物对CFTR 和CaCCs 氯离子通道的调节作用,发现四种黄酮类物质对CFTR 和CaCCs 氯离子通道均有调节作用,但是该调节作用并非仅是促进,例如白杨素、川陈皮素可以促进CFTR,但是抑制CaCCs,说明部分黄酮类化合物对CFTR 和CaCCs 氯离子通道活性具有相反的调节作用,提示在摄入富含黄酮类食物源抗便秘因子时应注意其对氯离子通道的拮抗作用。
2.3 肠道润滑因子及其保健机理
肠道润滑因子多是富含油脂的果实和种子,在肠道内有“润滑肠道”的功效,其是治疗慢性便秘的重要辅助手段。多数油脂无法到达结、直肠发挥润肠通便功效,其在人体小肠消化酶作用下分解为脂肪酸和甘油,长链脂肪酸进一步分解或吸收转化后参与人体其他代谢活动,并失去油脂的润滑特性。但是富含油脂的果实和种子有包埋油脂的效果,在人体肠道内与消化酶逐步接触,可以到达结、直肠发挥滑肠通便作用。
据笔者统计,《中华人民共和国药典(2020 年版第一部)》记载的油脂含量丰富的果实及种子类药食同源材料中,30%以上均有“润肠通便”、“泻下通滞”、“润燥滑肠”、“用于肠燥便秘”等功效。本文搜集有润肠通便功能种子药食同源肠道润滑因子见表2。

表2 部分有润肠通便功效的种子类中药材中的油脂组成Table 2 Oil composition of some seed herbs with laxative effect
由上表可以看出,该类肠道润滑因子均富含油脂(含量≥30%),且不饱和脂肪酸含量较高(含量≥85%),但不饱和脂肪酸的组成未见共性规律。
除上述富含油脂的食药同源润滑因子外,火龙果籽和猕猴桃籽是更具潜力的肠道润滑因子。火龙果籽中脂肪含量最高为32.02%,其中,不饱和脂肪酸的含量高达80.83%。其中亚油酸最高,为54.43%,其次油酸含量为23.40%[54]。猕猴桃籽中粗脂肪的含量约为32.0%,α-亚麻酸含量最高达63.99%[55]。火龙果籽、猕猴桃籽除油脂含量丰富外,因其数量多、体积小且不被分解,其类似于包埋油脂的微胶囊,具有良好的油脂缓释效果,是为数不多有希望对症出口梗阻性便秘的天然抗便秘因子。
但目前没有针对火龙果籽和猕猴桃籽进行润肠通便效果的研究,研究者多围绕未去籽的火龙果[56]和猕猴桃的润肠通便功效展开,籽粒的抗便秘功效有待开发。
2.4 益生元及益生菌因子及其保健机理
肠道菌群长期失衡被证明是功能性便秘的原因之一,该类型抗便秘因子主要作用是“选择性增殖有益菌,抑制有害菌”[57],从而达到平衡肠道菌群,润肠通便的效果。由于结、直肠内微生物数量最多(见表3),所以该类型抗便秘因子专一性强、具有结直肠靶向、抗便秘效果好。
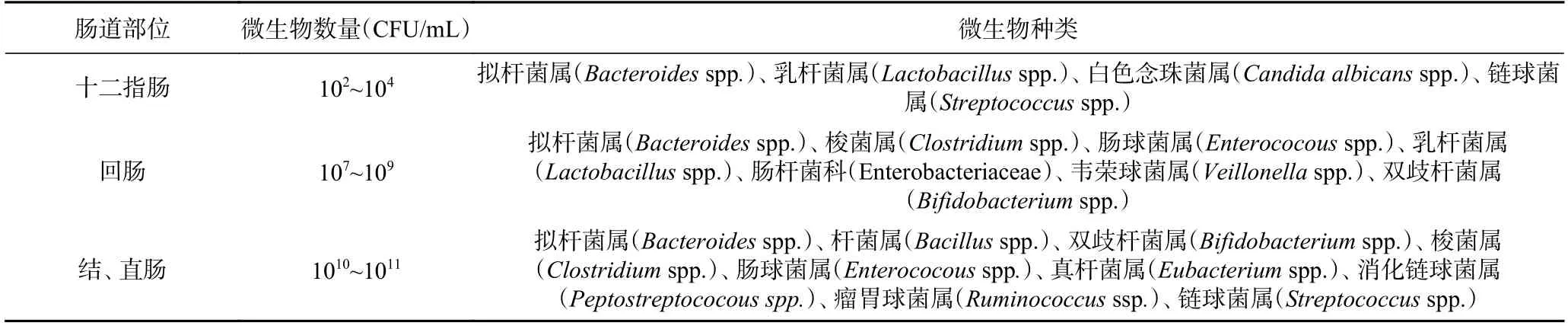
表3 肠道微生物数量及种类Table 3 Number and species of intestinal microorganisms
该类型抗便秘因子包括益生元和益生菌两大类,其保健机理有差异。益生菌剂通过直接增加益生菌种群数量实现“增殖有益菌”,益生元是通过给予肠道内益生菌营养物质促进益生菌生长而间接“增殖有益菌”。
2.4.1 食物源益生菌直接调节肠道菌群 肠道健康相关的益生菌种类很多,双歧杆菌、乳酸杆菌、类杆菌等是常见的研究对象。例如植物乳杆菌581[58]具有较好的肠道耐受性,能调节肠道菌群;乳双歧杆菌HN019 有调节肠道菌群[59]、改善肠道功能的功效[60]。但是,益生菌调节肠道菌群的作用机理并不清楚,堵雅芳等[61]猜测,其可能与其提高免疫力、抗炎和抗氧化有关。
2.4.2 食物源益生元间接调节肠道菌群 目前研究较多的益生元是低聚糖,已证明多种功能性低聚糖有抗便秘功效。低聚糖(Oligosaccharides)又称寡糖,是由3~8 个单糖组成的功能性糖类,其不能被人体消化系统分解,但是能在肠道中被乳酸菌、双歧杆菌等益生菌利用并产生乳酸等次级代谢产物,具有“增殖有益菌,抑制有害菌”的独特功效,因此低聚糖具有治疗慢性便秘的显著功效。汪雨亭等[62]发现香蕉低聚糖低、中、高剂量实验组小鼠的小肠墨汁推进率、首粒黑便时间均显著优于便秘模型组,说明了香蕉低聚糖及其设置浓度下,都有促进小鼠肠道蠕动的效果。刘丽媛[38]通过建立的便秘小鼠模型的肠运动实验中发现,芦笋低聚糖中高剂量组小肠推进率、粪便粒数有显著提高,首便时间明显缩短。丁伯乐等[63]研究了山药低聚糖对五种益生菌的体外增殖影响,发现山药低聚糖对五种益生菌均有促进作用,48 h 促进菌体量均在10%左右。此外,壳寡糖[64]、大蒜低聚糖[65]、麦麸低聚糖[66]、大豆低聚糖[67]等功能性低聚糖的抗便秘功效也多有研究。
除低聚糖外,部分多糖(如云芝多糖、胡萝含氮多糖)、抗性淀粉[68]、水溶性膳食纤维[69]、膳食多酚[70]等也被证明有益生元作用。华梅等[71]利用基因组学研究了人参水溶性膳食纤维对便秘大鼠模型肠道微生物结构的影响,发现低剂量实验组厚壁菌门和乳酸菌属丰度明显提高,高剂量实验组梭菌属和瘤胃球菌属丰度明显提高,说明人参水溶性膳食纤维可以有效增殖益生菌。
3 食物源抗便秘因子功效的评价方法概述
常见的食物源抗便秘因子功效评价手段有两种,分别是动物试验和人体试食试验。前者周期短、结果直观,是目前绝大多数学者采用的评价方法;后者选取试验样本的难度偏高,采用此评价方法学者极少[72]。此外,近些年兴起的肠道体外模型评价[73]也可以参考,但是肠道体外模型仍需进一步完善。
3.1 动物试验评价
目前,绝大多数学者采用构建便秘动物模型方法对抗便秘因子进行研究,小鼠的墨汁推进率、排便时间、粪便粒数、粪便重量是最主要的抗便秘表征指标。
陈洪雨等[74]在研究山楂膳食纤维润肠通便效果时采用便秘模型小鼠的小肠推进率、首粒排黑便时间和增便质量等指标,发现中、高剂量组与模型组相比,三组数据具有显著性差异(P<0.05)。乐卿清等[25]用墨汁推进率和首粒黑便时间表征小鼠的肠道蠕动情况,100 mg/kg 不溶性膳食纤维剂量组小鼠小肠中墨汁推进率显著提高(P<0.05),首粒黑便时间显著缩短(P<0.05),证明羊栖菜不溶性膳食纤维在小鼠便秘模型实验中有通便作用。刘丽媛等[38]采用小肠墨汁推进率、首次排便时间和小鼠的粪便粒数及重量研究芦笋低聚糖的润肠通便效果,3 个剂量组芦笋低聚糖均能缩短便秘小鼠的首次排便时间,增加小鼠的粪便粒数与重量,即具有润肠通便作用。
此外,有少部分学者已采用了更直接的评价指标。刘丽媛等[38]采用小鼠血浆、肠组织中的SP 含量变化来判断是否有润肠通便效果,其研究显示,相比于便秘模型组小鼠,阳性实验组能显著提高了小鼠血浆、肠组织中的SP 含量。有学者在研究肠润药物对功能性便秘影响时,采用了对大鼠结肠Cajal 间质细胞数量及c-kit/SCF 信号传导通路的指标[49],阳性实验组大鼠结肠Cajal 间质细胞数量高于便秘模型组,结肠组织的c-kit、SCF 蛋白及其mRNA 表达水平也高于便秘模型组。
3.2 人体试食及临床试验评价
人机体各代谢系统相关联且有机统一,不同个体间也存在差异,人体试食和临床实验数据则更有价值。临床医学实验审批需要复杂的流程,但人体试食实验可以参照《保健食品检验与评价技术规范实施手册(2003 年版)》(通便功能检验方法,人体试食实验)进行。
人体试食实验评价润肠通便效果的主要指标包括每天排便次数、排便状况计分、粪便性状积分、粪便含水量等。王莹等[75]采用人体试食试验评价聚葡萄糖对功能性便秘患者的疗效,表明每日摄入20 g聚葡萄糖1 周后,患者的排便困难、粪便性状、排便不尽感显著减少,并且排便频率明显提高,其有效率达73.3%。赵晶晶[76]在低聚果糖液润肠通便效果评价中发现,试食组试食前后平均每天排便次数分别为0.35±0.13、0.70±0.27,排便状况积分1.40±0.46、1.05±0.32,粪便性状积分1.27±0.46、0.76±0.37,粪便含水量62.18±7.54、74.00±9.42,试食前后差异显著(P<0.05)。肖薇[77]采用309 例志愿者试食实验评价车前子壳沙棘制品的润肠通便效果,实验表明,该制品可增加受试人群的排便次数、粪便含水率、改善受试者排便状况及粪便性状,说明受试制品具有润肠通便的作用。Timm 等[78]研究发现,连续10 d 每日摄入聚葡萄糖20 g,粪便质量和排频率量明显增加,并且粪便pH 降低,形态变软。
3.3 体外模型试验评价
近些年的体外肠道模型[73]的建立为研究者提供了可视化的肠道研究途径,目前其应用领域包括:肠道菌群结构和数量变化[79]、肠道内代谢情况和代谢机理研究[80]、肠道疾病及临床治疗[81]等。虽然其仍未广泛应用于抗便秘因子的研究,但笔者认为其可能将是抗便秘因子研究的重要手段之一,能够直观表明抗便秘因子的益生功效及抗便秘机理。
于雷雷等[82]在利用体外结肠发酵模型,探索植物乳杆菌CCFM639 的加入对人体代谢及肠道菌群产生的变化,结肠发酵模型数据显示,植物乳杆菌CCFM639 能提高模型中短链脂肪酸(SCFAs)的含量,同时短链脂肪酸与小类杆菌属、链球菌属、罗斯氏菌属等有益菌呈正相关,与欧文氏菌属、埃希氏菌属、沙雷氏菌属等有害菌呈负相关,这似乎显示了益生菌润肠通便的某种机理。李旭娇等[83]研究发现,罗望子多糖发酵后肠道菌群丰富度显著增加而α-多样性指数(Ace、Chao1、Shannon)显著降低;门水平显示,厚壁菌相对丰度显著升高,而拟杆菌、变形菌相对丰度显著下降;属水平显示,乳酸杆菌、副杆状菌、普氏菌和柔嫩梭菌等益生菌的相对丰度显著增加,志贺氏菌、多尔氏菌等致病菌的相对丰度显著降低,表明其可有效调节肠道菌群结构。崔琳琳等[84]利用体外肠道模型研究苦荞抗性淀粉的益生元作用,研究表明苦荞抗性淀粉有良好的益生效果:可以降低肠道内pH,提高乙酸、丙酸、丁酸、乳酸含量,增殖双歧杆菌、乳酸菌,抑制大肠杆菌、产气荚膜菌。
4 存在问题与展望
目前,绝大多数食物源抗便秘因子的研究仅限于验证其抗便秘功效,未见分型分类等系统性研究,抗便秘机理的探索也较少,总体而言“研究不深入,未形成体系”。这种研究现状可能因为食物源抗便秘因子作为食品科学与医学的交叉领域,存在研究盲区和技术壁垒。以下,笔者列举出食物源抗便秘因子存在的具体问题及其未来发展的方向。
4.1 存在问题
4.1.1 构建动物模型方法有缺陷 目前采用的建模方法是《保健食品检验与评价技术规范实施手册(2003 年出版)》(通便功能检验方法,动物试验)。其原理是,使用SPF 级小鼠(盆底肌正常,无出口梗阻障碍的小鼠),经口灌胃给予造模药物盐酸洛哌丁胺或复方地芬诺酯,建立小鼠小肠蠕动抑制模型。盐酸洛哌丁胺和复方地芬诺酯能有效抑制肠平滑肌收缩,小肠、结肠和直肠平滑肌均受到抑制,且抑制效率沿路径方向递减。所以,该模型消化功能和通便功能均受抑制,并且消化功能抑制更强。
因此,建立更精确的动物模型是抗便秘研究的重要方向,但是目前鲜有报道。新模型未建立时,仍可以采用上述建模方法判断有无抗便秘的功效。
4.1.2 未明确对症的功能性便秘类型 目前,大多数抗便秘因子的研究只探讨润肠通便效果,未见到其是否对症慢传输型或出口梗阻型便秘的相关研究。上文提到,功能性便秘两种主要类型的致病机理不同,其治疗手段有差异。结肠动力不足和直肠动力不足分别是慢传输型和出口梗阻型便秘的主要特征[8−9],所以抗便秘因子能否到达结肠或直肠,将是评价其对症便秘类型的重要依据。
“效用递减”规律下,不是所有的抗便秘因子都可以到达结肠或直肠。结、直肠壁细胞结构相似,是各类型抗便秘因子的靶向部位,抗便秘因子随肠道运输路径依次发挥功效并随之消耗,所以“效用递减”。例如火麻仁油中含有γ-亚麻酸(γ-Linolenic acid,GLA),是前列腺素的前体物质,前列腺素参与肠壁细胞神经传导[13],在“效用递减”规律下,按照小肠、结肠、直肠顺序衰减,结肠为大便泻下相关的主要作用部位。另外,消化系统中消化酶和肠道微生物的分解吸收,加剧了抗便秘因子的“效用递减”。
综上所述,笔者推断:食物源抗便秘因子在肠道中沿肠道运输方向“效用递减”,并且抗便秘因子能否到达结肠或直肠,将对症不同的功能性便秘类型。此假设有待于实验数据验证,可以借助医学上结、直肠传输试验和压力检测,绘制效用衰减曲线来验证。
4.2 未来展望
4.2.1 缓释技术强化食物源抗便秘因子 采用缓释技术强化抗便秘因子能实现结肠或直肠靶向,是最有希望使抗便秘因子到达直肠对症出口梗阻型便秘的现代技术。抗便秘因子共同缺陷是,在消化系统作用下,大部分被分解吸收,其抗便秘功效沿出口方向效用递减。到达结肠时效用已经衰减,能否到达直肠、到达直肠后其含量是否起效,尚为未知。缓释控制技术可以改善此情况,但尚需进一步验证。
传统缓释技术采用表面活性剂稳定乳液包埋活性成分。但是,人们发现无机颗粒会引起刺激、破坏人体组织并产生环境问题[85]。高内相皮克林乳液(High internal phase Pickering emulsion,HIPPE)较传统乳液有更好的稳定性和潜在应用前景[86]。
目前,基于生物聚合物的高内相皮克林乳液缓释技术已成为热点领域。本文对近期以生物聚合物为载体的高内相皮克林乳液研究成果进行汇总(表4),发现学者多研究两个方向:开发新的一元或多元生物聚合物载体;开发天然或改性的纳米载体,其稳定性和生物利用度更高[87],肠靶向和受控的递送功能更强[88]。

表4 目前HIPPE 生物聚合物载体研究方向及内容Table 4 Current research direction and content of HIPPE biopolymer carrier
此外,缓控释技术的评价方法在逐渐完善。体外胃肠道消化发酵模型参数的不断修正[72],有助于判断携带抗便秘因子的高内相皮克林乳液稳定性和缓释效果。
4.2.2 开发高效抗便秘因子产品 食物源抗便秘因子种类丰富,包含膳食纤维、抗性淀粉、低聚糖、脂肪酸等。各类食物中均存在相关物质,但是目前食物源抗便秘因子研究载体仅有香蕉、大豆、麦麸、燕麦、薯类、芦笋、果蔬、果皮及果蔬加工副产物等,究其原因是抗便秘因子含量较低的食物没有突出的抗便秘功效,传统意义上不被人们认为有抗便秘功效。如果按照抗便秘因子的分类,从各类食物中有目的地提取食物源抗便秘因子,通过富集、组合、强化缓释等方式,有可能开发出更高效的抗便秘因子产品。
5 结语
功能性便秘是一种常见慢性病,不但患者群体数量多,而且患者几乎终身携带,并且可能随生活习惯改变、年龄增大而恶化。食物源抗便秘因子研究的目的是帮助慢性便秘患者缓解慢性便秘症状,因此建立食物源抗便秘因子研究体系有深刻的科技和社会学意义。同时,食物源抗便秘因子的研究要通过功能性便秘类型自我诊断理论、抗便秘因子分型分类及对症理论、抗便秘因子机理研究、现代缓释技术等理论技术的发展才能逐步进步和完善。

