HPLC 法测定保健食品B 族维生素片中9 种维生素B 的含量
谭婉清,王术玲 ,关日晴
(1.广州中医药大学中药学院,广东广州 510006;2.广东省药品检验所,广东广州 510663)
水溶性维生素是人体维持正常生理功能所必需的一类微量有机物质,适量摄取对人的生长、代谢、发育都具有积极的促进作用[1−4],而过量摄入却会造成严重危害,如过量摄入维生素B6会对神经产生较大的不良影响,导致一些神经毒素的产生,并大幅度影响人们的肢体感官;维生素B1的大量使用会对人体的诸多新陈代谢环节产生很大的影响,最终导致人体产生头晕、恶心、心律失常、眼花等现象;维生素B12的过量使用也会导致人体另一种营养素叶酸的缺乏,同时导致心脏病患者病情的进一步加重[5]。由此可见,需要科学、合理地控制维生素的摄入量。
随着食品工业的发展和人们对保健食品需求程度的日渐提高,市场上出现了各类添加维生素B 的保健食品,虽然已引起了质量监督部门极大的重视,但目前我国针对此类商品功效成分检测的相关标准[6−8]并未完善,在实际应用中只能参考食品标准或药典[9−16]。其中,GB/T 5009.197-2003 在流动相中加入对柱效及泵损害较大的离子对试剂;GB 5009.84-2016 用到气味较大的正丁醇,前处理需要繁琐的衍生化,并且测定时受衍生产物在4 h 内稳定的限制;食品标准中测定烟酸、烟酰胺、叶酸、泛酸和生物素的仲裁法为微生物法,该方法普遍存在操作繁琐、测定时间长、测定误差大、测定结果重复性差等不足。这些方法并不适用于基质相对简单的保健食品,会降低待测组分的回收率。近年来,液相色谱-质谱联用检出限低,准确度高,备受科研人员的青睐[17−20],但是质谱仪器价格较贵、日常维护费用也很高,很难在基层普及,另外,对于常量的维生素而言,容易污染仪器,造成仪器残留。文献报道[21−24],用普通高效液相色谱法测定维生素B 的并不少,但覆盖维生素B1、维生素B2、维生素B6、烟酸、烟酰胺、泛酸、叶酸、生物素和维生素B12这9 种常见成分进行含量测定的研究尚未见报道。
本研究旨在建立一种简便、快速、准确的高效液相色谱-二极管阵列(HPLC-DAD)检测方法,适用于保健食品B 族维生素片中9 种维生素B 成分的含量测定,以期提高检测分析效率,并降低检测成本。
1 材料与方法
1.1 材料与仪器
10 批B 族维生素片 9 批来自2018~2019 年保健食品监督抽验样品,1 批来自2017 年保健食品委托检验样品;9 种维生素标准品:维生素B1(纯度为97.9%)、维生素B2(纯度为98.2%)、维生素B6(纯度为98.2%)、烟酸(纯度为99.8%)、叶酸(纯度为89.3%)、泛酸钙(纯度为96.8%)、生物素(纯度为99.5%)、维生素B12(纯度为90.5%) 中国食品药品检定研究院;烟酰胺 纯度为99.5%,Dr.Ehrenstorfer GmbH;甲醇 色谱纯,霍尼韦尔国际公司;水 超纯水;其他试剂为分析纯 广州化学试剂厂。
Agilent 1260 高效液相色谱仪-二极管阵列检测器 美国安捷伦公司;CPA224S 万分之一电子天平德国赛多利斯集团;XS205DU 十万分之一电子天平 梅特勒-托利多集团;KQ-500DE 数控超声波清洗器 昆山市超声仪器有限公司;Milli Q Advantage with A10 超纯水发生器 默克密理博公司;LD5-2B离心机 北京京立离心机有限公司。
1.2 实验方法
1.2.1 溶液的配制
1.2.1.1 标准储备液 酸性储备液:精密称取维生素B1、维生素B2、维生素B6、烟酸和烟酰胺各20 mg于100 mL 容量瓶中,加适量0.1%盐酸,60 ℃超声(功率500 W,频率40 kHz)溶解,约10 min,放置至室温,用0.1%盐酸定容至刻度,摇匀,即得各成分浓度为200 μg/mL 的酸性混合储备液。
碱性储备液:精密称取20 mg 叶酸于100 mL 容量瓶中,用0.3%氨溶液溶解并定容至刻度,摇匀,即得浓度为200 μg/mL 的碱性储备液。
中性储备液:精密称取维生素B1210 mg 于50 mL 容量瓶中,用水溶解并定容至刻度,摇匀,即得200 μg/mL 的维生素B12对照液。精密称取泛酸20 mg 和生物素10 mg 于100 mL 容量瓶中,精密移取上述200 μg/mL 的维生素B12对照液20 mL 至此100 mL 容量瓶中,再加适量水,超声溶解并定容至刻度,摇匀,即得泛酸浓度为200 μg/mL、生物素浓度为100 μg/mL、维生素B12浓度为40 μg/mL 的中性混合储备液。
1.2.1.2 标准工作溶液 维生素B1、维生素B2、维生素B6、烟酸和烟酰胺的标准工作溶液:精密吸取上述酸性混合储备液0.1、0.5、0.5、1.0、2.5、5.0 mL 分别至20、20、10、10、10、10 mL 的容量瓶中,用0.1%盐酸稀释至刻度,即得维生素B1、维生素B2、维生素B6、烟酸和烟酰胺的混合标准工作溶液,经0.45 μm 的水相微孔滤膜过滤,备用。
叶酸的标准工作溶液:精密吸取上述碱性储备液0.1、0.5、0.5、1.0、2.5、5.0 mL 分别至20、20、10、10、10、10 mL 的容量瓶中,用0.3%氨溶液稀释至刻度,即得叶酸的标准工作溶液,经0.45 μm 的水相微孔滤膜过滤,备用。
维生素B12、泛酸和生物素的标准工作溶液:精密吸取上述中性混合储备液0.1、0.5、0.5、1.0、2.5、5.0 mL 分别至20、20、10、10、10、10 mL 的容量瓶中,用水稀释至刻度,即得维生素B12、泛酸和生物素的混合标准工作溶液,经0.45 μm 的水相微孔滤膜过滤,备用。
1.2.1.3 标准曲线绘制 将标准工作溶液进样分析,分别以9 种维生素B 的浓度为横坐标,峰面积响应值为纵坐标,绘制系列标准曲线,进行线性回归,得到9 种维生素B 的标准曲线线性回归方程。
1.2.2 样品的前处理
1.2.2.1 维生素B1、维生素B2、维生素B6、烟酸、烟酰胺 称取混合均匀样品0.1 g 至于50 mL 离心管中,准确加入0.1%盐酸10 mL(个别样品超曲线范围进行适当稀释),摇匀,60 ℃超声(功率500 W,频率40 kHz)处理15 min,中途振摇一次,冷却至室温,摇匀,静置或离心(4000 r/min 离心10 min),上清液经0.45 μm 的水相微孔滤膜过滤,即得。
1.2.2.2 叶酸 称取混合均匀样品0.5 g 至于50 mL离心管中,准确加入0.3%氨水10 mL,摇匀,60 ℃超声(功率500 W,频率40 kHz)处理15 min,中途振摇一次,冷却至室温,摇匀,静置或离心(4000 r/min 离心10 min),上清液经0.45 μm 的水相微孔滤膜,即得。
1.2.2.3 泛酸、生物素、维生素B12称取混合均匀样品1 g 至于50 mL 离心管中,准确加入超纯水10 mL,摇匀,60 ℃超声(功率500 W,频率40 kHz)处理15 min,中途振摇一次,冷却至室温,摇匀,静置或离心(4000 r/min 离心10 min),上清液经0.45 μm的水相微孔滤膜过滤,用于测定生物素与维生素B12,稀释10 倍用于测定泛酸。操作过程应避免强光照射。
1.2.3 色谱条件 色谱柱:COSMOSIL C18(5 μm,4.6 mm×250 mm);流速:0.5 mL/min;柱温:25 ℃;进样量:10 μL;检测波长:泛酸和生物素:205 nm,维生素B1、维生素B2、烟酸和烟酰胺:256 nm,维生素B6和叶酸:287 nm,维生素B12:361 nm;检测器:二极管阵列检测器(DAD);流动相:A 为甲醇,B 为0.1 mol/L 的磷酸二氢钾,梯度洗脱:0.00~8.00 min,A 由5%递增至20%,8.00~8.01 min,A 由20%快速增至55%,8.01~16.00 min,A 保持55%,16.00~17.00 min,A 由55%递减至5%,17.00~28.00 min,A 保持5%。
1.3 数据处理
方法学考察中重复性平行测定6 份,回收率测定三组9 份,适用性样品测定2 份,采用Microsoft Office Excel 2007 进行数据处理,结果以平均数表示。
2 结果与分析
2.1 溶剂的选择
保健食品B 族维生素片基质相对简单,其中的9 种维生素B 成分均为水溶性维生素,但化学结构并不相关,理化性质和色谱行为差异较大,所以要在同一个溶剂下同时测定B 族维生素片的9 种成分比较困难。维生素B12易溶于水和乙醇,在强酸(pH<2)和碱性溶液中易分解,导致其检测结果偏低[25−26]。维生素B1在酸性条件下稳定,在中性和碱性中稳定性差[27]。维生素B2、泛酸在碱性条件下不稳定,叶酸和泛酸在酸性条件下不稳定[28]。维生素B6在空气与酸性溶液中稳定,但在碱性溶液中易被破坏[29]。因此,本实验用酸溶液提取测定维生素B1、维生素B2、维生素B6、烟酸和烟酰胺;用碱溶液提取叶酸;用水提取泛酸、生物素和维生素B12,以确保样品中的成分稳定,结果可靠。
本实验比较了盐酸含量为0.05%、0.1%、0.3%和0.5%对样品提取的影响,经试验,维生素B1随着盐酸含量增加,出峰时间提前,0.3%盐酸提取液中维生素B1开始有干扰(见图1),维生素B2、维生素B6和烟酰胺用0.1%盐酸提取比用0.05%盐酸提取效果稍好些,所以选用了0.1%盐酸作为维生素B1、维生素B2、维生素B6、烟酸和烟酰胺的提取液。参照《中华人民共和国药典》(二部)叶酸“含量测定”项,叶酸用0.3%氨溶液作为提取溶剂。

图1 不同含量盐酸提取样品的液相色谱图Fig.1 Liquid chromatograms of samples extracted with different contents of hydrochloric acid
2.2 提取条件的选择
比较了20、30、40、60 ℃各超声(功率500 W,频率40 kHz)处理15 min 的样品中各成分的响应值,以20 ℃测得的响应值为基底,折算出20、30、40、60 ℃的相对峰面积(相对峰面积=不同温度提取的峰面积/20 ℃提取的峰面积×100),绘制柱形图,总的来说60 ℃条件下提取相对较好。再比较60 ℃超声(功率500 W,频率40 kHz)处理15、30、45、60 min 的样品中各成分的响应值,以15 min 测得的响应值为基底,折算出15、30、45、60 min 的相对峰面积(相对峰面积=不同超声时间提取的峰面积/15 min 提取的峰面积×100),绘制柱形图,结果显示差异不明显,所以确定提取条件为60 ℃超声15 min,见图2。

图2 不同温度(A)和不同超声时间(B)的提取效果比较Fig.2 Comparison of extraction effects at different temperatures (A) and ultrasonic time (B)
2.3 流动相的选择
高效液相色谱法测定维生素B 的标准及文献中很多用到了离子对试剂,离子对试剂平衡时间长,而且对柱子寿命影响比较大,所以本研究不考虑离子对试剂。参考标准,遴选出流动相中可以添加乙酸钠和磷酸二氢钾,本实验对乙腈-水、甲醇-水、甲醇-乙酸钠(0.05 mol/L)、甲醇-磷酸二氢钾(0.01 mol/L)、甲醇-磷酸二氢钾(0.05 mol/L)和甲醇-磷酸二氢钾(0.1 mol/L)不同流动相进行了考察。结果显示甲醇-乙酸钠(0.05 mol/L)体系中在205 nm 波长下基线波动大,不利于泛酸和生物素的测定,乙腈-水和甲醇-水体系中有些成分难以被洗脱,甲醇-0.1 mol/L 磷酸二氢钾体系的分离效果最好,为本实验的最终流动相,见图3。
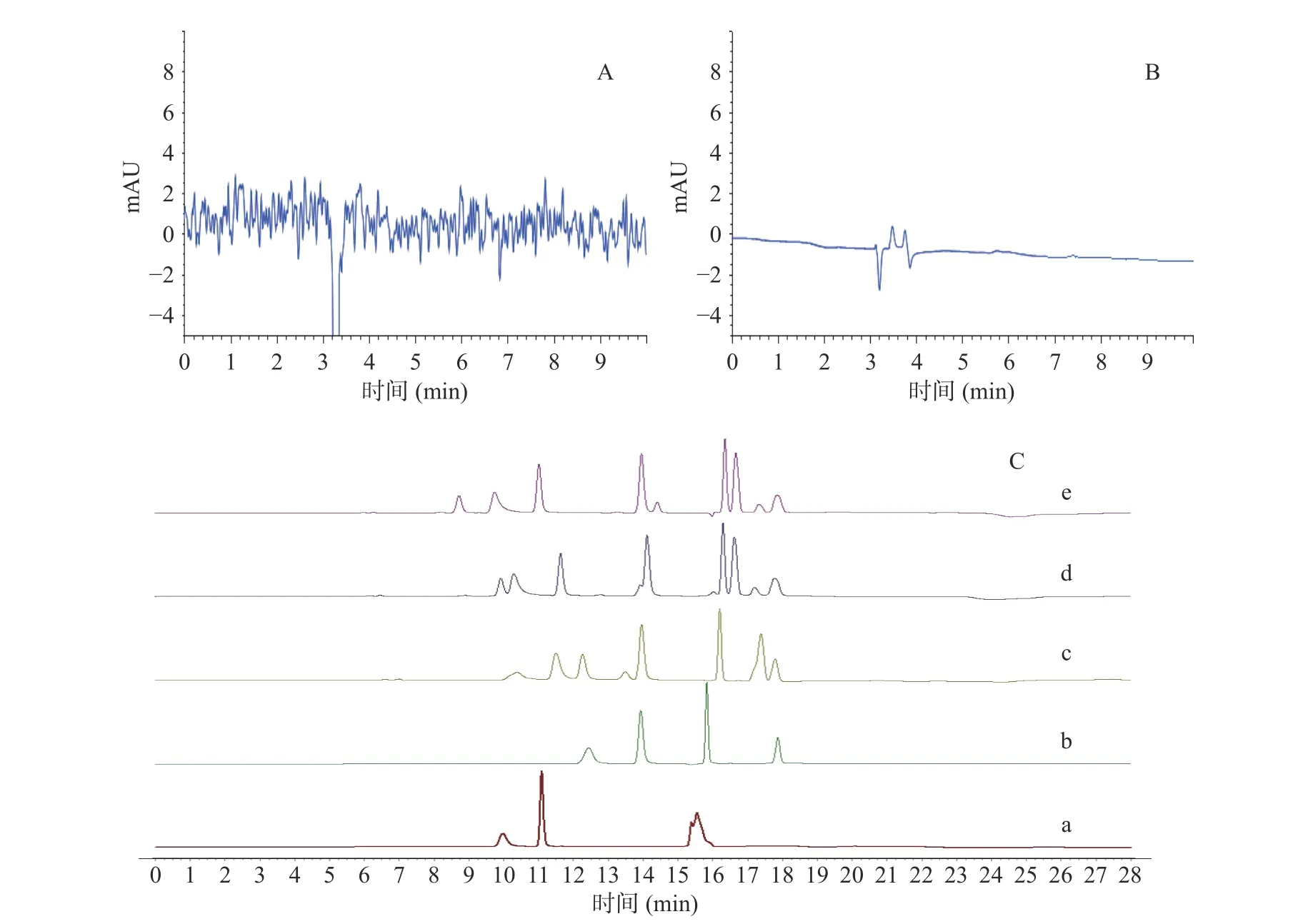
图3 不同流动相体系下20 μg/mL 混合标准品溶液的液相色谱图Fig.3 Liquid chromatograms of 20 μg/mL mixed standard solution under different mobile phase systems
2.4 流速与柱温的选择
固定柱温为28 ℃,比较了0.5、0.8、1.0 mL/min的出峰情况,实验结果显示,0.5 mL/min 的条件下,叶酸和维生素B12的分离效果最好,其他成分之间的分离度都大于2,所以选用0.5 mL/min。分离度见表1。

表1 不同流速和柱温的分离度Table 1 Resolution of different flow rates and columm temperatures
在0.5 mL/min 的条件下,比较了柱温分别为20、25、30、35 ℃的出峰情况,实验结果显示,温度越低,叶酸和B12的分离度越大,20、25、30、35 ℃温度下叶酸和B12的分离度分别为2.60、2.30、2.01、1.69,但泛酸和烟酰胺20 ℃时的分离度为1.95<2,所以选用25 ℃。分离度见表1。
2.5 波长的选择
混合标准溶液经C18柱分离后,由二极管阵列检测器于190~550 nm 波长范围内扫描,获得各化合物的吸收光谱图,维生素B1的光谱在242 nm 处有强吸收峰,维生素B2的光谱在266 nm 处有强吸收峰,烟酸、烟酰胺的光谱在260 nm 处有强吸收峰,维生素B6的光谱在290 nm 处有强吸收峰,叶酸的光谱在284 nm 处有强吸收峰,维生素B12的光谱在361 nm处有强吸收峰,泛酸和生物素没有明显的强吸收峰,参考GB/T 22246-2008[7]在200 nm 处测定泛酸,GB/T 17778-2005[30]在210 nm 处测定生物素,为兼顾多种组分的同时检测,并综合考虑灵敏度等因素,泛酸和生物素的检测波长为205 nm,维生素B1、维生素B2、烟酸、烟酰胺的检测波长为256 nm,维生素B6和叶酸的检测波长为287 nm,维生素B12的检测波长为361 nm,标品的检测结果见图4。

图4 20 μg/mL 混合标准品溶液的液相色谱图Fig.4 Liquid chromatograms of 20 μg/mL mixed standard solution
2.6 方法学考察
2.6.1 方法的线性及方法检出限浓度 在试验条件下,对标准工作溶液进行测定。结果表明9 种维生素B 均在各自线性范围内有良好的线性关系,决定系数R2均大于0.999。取维生素B 的标准品,以信噪比(S/N)3~5 配制检出限溶液,按本方法最大取样量1 g,最小稀释倍数10,计算检出限(LOD)。见表2。

表2 9 种维生素B 的线性回归方程、线性关系和LODTable 2 Linear regression equation,correlation coefficient and LOD of 9 kinds of vitamin B
2.6.2 重复性 烟酰胺是烟酸的酰胺化合物,通常不会同时添加在同一样品中,所以通过样品1 和样品2 来完成9 种成分的重复性试验。在相同的仪器条件下,按照1.2.2 实验步骤,分别测得样品1 中维生素B1、烟酰胺、维生素B2、维生素B6、叶酸、泛酸、生物素及维生素B12的含量,按照1.2.2.1 实验步骤,分别测得样品2 中烟酸的含量,结果表明重复性良好,其RSD 见表3。

表3 9 种维生素B 的重复性和稳定性(n=6)Table 3 Repeatability and stability of 9 kinds of vitamin B (n=6)
2.6.3 稳定性考察 在相同的仪器条件下,对同一混合标准工作溶液(20 μg/mL)进行0、1、2、4、8、16、24、36、48 h 进样测定,可以看出9 种维生素B 保留时间稳定,峰面积的相对标准偏差(RSD)≤0.8%(n=9),结果表明,维生素B 族9 种成分48 h 内的稳定性良好,其RSD 见表3。
2.6.4 方法回收率 通过样品1 和样品2 来完成9 种成分的回收试验。精密称取9 份同批次样品1,按样品各成分含量约80%、100%、120%高中低三个水平加入各标准溶液,每个水平各3 份样品,按照1.2.2 实验步骤,分别测得样品1 中三个水平的维生素B1、烟酰胺、维生素B2、维生素B6、叶酸、泛酸、生物素及维生素B12的浓度并计算回收率,精密称取9 份同批次样品2,按样品烟酸含量约80%、100%、120%低中高三个水平加入烟酸标准溶液,每个水平各3 份样品,按照1.2.2.1 实验步骤,测得样品2 中三个水平的烟酸浓度并计算回收率。结果显示平均回收率为91.8%~106.9%,RSD 为0.2%~4.8%,可以满足维生素B 族9 种成分的检测要求,各回收率及RSD 见表4。

表4 9 种维生素B 的回收率Table 4 Recoveries of 9 kinds of vitamin B
2.6.5 适用性 为考察方法的普遍适用性,采用本试验方法,对收集的9 个品种10 批次B 族维生素片样品进行检测,并与检验标准规定的方法测定结果进行比较,2 号和3 号样品的检验标准并没有对维生素B6、叶酸、泛酸及维生素B12作要求,其它结果与本方法结果的相对偏差在允许范围内,表明本方法适用于B 族维生素片中9 种维生素B 的含量测定,见表5。

表5 10 批样品的维生素B 含量(mg/g)Table 5 Contents of vitamin B in 10 samples (mg/g)
3 结论
在本研究建立的HPLC 色谱条件下,9 种维生素B 成分能得到较好的分离。线性、精密度、稳定性、重复性和回收率等试验结果表明,本方法灵敏、快速、准确,适用于保健食品B 族维生素片中9 种维生素B 的含量测定。与目前的国家标准和文献报道的方法相比,在保证准确性好、灵敏度高的同时,尽可能省去了复杂的前处理,降低了检测成本,提高了检测效率。从实际样品的测定实验发现,个别产品(本实验中的2、3 号样品)标签有添加维生素B6、叶酸、泛酸及维生素B12这几种成分,但企业标准中并没有作相应的要求,检验机构一般按标准检验,从而造成监管漏洞,该方法可快速测定B 族维生素片中9 种维生素B 成分的含量,尤其适用于大批量的监督抽验,可为该类保健品质量标准的制定提供定量依据,为监督B 族维生素类保健食品市场提供保障。

