酶及酶技术在茶叶深加工中的应用
费 璠 刘昌伟 牛 丽 刘仲华,3
(1. 湖南大众传媒职业技术学院,湖南 长沙 410100;2. 湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;3. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
茶,作为世界最受欢迎的饮料之一,在全世界60多个国家和地区均有种植[1]。近年来,随着中国茶园面积和茶叶产量的逐年增加,对茶叶品质要求也越来越高。然而,因夏秋茶滋味偏苦涩,品质相对较低,不少茶区对夏秋茶鲜叶实行弃养、弃采的策略。据调查[2],中国夏秋茶鲜叶中有30%~40%的已停止采摘,造成夏秋茶资源的极大浪费。夏秋茶具有生长迅速、芽头肥壮、茶多酚等物质积累多等优点,提质增效潜力大[3]。随着中国茶园面积的快速扩大,茶叶产量也同步快速增加,如何通过深加工技术提高过剩的茶叶资源(尤其是夏秋茶)利用效益,是推进中国茶产业高质量发展过程中日益突出的问题。
茶叶中的活性成分复杂多样,部分茶叶活性成分由于自身结构的特点,难以被传统的提取分离技术高效提取,且稳定性不强、生物利用度低,限制了其应用开发[4]。酶,绝大多数是生物大分子蛋白,在几乎所有的生物过程中都能高效、特异地加快生物化学反应。酶的催化活性、特异性和选择性使其在生物催化、生物传感器和生物医学等领域具有广阔的应用前景[5]。随着生物技术的发展,使用酶制剂开发绿色、可持续生物工艺方面的研究已成为热点[6]。外源酶被广泛应用于茶叶深加工领域,可更加绿色、高效的提取、分离、制备或修饰茶叶功能成分,以实现茶叶资源的高效利用。
酶技术在功能成分等茶叶深加工领域的应用主要包括三大部分:酶法提取、酶法合成、生物酶修饰茶叶提取物。酶法提取是利用果胶酶等水解茶叶细胞壁等,破坏细胞结构,促进茶叶内含物质溶出,提高茶叶活性成分的提取率[7],如茶多酚、儿茶素等物质的提取。酶法合成茶叶有效成分主要研究了利用酶催化合成茶黄素以及酶法合成茶氨酸等。生物酶修饰茶叶提取物可改善其稳定性,提高茶叶提取物的生物利用度,改变茶叶提取物的重要官能团,显著提高其生物活性[8]。而固定化酶技术是将生物酶固定到一种特殊材料上,从而使酶的稳定性、使用周期等大大增强。固定化酶能够高效、循环多次地利用于茶叶提取物的加工过程中,大大降低了茶叶深加工的生产成本,降低能耗,提升提取物质量,增加产品的附加值[9]。研究拟从酶法辅助提取、酶法辅助合成、生物酶修饰茶叶提取物以及固定化酶技术等方面对近年来国内外酶技术在茶叶深加工中的应用情况进行综述,以期为茶叶资源的高效开发与利用提供借鉴。
1 酶法辅助提取
从茶叶中提取儿茶素等活性成分通常是使用热水浸提,该法能耗较高,且存在部分活性物质难以完全提取或是因加热而发生异构化/氧化降解等问题,进而大大降低了活性成分的提取效率。茶叶有效成分往往存在于细胞中,因此,能否充分破坏细胞壁是高效提取茶叶有效成分的关键。植物的细胞壁主要由纤维素和果胶组成[10],纤维素酶和果胶酶在一般条件下即可破坏茶叶细胞壁,并在加速内含成分析出的同时,减少香气物质的损失[11]。此外,酶促反应还能进一步促进芳香物质的生成;而提取过程中,纤维素等多糖类物质的水解使可溶性糖含量增加,从而增进了茶多糖的丰度,还增加了茶多糖的抗氧化效率[12]。使用纤维素酶和果胶酶复合酶提取茶多酚,能够显著提升茶多酚浸提率,且得到的茶多酚具有优异的抗氧化性[13]。此外采用复合酶解—回流萃取法制备红茶提取物,提取效率将进一步提升[14]。茶叶中的酯型儿茶素易与蛋白质等反应形成茶乳酪,造成“冷后浑”[15]。因此在速溶茶的生产中需要除去茶乳酪。武永福等[16]研究发现单宁酶可切断酯型儿茶素中儿茶素与没食子酸间的酯键,转化得到简单儿茶素和一个没食子酸,减少茶乳酪的形成从而提高茶饮料的澄清度,降低茶汤苦涩度、使速溶茶口感有较大提升。
酶制剂现已被广泛应用于茶叶深加工中,在提高茶叶附加值的同时,较好地促进了夏秋茶资源的合理利用。目前,酶制剂仍存在成本高、酶活低等问题。但随着酶工程技术的高速发展,酶技术将推动茶叶提取乃至植物提取行业更加高效健康的发展。
2 酶法辅助合成
2.1 茶黄素酶促合成
茶黄素是由茶叶中的多酚氧化酶(polyphenol oxidase, PPO)等关键酶催化儿茶素氧化合成[17],是红茶中的“黄金分子”,具有抗炎、抗氧化等优异的生物活性[18-20]。但红茶中茶黄素含量偏低,难以分离提取,因此,体外酶法合成是获取茶黄素的有效途径。
目前体外模拟氧化合成茶黄素的研究主要集中在酶源筛选方面。现有研究[21]表明,茶鲜叶、梨等植物酶以及微生物酶作为酶源均能有效催化茶黄素的体外合成。于酶源的茶黄素合成系统中[22],加入底物儿茶素,茶PPO并通氧,在浓度为55 mmol/L的(表儿茶素EC、表没食子儿茶素EGC、表儿茶素没食子酸酯ECG、表没食子儿茶素没食子酸酯EGCG等)儿茶素系统内发酵30 min后,茶黄素较传统合成方式提高了68%,在发酵系统中底物消耗的顺序是EC>EGCG>EGC>ECG[23]。同时,在反应过程中采用分批加料的方式,也能显著提升茶黄素的产量[24]。Narai-Kanayama等[25]发现,茄子PPO在25 ℃,pH值4.5,底物质量浓度2.5 g/L,35 mL酶(活力196 U)的条件下催化儿茶素反应40 min得到茶黄素7.45 mg。Zhou等[26]以酪氨酸酶Bmtyrc为对象的研究,采用定向进化的方法得到多酚氧化酶,其催化性能明显优于野生型的突变体蛋白Bmtyrc-3,这种酶对EGCG和ECG的比活力分别提高了6.46倍和4.91倍。使用突变体Bmtyrc-3催化合成TFDG,产率可达35.35 mg/g,具有潜在的工业化应用价值。此外,有研究[27]比较了酪氨酸酶、漆酶、胆红素氧化酶和茶粗PPO活性,并用其催化合成茶黄素,其中酪氨酸酶催化效率最佳。值得注意的是,双酶(m梨PPO∶m真菌漆酶=1∶1)合成茶黄素的产率比单一使用梨PPO和真菌漆酶提高了18.4%和12.9%[28]。说明两种酶可能相互协作,推动儿茶素氧化向着合成茶黄素的方向进行,显著提升茶黄素合成效率。两种酶在催化过程中相互补足,最大效率催化茶黄素的合成,这可能是未来的发展方向之一,但双酶系统也可能产生更多的副产物,相关研究仍需深入探索。
上述研究说明植物氧化酶是一种能够有效催化合成茶黄素的酶,但由于不同来源的专一性不同,酶活力不足,生产成本高,分离纯化困难等因素,使得目前茶黄素酶促合成研究大多处于实验室研究阶段,较少运用于产业化合成。
2.2 茶黄素单体合成
茶黄素单体主要包含4种:茶黄素(Theaflavin,TF)、茶黄素-3-没食子酸酯(Theaflavin-3-gallate,TF-3-G)、茶黄素-3′-没食子酸酯(Theaflavin-3′-gallate,TF-3′-G)和茶黄素双没食子酸酯(Theaflavin-3,3′-digallate,TFDG),由于其结构极度相似(图1),分离纯化难度大[29]。因此,以外源酶催化儿茶素单体定向合成茶黄素并结合色谱等纯化方法能够有效制备茶黄素单体。Teng等[30]从茶鲜叶中纯化得到两种酶(PPO1和PPO2),并用其与EGC、EGCG等反应,发现PPO1对儿茶素底物更具催化活性,PPO1仅催化TF合成,而PPO2能够有效催化合成TFDG。但PPO酶提取效率低,难以规模化生产。在未来可通过转基因技术将茶树PPO基因转导于微生物中并使其高表达,规模化产生PPO,专一催化合成茶黄素单体。
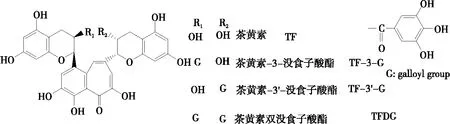
图1 4种茶黄素的结构式
通过培养茶树细胞得到的PPO酶也可催化EC和EGC有效合成TF,最终合成TF 395 mg,回收率70%[31]。该方法合成茶黄素效率高,但由于反应体系含有其他儿茶素,导致生成其他茶黄素组分,为单体分离纯化增加了难度。使用酪氨酸酶在1-辛醇和缓冲液双相系统中催化合成TF-3-G的产率显著提升[32],在酶促反应中EGCG醌优先二聚化,而辛醇相中的自身二聚化被抑制, EGCG醌参与ECO偶联,从而有效地产生TF-3-G。但由于使用过多的有机试剂,其运用前景还有待探讨。吴光亮等[33]利用皇冠梨PPO催化EGCG和ECG合成TFDG,在最优条件下反应60 min后,结合色谱技术分离得到纯度为97%的TFDG,得率为85%。但梨中酶含量少且不同产地酶活力差异巨大,此研究目前只停留在实验室阶段,难以运用到TFDG生产中,仍需深入探索。
总之,使用酶催化儿茶素合成茶黄素单体,可降低分离纯化茶黄素难度,为茶黄素单体的大规模生产提供可能。而筛选出合适的酶则是该工艺的关键步骤,生物酶在催化合成茶黄素及茶黄素单体方面的研究将大有可为。
2.3 茶氨酸合成
L-茶氨酸是茶叶的一种特有氨基酸,是茶叶中重要的品质与功能成分,具有安神镇静等多种生物活性,被广泛应用于食品、保健品等领域[34-36]。因此,L-茶氨酸的市场需求日愈提升。目前制备L-茶氨酸的方法包括:直接从茶中提取分离、化学合成和生物合成等[37]。综合多方面考虑,生物合成是制备L-茶氨酸最优选择,其中微生物酶合成是最具潜力的方法。
在大肠杆菌中异源表达γ-谷氨基甲酰胺合成酶和多聚磷酸激酶,并利用重组酶耦联催化合成L-茶氨酸,成品纯度可达到98.51%[38]。以γ-谷氨酰转肽酶催化合成L-茶氨酸,在500 mL的体系中,添加0.2 mol/L谷氨酰胺,1.8 mol/L乙胺,0.4 mol/L HCl,3 U transferγ-GGT粗酶液、0.06 mol/L NH4HCO3,1 mmol/L Mg2(OH)2CO3,在pH 9.7,30 ℃的条件下,反应36 h,茶氨酸产量为26.45 g/L,底物转化率可达86%[39]。根据L-茶氨酸合成机制,研究人员[40]从茶树根际土壤筛选出了具有高产L-茶氨酸能力的优势菌株。该菌株合成的酶催化合成L-茶氨酸产量达到2.945 g/L。Suzuki等[41]利用γ-谷氨酰胺转肽酶催化L-谷氨酰胺和乙胺反应生产茶氨酸,转化率可达60%。反应条件温和,绿色高效,产物无毒且活性高。然而,由于现有研究受到技术的限制,对高产L-茶氨酸合成酶的菌株筛选、培养与合成酶的高表达及固定化、合成酶催化合成L-茶氨酸等关键技术难点尚未取得关键性突破,生物酶合成L-茶氨酸,成本高,产品单价高,受到化学合成茶氨酸的冲击等因素,生物酶催化合成L-茶氨酸仍需更深入的研究。
3 生物酶修饰茶叶提取物
众多茶叶提取物如EGCG具有结构不稳定、易被氧化、脂溶性差、生物利用度低等缺点[42-46],这大大限制了茶叶提取物在食品医药等领域的开发与利用。因此对茶叶提取物结构进行分子修饰,如酯化、甲基化、酰基化等衍生化已成为解决上述问题的最优办法之一[47-48]。化学修饰是当前分子改造的主要方法,但仍有一定的局限,而酶法修饰还处在探索阶段。使用酶对茶叶天然产物的结构进行修饰,不仅能提高茶叶功能成分的稳定性及生物利用度,还能提升其脂溶性和生物活性,这对茶叶活性物质的运用具有重大意义。
EGCG可用酶除去没食子酸酯,将其转化为更具活性的EGC。单宁酶可水解除去茶汤中酯型儿茶素的没食子酸酯,其自由基清除率和活性显著提高[49]。近年来,改善EGCG特性的研究主要集中在酶法和化学方法乙酰化或酯化其酚羟基[50]。生物酶修饰EGCG是提升EGCG脂溶性的较优选择。酶法酰化反应温和,未引入其他物质,使得产物分离纯化更加高效便捷。对EGCG 4个环上的酚羟基进行乙酰化或酯化,使得重构的分子由水溶性变为脂溶性。利用脂肪酶催化EGCG成功转化4种衍生物,且4种衍生物抗氧化活性均优于EGCG[51-53]。利用酶对儿茶素等进行结构改造,其条件温和,使得茶叶活性物质生物活性最大化保留。但酶生产成本过高,如何获取专一高效酶源成为关键问题。在未来可利用基因工程与发酵工程培养工程菌种生产儿茶素酯化、酰基化等所需酶制剂[54],这样可极大解决酶制剂所存在的问题,为茶叶有效成分修饰提供优质可靠的酶。
4 固定化酶技术
酶是一种可以高效控制特定化学反应的一种通用的生物催化剂。但是,天然酶酶活力低且不稳定难以利用,成本高等因素制约酶制剂的使用。酶固定化后具有稳定性增加,易从反应系统中分离且易于控制,能反复多次使用等优势[55],是催化合成茶黄素等茶叶活性成分的理想酶源(图2)。

图2 基因重组酶催化合成茶黄素
将茶叶PPO固定在聚苯胺膜中,可增加酶的热稳定性,其半衰期也远长于游离酶,使用该酶进行茶黄素合成,总转化效率达到85%[56]。该酶系统特点是无毒性,易得,催化效率高,但茶PPO提取繁琐复杂,提取工艺尚待优化。Zeng等[57]使9种物种的PPO基因在大肠杆菌中异源表达得到PPO,并将PPO固定,这些酶均能催化合成茶黄素,且活性更强,能循环使用多次。此类酶可能存在包涵体,酶无催化活性,且成本过高,目前尚处于摸索阶段。但该方法无疑是未来酶技术发展的主要方向,突破相关技术难题,未来将大有可为。Lei等[58]通过将梨PPO固定在纳米材料上得到固定化酶,并用其催化合成TFDG,产率可达42.23%,显著提高了合成效率。梨PPO固定化后,酶活性和存储周期大大增强,使用8次后仍具有85%的酶活力,极大地增强了酶的使用效率。梨PPO是目前合成茶黄素效果最佳的酶,通过该酶有望实现规模化生产茶黄素。
总之,将酶固定化技术应用于茶叶深加工中,能够大幅提升酶的使用效率促进茶叶有效成分转化效率,且能够循环多次使用,具有巨大的应用潜力。目前,虽然固定化酶技术运用于茶叶活性成分提取已有报道,但是固定化酶运用于茶叶深加工仅局限于实验室层面,难以大量生产高纯茶叶活性成分,严重阻碍了茶叶天然产物的功效研究和应用开发,酶催化技术值得进一步深入探讨。
5 展望
近年来,随着酶工程和茶叶加工技术的高速发展,酶工程技术在茶叶加工中的研究越来越多。外源酶参与茶叶加工,能够促进鲜叶中的酯型儿茶素分解,使茶叶中可溶性糖、氨基酸、茶黄素等关键品质因子增多,降低茶叶苦涩度,提升夏秋茶品质,还能为发酵茶类缩短加工周期,加速成茶品质形成。在提取茶叶有效成分时,酶制剂能有效破坏细胞结构,增加细胞通透性,促进细胞内物质的溶出、扩散和浸出,达到充分提取的目的。在速溶茶加工中,酶能去除沉淀,提高氨基酸含量赋予茶汤鲜爽的口感,减少香气的损失,改善茶汤色泽。在酶制剂合成茶叶活性物质时,酶技术能够特异性催化合成茶黄素等物质,且副产物量少易分离,反应高效绿色环保。但酶工程技术在茶叶领域的应用仍有不足,如酶源受限、生产成本高等。总的来说,酶在茶产业的应用潜力巨大,期望在未来的发展中,结合基因工程、蛋白质工程等通过转基因技术改良、诱变、驯化等方式培养菌株生产适宜应用于茶产业中的酶,并将酶固定化后更好的应用于生产。

