微生物法测定婴幼儿奶粉中泛酸含量的研究
贺 燕 钟菲菲 王晓庆 徐文泱 杨 滔
(1. 湖南省产商品质量检验研究院,湖南 长沙 410000;2. 长沙市食品药品检验所,湖南 长沙 410000)
泛酸又名维生素B5,是一种重要的水溶性维生素。它具有酸性,易溶于乙醇和水,不溶于脂类溶剂,在酸性环境中易分解,在中性环境中较为稳定,是婴幼儿乳粉中添加的重要营养强化剂[1-4]。目前泛酸的检测方法有微生物法、高效液相色谱法、酶联免疫法、超高效液相色谱—串联质谱法(UPLC-MC/MS)[5-7]。微生物法主要是利用植物乳杆菌对泛酸的特异性,在含有泛酸样品中根据生长产生的光密度来测定泛酸的含量[8],此方法灵敏度高,不仅能检测出强化泛酸,还能检测出原生泛酸,这是较仪器方法的优异之处[9]。但由于现有的微生物方法GB 5009.210—2016中关键步骤试验条件不具体(菌液浓度的把控等)、提取方法存在不足、试验过程繁琐(吸光度的测定)等,导致此方法具有操作过程既复杂,检验试验又易失败等缺点[10]。研究主要从菌种的选择、浓度的确定、样品前处理方法、吸收光度测定方法等方面进行深入研究,优化目前用于泛酸检测的微生物方法,以期为后续国标检测方法的修订提供试验依据。
1 材料与方法
1.1 材料、菌种与试剂
婴幼儿奶粉:市售;
质控样品:山东美正生物科技有限公司;
ATCC 8014植物乳杆菌、CICC 6076植物乳杆菌:上海北诺生物科技有限公司;
泛酸钙标准品:95.5%,德国DR.Ehrenstorfer公司;
乙酸钠、乙醇、盐酸:分析纯,国药集团药业股份有限公司。
1.2 仪器
电子天平:ME204E型,梅特勒—托利多仪器(上海)有限公司;
紫外分光光度计:T9型,普析通用仪器有限公司;
高压灭菌锅:HVA-85型,日本平山制作所株式会社厂;
培养箱:MIR-254型,松下电器(中国)有限公司;
酶标仪:Infinite M200型,美国Tecan公司。
1.3 试验方法
1.3.1 植物乳杆菌的选择及制备优化
本文以休闲口味调味泡菜脆口萝卜为例,引用Q10方法[5],通过加速货架期试验[6](Accelerated Shelf-life Testing,ASLT)研究了3种不同包装材质对脆口萝卜货架期的影响。为该类型的产品选择合适的包装材料提供了重要的数据支撑。
(1) 不同来源的植物乳杆菌菌种测试:GB 5413.17—2010《食品安全国家标准 婴幼儿食品和乳品中泛酸的测定》和GB 5009.210—2016《食品安全国家标准 食品中泛酸的测定》中的微生物法均采用ATCC 8014植物乳杆菌,而对于其他来源的植物乳杆菌则未提及。采用不同来源的植物乳杆菌即ATCC 8014植物乳杆菌、CICC 6076植物乳杆菌,按照GB 5009.210—2016第一法(微生物法)来测定质控样品及市售婴幼儿配方奶粉,分析不同来源的植物乳杆菌对婴幼儿奶粉中泛酸测定的影响。
(2) 菌液浓度对测定结果的影响:将保存的ATCC 8014转接到乳酸杆菌琼脂培养基上,36 ℃培养18~24 h,再将其接种于乳酸杆菌肉汤中,36 ℃培养24 h。肉汤培养物先500 r/min 离心10 min留菌液,再以2 500 r/min 离心10 min,再将沉淀物用无菌生理盐水洗涤3次。添加菌液或无菌生理盐水将透光率调至60%,70%,80%,90%,以此菌悬液作为测试菌液用来测定样品,菌液的添加量为50 μL。按照GB 5009.210—2016第一法(微生物法),研究不同浓度的菌液直接添加至待测液中对测定结果的影响。
(3) 菌液添加量对测定结果的影响:为简化菌液的制备和添加过程,制备系列5 mL乳杆菌接种肉汤,分别接种活化后的植物乳杆菌斜面培养物1环,于36 ℃培养20 h,将肉汤培养物首先500 r/min离心10 min留菌液,再将菌液以2 500 r/min离心10 min,再将沉淀物洗涤3次,充分洗涤后按2.5,5.0,10.0 mL的菌液量添加到400 mL泛酸测试培养基中,按照GB 5009.210—2016第一法(微生物法)测定质控样品,比较相同测试培养基添加不同菌液量对测定结果的影响。
1.3.2 泛酸样品前处理方法 分别采用GB 5413.17—2010水解法和GB 5009.210—2016的直接提取法,对泛酸质控样品及奶粉样品进行测定,比较不同样品前处理方法对结果的影响。
1.3.3 吸光度测定方法 吸光度的测定有紫外分光光度法和酶标仪测定方法,对质控样品、市售的5个奶粉以及加标样品按照GB 5009.210—2016第一法(微生物法)处理,分别采用紫外分光光度法和酶标仪法测定吸光度,比较吸光度测定方法对测定结果的影响。
1.3.4 加标试验 以9号样品的奶粉作为试验样品,添加10 μg加标按照GB 5009.210—2016第一法(微生物法)进行试验,本底样品和加标样品分别进行6次平行试验,分析酶标法测定对结果的影响。
2 结果与分析
2.1 植物乳杆菌的选择及制备优化
2.1.1 不同来源的植物乳杆菌菌种对测定结果的影响
用ATCC 8014植物乳杆菌和CICC 6076植物乳杆菌按照GB 5009.210—2016第一法(微生物法)检测质控样品及市售奶粉样品1号、样品2号、样品3号测定泛酸结果见表1,标准曲线见图1。
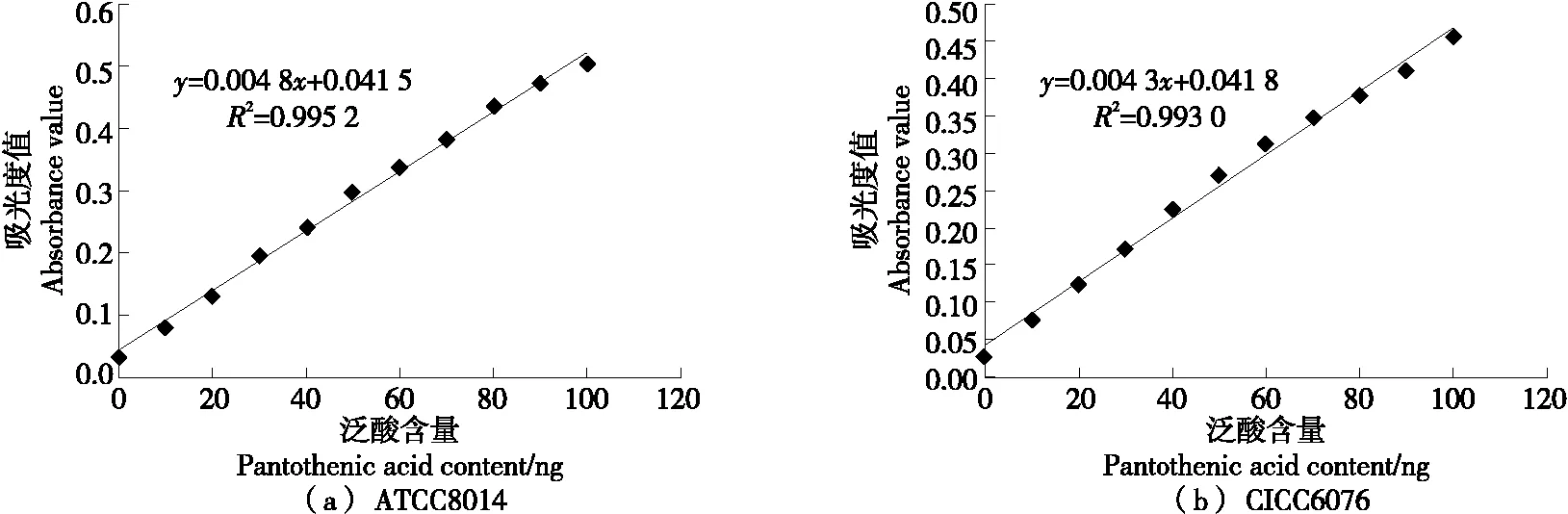
图1 不同植物乳杆菌测定的标准曲线图

表1 不同来源的植物乳杆菌测定泛酸结果表
采用ATCC 8014植物乳杆菌、CICC 6076植物乳杆菌按照GB 5009.210—2016第一法(微生物法)测定的3个奶粉样品和质控样品,相对标准偏差在0.82%~6.59%,在允许的相对偏差范围内。此外,以两种不同来源的植物乳杆菌菌株得到的标准曲线性方程y=0.004 8x+0.041 5(R2=0.995 2)和y=0.004 3x+0.041 8(R2=0.993 0),线性良好且二者线性范围一致,说明ATCC 8014植物乳杆菌和CICC 6076植物乳杆菌均可用来测定婴幼儿配方奶粉中的泛酸含量。有关研究[11-13]及现有标准(GB 5009.210—2016和GB 5413.17—2010)均使用ATCC 8014植物乳杆菌测定泛酸,该菌货期长,但价格昂贵。
2.1.2 不同浓度菌液直接添加至待测液中对测定结果的影响 用无菌生理盐水调制透光率分别为60%,70%,80%,90%的菌液,由不同的菌液浓度得到的泛酸标准曲线见图2,测定的质控样品结果见表2。
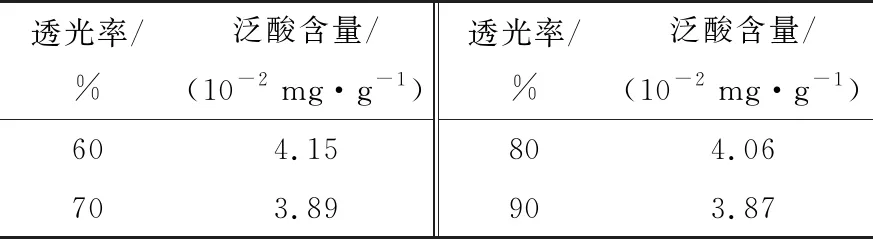
表2 不同浓度菌液测定的质控样品结果
由图2可知,透光率为70%,80%,90%时,曲线吸光度值基本上呈线性增加,透光率为80%时菌液浓度所得标准曲线的线性最好,泛酸标准曲线方程为y=0.007 3x-0.044 3,相关系数R2为0.991 2。分析原因为:接种 60%透光率的菌液浓度的标准曲线由于菌液浓度较高,当达到高浓度标准值(90~100 ng/mL)时,定量标准物质消耗后,植物乳杆菌繁殖增加速度减缓,吸光度值增加幅度变缓,故曲线明显趋向于持平;当接种90%透光率菌液时,因为接种量较少,在低含量的营养成分的条件下,繁殖增加缓慢,较低浓度的吸光度值特别低。利用植物乳杆菌对泛酸的特异性进行检测时,添加菌液浓度至关重要,菌液浓度不宜太高,太高则会出现高浓度标准值(90~100 ng/mL)的吸光值无明显变化,太低则会出现低浓度标准值的吸光度值过低,同时不同管之间的平行性较差。
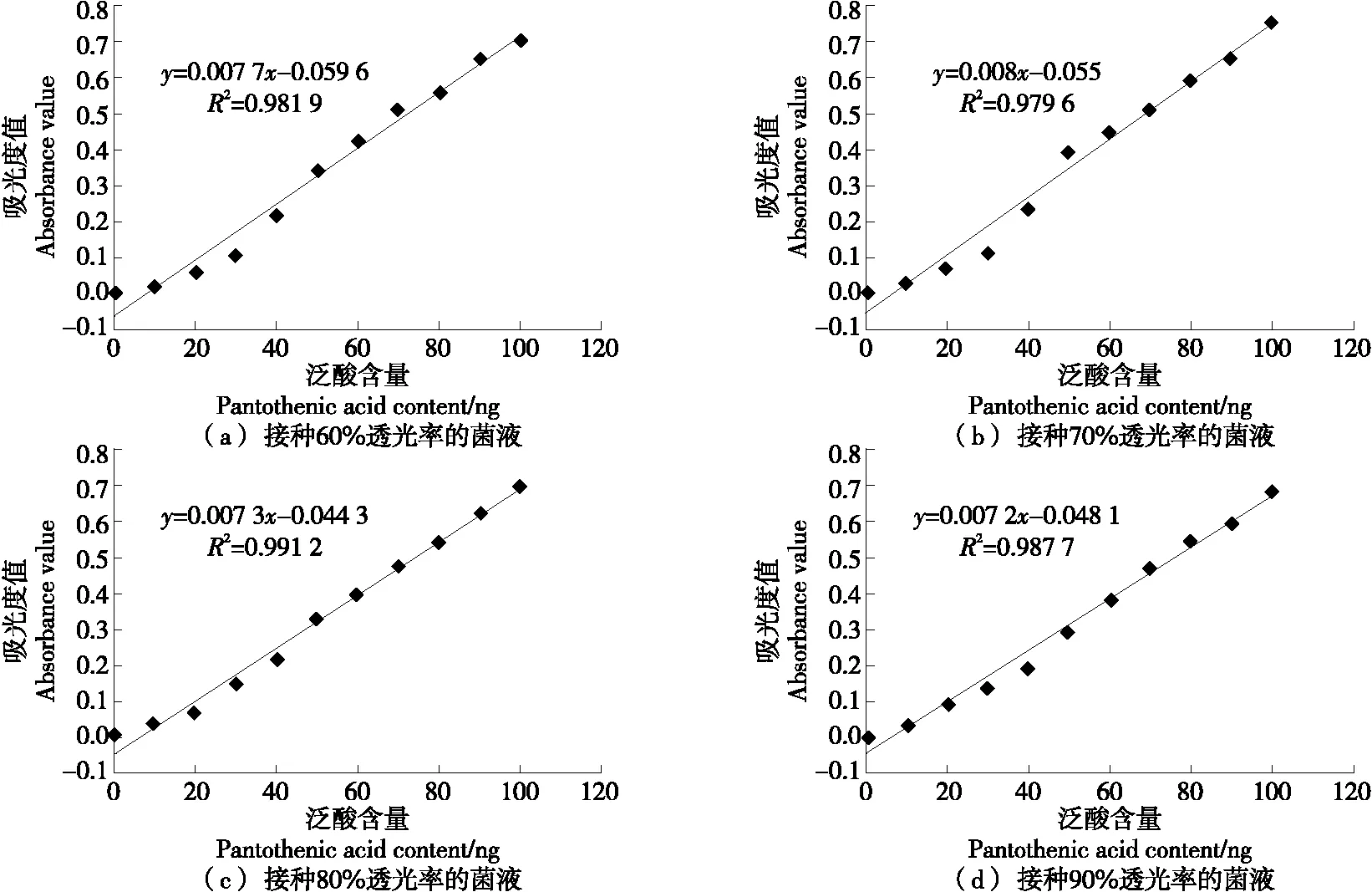
图2 不同浓度菌液直接添加至待测液中所得的标准曲线
从测定质控样品的结果来看,添加菌液透光率为60%~90%时结果均在质控样品允许接受的范围内,但从标准曲线的线性以及平行测试管的平行性来看,以添加透光率为80%的菌液50 μL至测试管中,得到的标准曲线及样品测定结果最佳。GB 5009.210—2016和GB 5413.17—2010标准方法及现有研究中对于菌液浓度的定量不明确或者范围很广,研究定量菌液浓度数据结果,有利于检测操作的标准化,确保检验试验的成功和检测结果准确。
2.1.3 不同的菌液量直接添加至测试培养基中对测定结果的影响 国标方法及现有研究中一般接种一定范围内的透光率的菌液,此方法需要经过多次调试和测定菌液浓度,对于初学的检测者难度较大。为减少菌液的制备及接种过程,研究直接添加到测试培养基的菌液添加量,便于检测过程的标准化操作。按2.5,5.0,10.0 mL的菌液量添加到400 mL泛酸测试培养基中,用来测定质控样品,得到接种2.5 mL菌液的标准曲线和测试样品在低浓度时,培养后吸光度值过低,而添加10.0 mL菌液的标准曲线在高标准液浓度70 ng/mL以上增加缓慢,在90,100 ng/mL 的标准溶液浓度吸光度值基本无变化。因而以添加5.0 mL菌液到400 mL泛酸测试培养基中得到的标准曲线及样品测定结果最佳(见图3),线性极好,R2达到了0.996 9,测定得到的质控样品结果为3.83×103μg/100 g(质控样品泛酸参考值为2 970~4 610 μg/100 g),基本接近中位值。
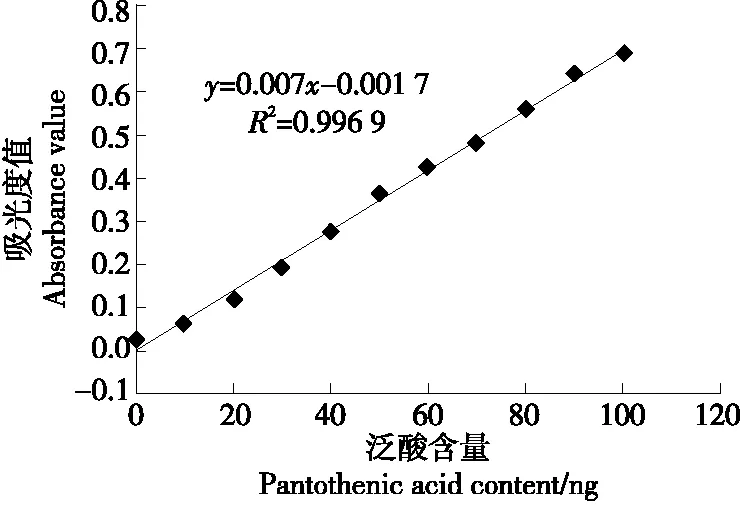
图3 接种5.0 mL菌液至400 mL泛酸测试培养基得到的标准曲线
2.2 样品前处理方法
由表3可知,利用水解法和直接提取法提取泛酸,两种方法所得结果不一致,直接提取法明显高于水解法,两者测定的结果相对偏差范围达到了12%~32%。其原因是:① 水解法中泛酸的提取通过121 ℃水解来实现,该过程可能会造成游离泛酸的分解而导致总泛酸测定结果偏低;② 直接提取法提取奶粉中全部的水溶性维生素包括生物素、烟酸也将全部被提取出来,生物素和烟酸对植物乳杆菌也有特异性,能促进植物乳杆菌的生长而导致测定结果偏高,另外,直接提取法提取不经过滤,样品液明显呈现浑浊状态,也可能导致结果偏高。

表3 两种前处理方法所得泛酸结果分析表
2.3 吸光度测定方法
GB 5413.17—2010第一法(微生物法)和GB 5009.210—2016第一法(微生物法)均要求采用紫外分光光度进行测定。此法最大的弊端是开展大批量样品检测时耗时长,并会导致后续样品测定结果偏高,而酶标仪测定吸光度的速度则较快。从表4结果来看,用紫外分光光度法和酶标仪测定的1个质控样品及5个奶粉样品相对偏差在1.0%~4.8%,在GB 5413.17—2010第一法(微生物法)和GB 5009.210—2016第一法(微生物法)允许的偏差误差范围内。由表5可知,采用酶标仪测定吸光度的加标回收率达到了96.9%,相对标准偏差为4.95%,回收率符合要求且测定方法的精密度高。为减少现行国标法检测泛酸时检测吸光度的繁琐程度,建议改用酶标仪进行测定,此法方便,测定耗时短,准确度高。
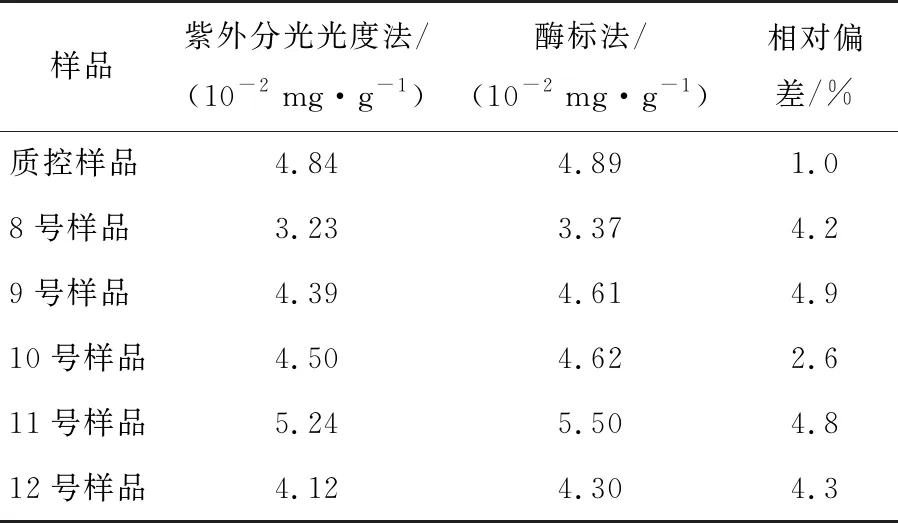
表4 不同吸光度测定方法的结果分析
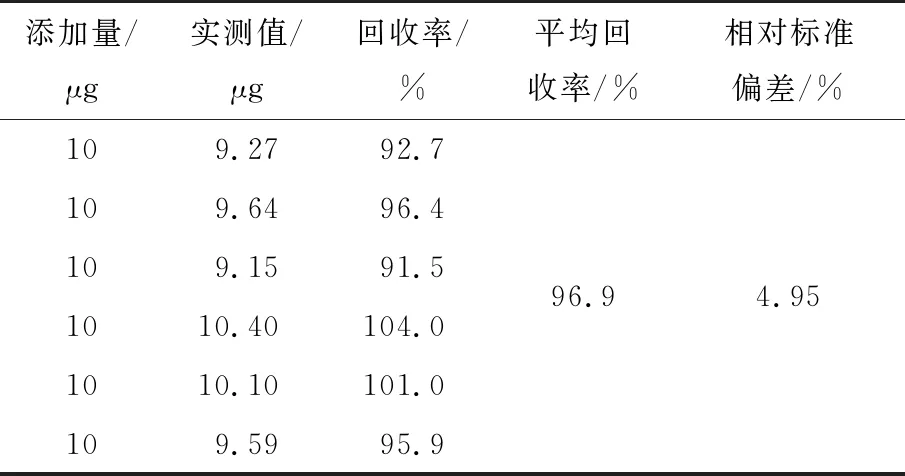
表5 酶标法测定9号加标样品的结果分析表†
3 结论
(1) 植物乳杆菌CICC 6076作为测试菌株用来测定婴幼儿食品中的泛酸含量具有和植物乳杆菌 ATCC 8014同等的效果,建议在允许(如内销食品检验)时替换使用。
(2) 为利于检测的标准化操作,对微生物法关键测定步骤的菌悬液准备研究出两种标准化的定量操作条件:① 直接接种透光率为80%的菌液50 μL于灭菌测试管中;② 采用5 mL菌液(单一菌落接种5 mL乳杆菌肉汤培养20 h后的培养液)添加至400 mL灭菌测试培养基中,后者操作更简单。
(3) 用紫外分光光度法和酶标仪测定的结果相对偏差小,且采用酶标仪测定吸光度加标回收的回收率可达到96.9%,用酶标仪测定泛酸的吸光度值,耗时短,准确性高,故建议GB 5009.210—2016的后续修订可在第一法中引入此方法测定吸光度值。
(4) 对于微生物法测定泛酸含量使用直接提取法导致结果偏高的原因还有待于深入研究,特别是如何避免和解决提取过程中因烟酸、生物素含量引起的结果偏高问题。

