不同ELISA 和AGID 试剂盒检测马传染性贫血病毒抗体的比较
薛 文,秦 菊,努尔买买提·阿穆提,马晓艳,苏晓慧,阿依吐拉·肉孜,李雷斌,陈玲玲,古丽曼·木哈买提拜,王 文
(1.新疆维吾尔自治区动物疾病预防控制中心,新疆乌鲁木齐 830011;2.塔里木大学动物科学学院,新疆阿拉尔 843300;3.中国动物疫病预防控制中心,北京 102618;4.广西大学动物科技学院,广西南宁 530005)
马传染性贫血(equine infectious anemia,EIA),简称马传贫,是由马传染性贫血病毒(EIAV)引起马属动物的一种以反复发热、贫血和持续病毒血症为特征的传染性疾病,我国将其列为二类动物疫病,世界动物卫生组织(WOAH)将其列为须通报动物疫病[1]。《马传染性贫血检疫技术规范》(SN/T 2717—2010)规定EIAV 的实验室检测方法为病毒分离鉴定、酶联免疫吸附试验(ELISA)和琼脂凝胶免疫扩散试验(AGID)。AGID 方法简便特异,是国际贸易中指定的诊断方法,但是琼脂浓度及温度会对琼脂板质量产生影响,同时技术人员的不当操作也可能导致假阴性或假阳性结果[2-3]。相比之下,ELISA 方法简单灵敏,适合样本的高通量检测,是EIAV 初筛的常用方法。
1963 年,新疆首次确诊EIA 疫情,通过采取综合性防制、检疫净化、免疫、全面检疫净化和达标考核验收等处置措施[4],疫情得到有效控制。近年来,新疆各地传统民族马术活动和以马术体育竞赛、骑马旅游、民族马术演出为主题的节庆活动开展日益频繁,做好EIA 的监测与防控工作至关重要。2018 年开始,新疆全区推广使用ELISA 方法初筛结合AGID 方法确诊的方式开展EIAV 监测,切实加快了EIA 的消灭进程。为了保障新疆现代马产业健康发展,本试验筛选了市面上4 种商品化ELISA 试剂盒和3 种AGID 试剂盒进行比对分析,旨在为选择更有效的EIAV 检测试剂提供数据支撑。
1 材料与方法
1.1 马血清样本
1 份EIAV 强阳性血清及28 份临床马血清,均为本实验室集中监测保留样本,-20 ℃保存。
1.2 检测试剂盒
ELISA 检测试剂盒:A(批号P200601-004)、B(批号20200812-0031)、C(批号GS456)、D(批号G58);AGID 检测试剂盒:A(批号P200301-001)、B(批号20200402)、C(批号HR798)。
1.3 主要仪器
全波长酶标仪,Multiscan GO/美国Thermo 公司;高速自动化洗板机,Hydrospeed/帝肯公司;电热恒温培养箱,DHP-9082PY/上海一恒科技有限公司;单道微量移液器,Brand 公司。
1.4 检测方法
1.4.1 灵敏性试验 用3 种商品化AGID 试剂盒和4 种ELISA 试剂盒分别检测EIAV 强阳性血清,将被检测血清从1:2 倍比稀释至1:2 048,每个稀释度做2 个重复。AGID 试剂盒检测步骤依据《马传染性贫血病琼脂凝胶免疫扩散试验方法》(NY/T 569—2002)和试剂盒说明书进行。阳性对照参考线延伸到样品孔,无弯曲或具有远离抗原孔并朝向阳性对照血清的略微弯曲,判定为阴性;阳性对照参考线与样品和抗原之间的线连成一条连续的沉淀线,判定为强阳性;对照沉淀线跑入样品孔,且出现弯曲、方向朝向中心抗原孔的沉淀线,但在样品孔和抗原孔之间未形成连续的线,判定为弱阳性。ELISA 试剂盒具体操作步骤和结果判定标准参照相应试剂盒说明书进行(表1)。
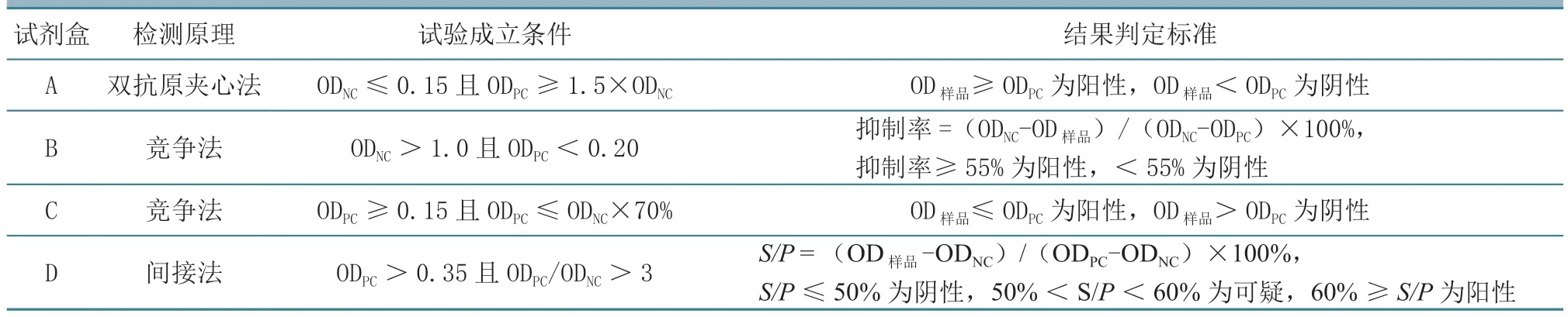
表1 4 种ELISA 试剂盒检测原理和结果判定标准
1.4.2 临床样品检测 以28 份临床马血清作为样品盘,分别用4 种商品化ELISA 试剂盒和AGID试剂盒B 进行抗体检测,以AGID 结果作为标准,通过计算符合率、Kappa 值、敏感性、特异性和约登指数,综合评价4 种ELISA 试剂盒的检测效果。具体操作步骤和结果判定标准同1.4.1。
1.5 数据分析
以AGID 试验数据为标准,计算4 种ELISA试剂盒的敏感性、特异性和符合率。敏感性=真阳性/(真阳性+假阴性)×100%;特异性=真阴性/(真阴性+假阳性)×100%;符合率=(真阳性+真阴性)/样本数量×100%。根据Kappa值评价试剂盒的一致性:Kappa 值<0,代表一致性极差;0~0.2,代表一致性微弱;>0.2~0.4,代表一致性弱;>0.4~0.6,代表一致性中度;>0.6~0.8,代表一致性高度;>0.8~1.0,代表一致性极强。约登指数=敏感性+特异性-1。
2 结果
2.1 灵敏性试验
A、B、C、D 4 种ELISA 检测试剂盒呈阳性反应的终点效价分别为1:1 024、1:256、1:32、1:128,A、B、C 3 种AGID 试剂盒呈阳性反应的终点效价均为1:16(表2)。

表2 ELISA 方法和AGID 方法的灵敏性试验结果
2.2 临床样品检测
使用AGID 试剂盒B 和4 种ELISA 试剂盒分别对28 份田间马血清进行检测。结果(表3)显示,ELISA 与AGID 检测结果存在一定差异,且4 种ELISA 试剂盒检测结果也不完全一致。28 份血清中,AGID 试剂盒B 检测出阳性血清12 份,4 种ELISA 试剂盒分别检测出阳性血清12、14、11、9 份。在AGID 试剂盒B 检测出的12 份阳性血清中,ELISA 试剂盒A、B 的检测结果也为阳性,试剂盒C 检出1 份阴性,试剂盒D 检出3 份阴性;在AGID试剂盒B检测出的16份阴性血清中,ELISA 试剂盒A、C、D 的检测结果也全部为阴性,仅试剂盒B 检出2 份阳性。
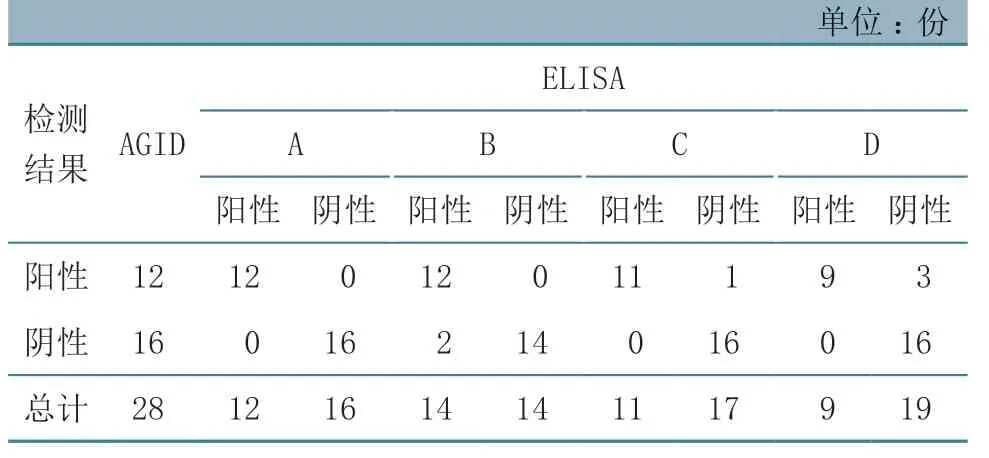
表3 AGID 试剂盒B 与4 种ELISA 试剂盒检测结果比较
2.3 4 种ELISA 试剂盒综合评价
28 份田间马血清的检测结果(表4)显示,ELISA 试剂盒A 与AGID 试剂盒B 检测结果完全一致,符合率为100%(28/28),其他3 种ELISA试剂盒与AGID 试剂盒B 的总体符合率分别为92.86%(26/28)、96.43%(27/28)、89.29%(25/28)。根据Kappa 一致性检验,4 种ELISA 试剂盒与AGID 试剂盒 的Kappa 值分别为1.000、0.857、0.926、0.774。
以AGID 结果作为标准,4 种ELISA 试剂盒的敏感性分别为100%(12/12)、100%(12/12)、91.67%(11/12)、75.00%(9/12),特异性分别为100%(16/16)、87.50%(14/16)、100%(16/16)、100%(16/16),约登指数分别为1.00、0.88、0.91、0.75。本试验中ELISA 试剂盒B 的敏感性(100%)高于试剂盒C(91.70%),而特异性(87.50%)低于试剂盒C(100%),试剂盒的敏感性和特异性有差异,因而需要通过约登指数进行比较。对4种ELISA 试剂盒的约登指数比较发现,试剂盒A效果最佳,其他依次是试剂盒C、B、D(表4)。
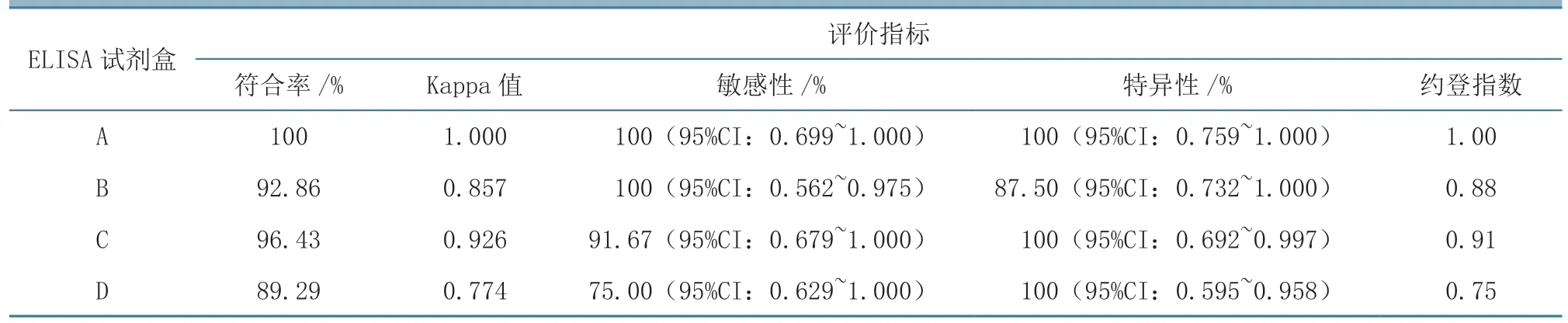
表4 4 种ELISA 试剂盒综合评价结果
3 讨论
本研究的灵敏性试验结果显示,4 种ELISA试剂盒阳性反应的终点效价分别为1:1 024、1:256、1:32、1:128,3 种AGID 法试剂盒均为1:16,说明ELISA 试剂盒的检测灵敏度普遍高于AGID 试剂盒。郭振梅等[5]的试验结果显示,使用间接ELISA 方法检测琼脂扩散试验阴性马血清的复阳率为4.4%(29/649)。张德禄[6]使用间接ELISA 方法复检340 份冷冻保存2 个月左右的琼扩试验阴性血清复阳率为45%(153/340)。以上结果提示,与AGID 方法相比,ELISA 方法提高了抗体滴度过低血清样品的阳性检出率。由于样本数量限制,本试验在样品盘设置上,缺少弱阳性及阴性样品,且未对试剂盒批内及批间稳定性进行评价,在实际应用中有必要增加弱阳性样品及阴性样品,并对试剂盒的稳定性进行评测。
本研究的一致性试验结果显示,4 种ELISA试剂盒与AGID 试剂盒检测结果的符合率均能达到89%以上。王大孝等[7]使用ELISA 和AGID 对马血清进行比较检测发现,1 298 份健康马血清符合率为100%(1298/1298),44 份感染马血清符合率为95.45%(42/44)。康哓杰[8]使用20 份标准阳性血清和268 份临床马血清进行双抗原夹心ELISA 和AGID 比较试验,符合率为98.96%,与本次试验结果接近。根据Kappa 一致性检验结果判定标准,Kappa 值越大,代表结果可靠程度越高。本试验中,ELISA 试剂盒A、B、C 与AGID 试剂盒一致性检测结果均为极强,试剂盒D 与AGID试剂盒一致性检测结果为高度。由此可见,ELISA是EIA 诊断的可靠手段之一。
在4 种ELISA 试剂盒中,试剂盒A、B 的敏感性均达到100%(12/12),优于试剂盒C(91.67%)和试剂盒D(75.00%);试剂盒A、C、D 的特异性均达到100%,优于试剂盒B(87.50%)。试剂盒A 采用双抗原夹心方法,使用纯化的EIAV p26重组抗原和过氧化物酶标记的重组蛋白p26 结合物作为双抗原,有效减少了非特异性抗体干扰,从反应机制上减少了假阳性,特异性较间接法(试剂盒D)和竞争法(B、C 试剂盒)都高。同时双抗原夹心法检测总抗体,可有效检测弱阳性样品[9]。
考虑到敏感性和特异性权重不同,本研究引入加权约登指数,加权约登指数Jω=2×[ω×灵敏性+(1-ω)×特异性]-1(ω为权重,0 ≤ω≤1);0 ≤Jω≤1,Jω越接近1,代表真实性越大[10]。在EIA 净化早期,预期流行率较高,应尽可能筛选出可疑样品,即更关注敏感性,那么可设定ω>0.5,随着ω增大,ELISA 试剂盒B的优势相对明显;当处于净化晚期,预期流行率很低,应避免误杀造成的经济损失,即更关注特异性,那么可设定ω<0.5,则ELISA 试剂盒C、D 的优势愈加明显。以上结果提示,在开展EIAV 抗体监测时,应该根据实际情况合理选择试剂盒,以保证检测结果的准确性。
目前,监测筛查EIAV 阳性血清通常使用垂直试验,即经ELISA 初筛的阳性血清必须通过AGID 试验确认[11]。这种联合试验方法可以使两种方法优势互补,有效提高试验的特异性和阳性预测值,提升检测可靠性,缩短疫区净化时间。当ELISA、AGID 的检测结果不一致时,需要反复检测或者使用免疫印迹法进行修正[3]。

