IL-8联合序贯器官衰竭评分对非泌尿外科术后尿源性脓毒症休克的预测价值
汪 升,陈玉梅,邵 勉,徐斐翔,童朝阳,薛明明
复旦大学附属中山医院急诊科,上海 200032
尿源性脓毒症是源于尿路感染的脓毒症,发生率占所有脓毒症的25%~30%[1],其临床诊断主要依靠序贯器官衰竭评分(sequential organ failure assessment, SOFA),并辅以尿路感染证据[2]。研究显示,约有40%的尿源性脓毒症患者会进展为休克[3],20%~40%尿源性脓毒症休克患者会在住院期间死亡[4]。因此,早期识别可能并发休克的尿源性脓毒症患者对降低尿源性脓毒症相关病死率和改善其预后具有重要意义。
由于约80%尿源性脓毒症为泌尿外科术后并发,既往研究[5]多聚焦于泌尿外科术后尿源性脓毒症。然而,基于庞大的患者基数,临床上非泌尿外科术后尿源性脓毒症患者不少见。目前,鲜见非泌尿外科术后尿源性脓毒症的相关研究。因此,本研究回顾性分析57例非泌尿外科术后尿源性脓毒症患者的相关资料,分析相关危险因素结合SOFA评分对该病并发休克的预测价值,以期为其临床风险分层管理提供参考。
1 资料与方法
1.1 研究对象选取2018 年3月至 2021 年 5月复旦大学附属中山医院收治的57例非泌尿外科术后尿源性脓毒症患者。脓毒症根据2016年国际脓毒症指南3.0标准[2]诊断,即患者发生感染或疑似感染且SOFA≥2分。纳入标准:(1)脓毒症由尿路感染引起;(2)年龄≥18岁。排除标准:(1)住院时间<24 h;(2)4周内有泌尿外科手术史;(3)其他部位同时感染;(4)恶性肿瘤患者;(5)尿毒症透析患者;(6)血液系统疾病患者;(7)自身免疫性疾病患者;(8)哺乳期妇女或孕产妇;(9)使用刺激炎症介质释放药物;(10)临床资料不完整或放弃治疗者。根据患者住院期间是否发生休克,将其分为休克组(n=26)和非休克组(n=31)。尿源性脓毒症休克定义为尿源性脓毒症患者在充分的液体复苏后持续低血压,需要血管加压素将平均动脉压维持在65 mmHg或更高,血清乳酸水平大于2 mmol/L[5]。本研究符合世界医学会《赫尔辛基宣言》,通过复旦大学附属中山医院医学伦理委员会审批(B2021-542),患者均知情并签署知情同意书。
1.2 观察指标收集研究对象的一般临床资料、入院时的实验室检测指标、SOFA评分和急性生理和慢性健康评分系统Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)评分。一般临床资料包括性别、年龄、体质指数(body mass index,BMI)、吸烟史、饮酒史、基础疾病情况、入院时的平均动脉压、住院治疗过程中是否发生多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)、是否使用机械通气以及是否使用血管活性药物。细胞因子包括白细胞介素-1β(interleukin-1β,IL-1β)、IL-2受体、IL6、IL-8、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)。
1.3 统计学处理采用SPSS 26.0进行统计分析。采用Shapiro-Wilk检验判断计量资料是否符合正态分布,正态分布计量资料以x±s表示,方差齐时采用两独立样本t检验进行组间比较,方差不齐时则采用两独立样本t’检验进行组间比较;非正态分布计量资料采用M(P25,P75)表示,组间比较采用两独立样本秩和检验。计数资料以n(%)描述,组间比较采用χ2检验或Fisher确切概率法。对非泌尿外科术后尿源性脓毒症休克的危险因素进行二分类logistic回归分析。采用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析各参数预测非泌尿外科术后尿源性脓毒症休克的效力。所有检验方法均为双侧检验,方差齐性检验水准(α)为0.1,其他检验水准(α)为0.05。
2 结 果
2.1 一般资料分析结果(表1)表明:57例非泌尿外科术后尿源性脓毒症患者中,男性28例、女性29例;年龄(67.26±13.84)岁。休克发病率为45.61%。休克组患者女性占比、入院SOFA评分、治疗期间MODS发生率均高于非休克组(P<0.05);治疗过程中,休克组17例(65.4%)患者使用血管活性药物,非休克组未使用血管活性药物(P<0.001)。
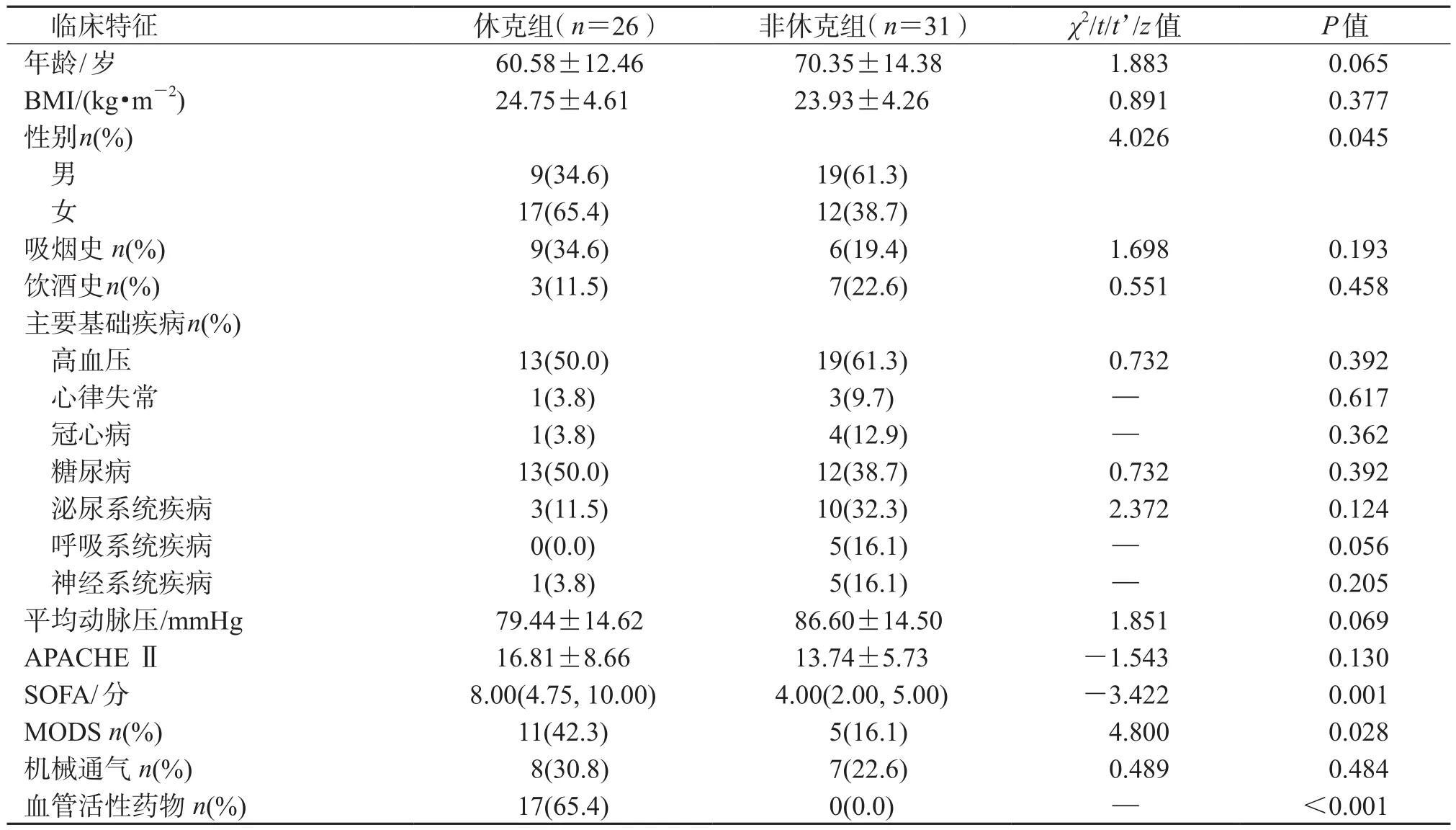
表1 2组非泌尿外科术后尿源性脓毒症患者一般临床资料比较
2.2 细胞因子水平比较结果(表2)表明:休克组IL-1β、IL-8和IL-10水平高于非休克组,差异均有统计学意义(P<0.05)。

表2 2组非泌尿外科术后尿源性脓毒症患者细胞因子水平比较
2.3 非泌尿外科术后尿源性脓毒症休克的危险因素分析将所有患者IL-1β、IL-8和IL-10以中位数为界,分为高水平组(n=28)和低水平组(n=29),分别有17例(60.7%)和9例(31.0%)患者发生休克(χ2=5.058,P=0.036)。以低水平组为参照进行二分类logistic回归多因素分析,通过逐步回归法分析并进行性别调整,显示高水平IL-8(≥48 pg/mL)为非泌尿外科术后尿源性脓毒症休克的独立危险因素(OR=3.579,95%CI 1.084~11.813)。
2.4 IL-8和(或)SOFA评分对非泌尿外科术后尿源性脓毒症休克的预测价值ROC曲线分析(图1,表3)显示:高水平IL-8联合SOFA评分对非泌尿外科术后尿源性脓毒症休克的预测价值较高(AUC=0.818,95%CI 0.707~0.928,P<0.001),灵敏度(84.6%)最高。
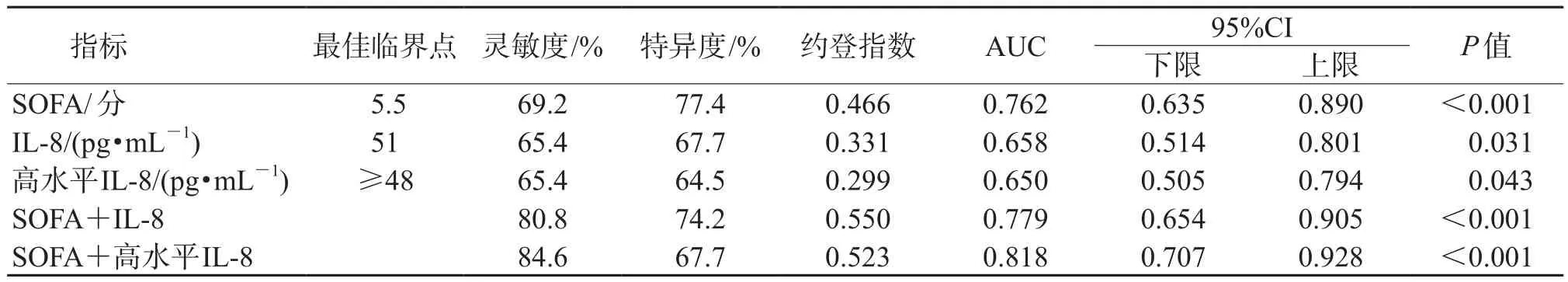
表3 IL-8和(或)SOFA评分对非泌尿外科术后尿源性脓毒症休克的预测价值
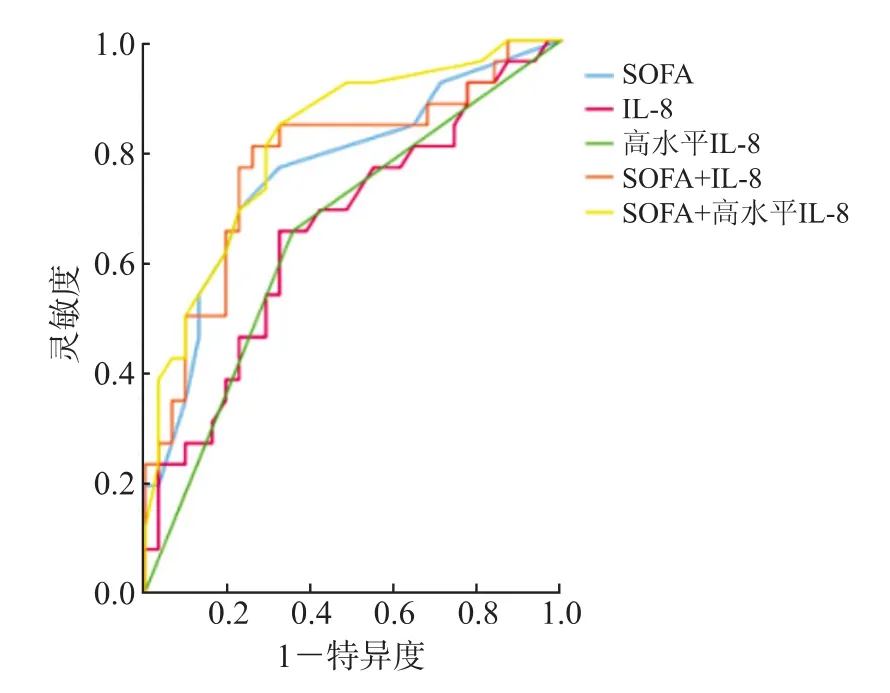
图1 IL-8和(或)SOFA评分预测非泌尿外科术后尿源性脓毒症休克的ROC曲线
3 讨 论
脓毒症是一种由感染引发的宿主免疫功能紊乱[6]。活化的促炎反应系统释放大量炎症介质,增加毛细血管通透性或引起血管扩张,导致有效循环血量相对不足,从而促进休克的发生发展[7]。严重的脓毒症或脓毒症休克患者可表现相对较高的细胞因子水平。炎症早期检测细胞因子对预测脓毒症的严重程度有很高的临床价值[8]。IL-6、IL-8和TNF-α等促炎细胞因子是严重感染过程中被激活的典型炎症介质,其引发的炎症反应与疾病的严重程度和临床预后相关[9]。抑炎细胞因子IL-10具有抑制固有免疫细胞释放炎症介质、抗原表达和吞噬作用的功能,其水平亦与脓毒症患者的死亡率相关且对脓毒症并发休克有预测价值[10]。
本研究显示,高水平IL-8(≥48 pg/mL)为非泌尿外科术后尿源性脓毒症休克的独立危险因素,可能与其参与尿路感染以及脓毒症发病相关。尿路感染常见致病菌大肠埃希菌可诱导中性粒细胞中IL-8相关信号通路上调;尿路感染时成熟中性粒细胞进入感染部位,自身释放IL-8的同时可诱导周围组织细胞释放IL-8[11]。因此,血清中IL-8水平可作为诊断小儿尿路感染的生物学标志物之一[12]。炎症发展过程中,IL-8的上调提示疾病恶化和更高的死亡倾向,且与脓毒症进展有关[13]。严重脓毒症伴发休克的患者在入院后24 h内血浆IL-8水平持续升高,而无并发症的脓毒症患者则无这种表现[14]。因此,在脓毒症早期对患者进行IL-8阻断治疗,可能有助于改善患者预后。
SOFA评分对泌尿外科术后尿源性脓毒症休克有较好的预测价值[15],但其与脓毒症休克出现的时间相关性较小。脓毒症休克患者在脓毒症早期就会出现细胞因子风暴,且休克患者细胞因子风暴强度最大值的出现时间早于SOFA评分[16]。因此,联合细胞因子也许能提高SOFA评分对脓毒症休克的预测效能。本研究显示,SOFA联合IL-8尤其是高水平IL-8预测非泌尿外科术后尿源性脓毒症休克的AUC及灵敏度均高于SOFA单独预测。
本研究为国内首次描述非泌尿外科术后尿源性脓毒症休克临床特征、危险因素及危险因素预测休克的价值,存在一定的局限性:(1)为单中心回顾性研究,可能出现选择和信息偏倚;(2)样本量估算主要依据针对logistic回归分析的样本量估算的常用准则,即样本量为协变量个数的10~15倍[17],57例符合该要求,但样本量仍较少,研究结果是否适用于所有非泌尿外科术后脓毒症休克患者还有待扩大样本量后进一步验证;(3)所选择的细胞因子相对有限,未纳入如IL-4、IL-9、IL-10、转化生长因子-β、可溶性TNF-α受体等细胞因子以及肾上腺素等有预测价值的危险因素。
综上所述,非泌尿外科术后尿源性脓毒症患者,休克组女性占比、入院时SOFA评分、MODS发生率、IL-1β、IL-8和IL-10水平均高于非休克组,高水平IL-8(≥48 pg/mL)为该病患者发生休克的独立危险因素,同时有助于提高SOFA预测休克的价值。但未来需要更大样本,并选择更多细胞因子,进行多中心前瞻性临床研究来验证本研究结论。
利益冲突:所有作者声明不存在利益冲突。

