胃癌新辅助治疗后不同肿瘤退缩分级系统的预后预测价值
刘 丹,田晨宇,赵骏杰,李豪杰,汪学非
复旦大学附属中山医院普外科,上海 200032
胃癌是常见的恶性肿瘤之一,全球发病率居所有恶性肿瘤的第5位,死亡率高居第3位[1],其中近一半的死亡病例发生在中国,原因之一是相当一部分患者就诊时,肿瘤已是进展期[2]。尽管根治性胃切除术联合D2站淋巴结清扫术对局部进展期胃癌的治疗效果已受到广泛认可,并已成为我国治疗局部进展期胃癌的标准方式[3],这类患者术后的总体预后情况仍然较差[4]。
新辅助治疗是当前改善局部进展期胃癌患者预后的尝试之一,旨在缩小肿瘤原发灶和转移淋巴结,减少肿瘤侵犯,降低手术难度,提高R0切除率,减少或消除微小残余病灶,减少术后复发转移,从而改善长期生存[5]。随着MAGIC[6]、FLOT4-AIO[7]、RESOLVE[8]、PRODIGY[9]等研究结果的公布,新辅助治疗的疗效得到越来越多的认可,其在临床中的应用也逐渐普及。由于新辅助治疗后的手术组织标本具有不同于常规手术组织标本的病理特征和临床意义,先后有多种肿瘤退缩分级(tumor regression grade, TRG)标准被用于评价胃癌新辅助治疗的疗效及预测预后。
TRG是对术前治疗后的肿瘤组织进行病理学评价的重要分级标准,主要依据肿瘤组织中肿瘤细胞残存比例(和纤维化程度)进行评估,目前常见的TRG标准有Mandard-TRG[10]、Becker-TRG[11]、以及JGCA-TRG[12]等,这些分级均被应用于临床工作及临床研究,尚未形成统一的胃癌新辅助治疗后TRG标准。因此,本研究旨在比较不同TRG与临床病理特征的关系,并比较其预后价值,从而为胃癌新辅助治疗的病理评价提供参考。
1 资料与方法
1.1 一般资料回顾性收集2014年1月至2019年12月在复旦大学附属中山医院接受新辅助治疗及胃癌根治术的局部进展期胃癌患者的临床病理资料及手术组织标本。纳入标准:(1)组织学诊断为胃腺癌;(2)基线影像学评估无明确的远处转移征象及其他不可切除因素;(3)于我院接受胃癌根治术;(4)无围手术期死亡;(5)术后接受辅助治疗;(6)临床病理资料及随访信息完整;(7)签署知情同意书。排除标准:(1)同时合并其他恶性肿瘤;(2)无法获得手术组织标本。本研究已获得复旦大学附属中山医院伦理委员会批准(B2021-314R)。
1.2 病理评价方法对于肿瘤原发灶的取材,若肉眼可见肿瘤病灶,或者胃中有瘢痕的区域能显示先前肿瘤(瘤床)的位置,则以0.5 cm为间隔,对该肿瘤或瘤床进行连续横切,全部取材。若肉眼无法鉴别原发肿瘤病灶,可通过基线胃镜及CT检查,对可疑区域以0.5 cm为间隔连续取材。关于淋巴结取材,标本离体后外科医生将淋巴结从标本中分离出来并分组,用甲醛固定。如果1个淋巴结的短径大于1 cm,则将该淋巴结分为两半分别包埋,1个蜡块中最多包埋4个淋巴结,并以0.2~0.3 cm为间隔连续横切淋巴结。切片采用苏木精-伊红染色,采用Van Gieson染色用于区分化疗导致的肿瘤结缔组织增生和瘢痕,PAS染色用于区分印戒细胞和上皮细胞。若未看到残余肿瘤细胞,则需每个蜡块追加3张切片以确认病理完全缓解,必要时加做免疫组织化学染色帮助判断是否有癌灶残留。
根据AJCC第8版胃癌分期中的新辅助治疗后分期(ypTNM分期)系统,确定手术组织标本的T分期和N分期。根据Mandard-TRG、Becker-TRG及JGCA-TRG标准分别评估TRG(表1)。上述分期及分级均由2位病理医生分别独立阅片判断并核对后获得。
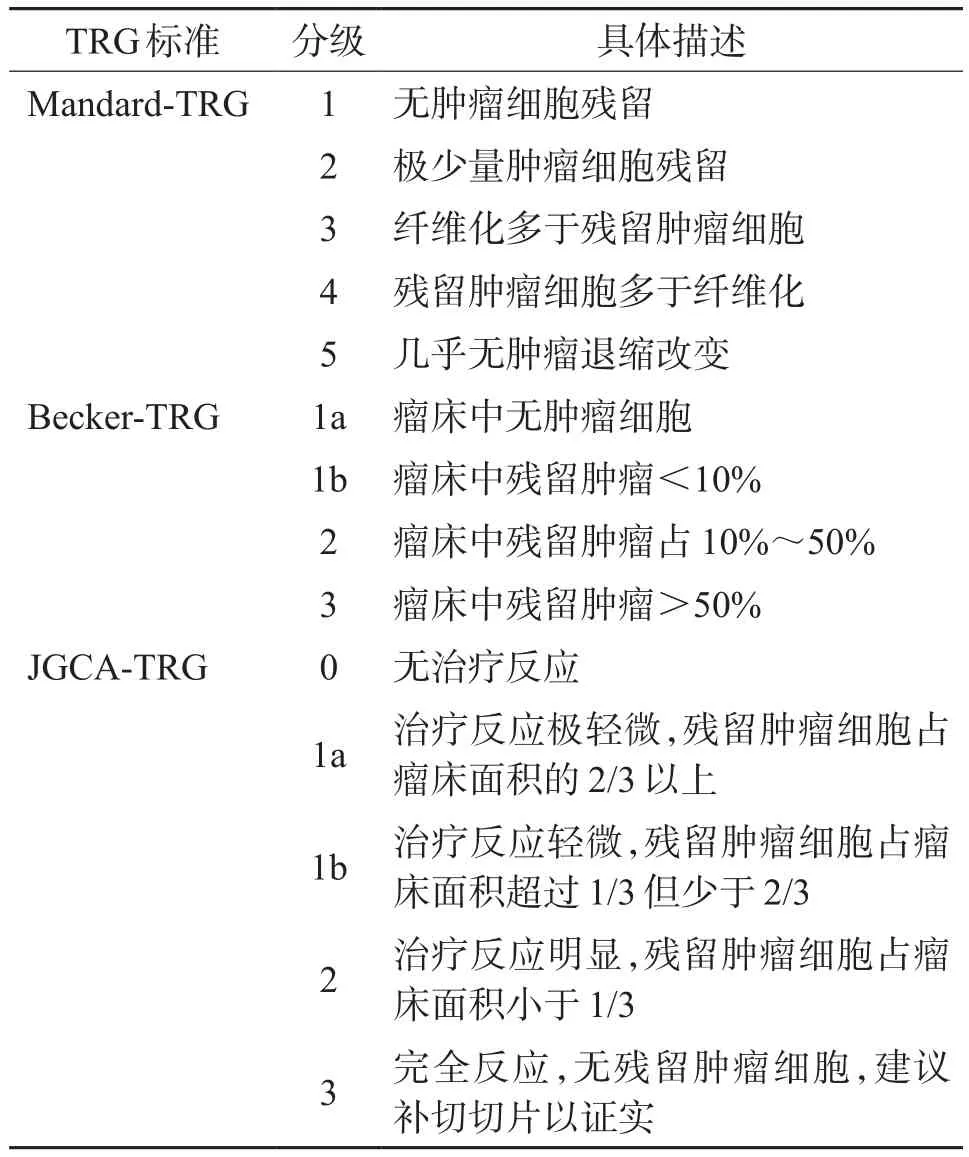
表1 TRG分级标准
1.3 随访信息主要观察指标为总生存时间(OS),定义为从患者接受根治性手术到患者死亡或末次随访的时间。随访信息通过门诊随访结合电话随访的方式获得,末次随访时间为2021年7月。
1.4 统计学处理采用 SPSS 26.0软件和R 4.0.3进行统计学分析。分类变量采用χ2检验或Fisher确切概率法进行比较。采用Kaplan-Meier法绘制生存曲线,采用log-rank检验比较亚组间生存差异。采用Cox单因素和多因素回归分析探索预后相关因素。用受试者工作特征曲线(ROC)评价不同TRG标准对患者5年生存状态的预测效能。检验水准(α)为0.05。
2 结 果
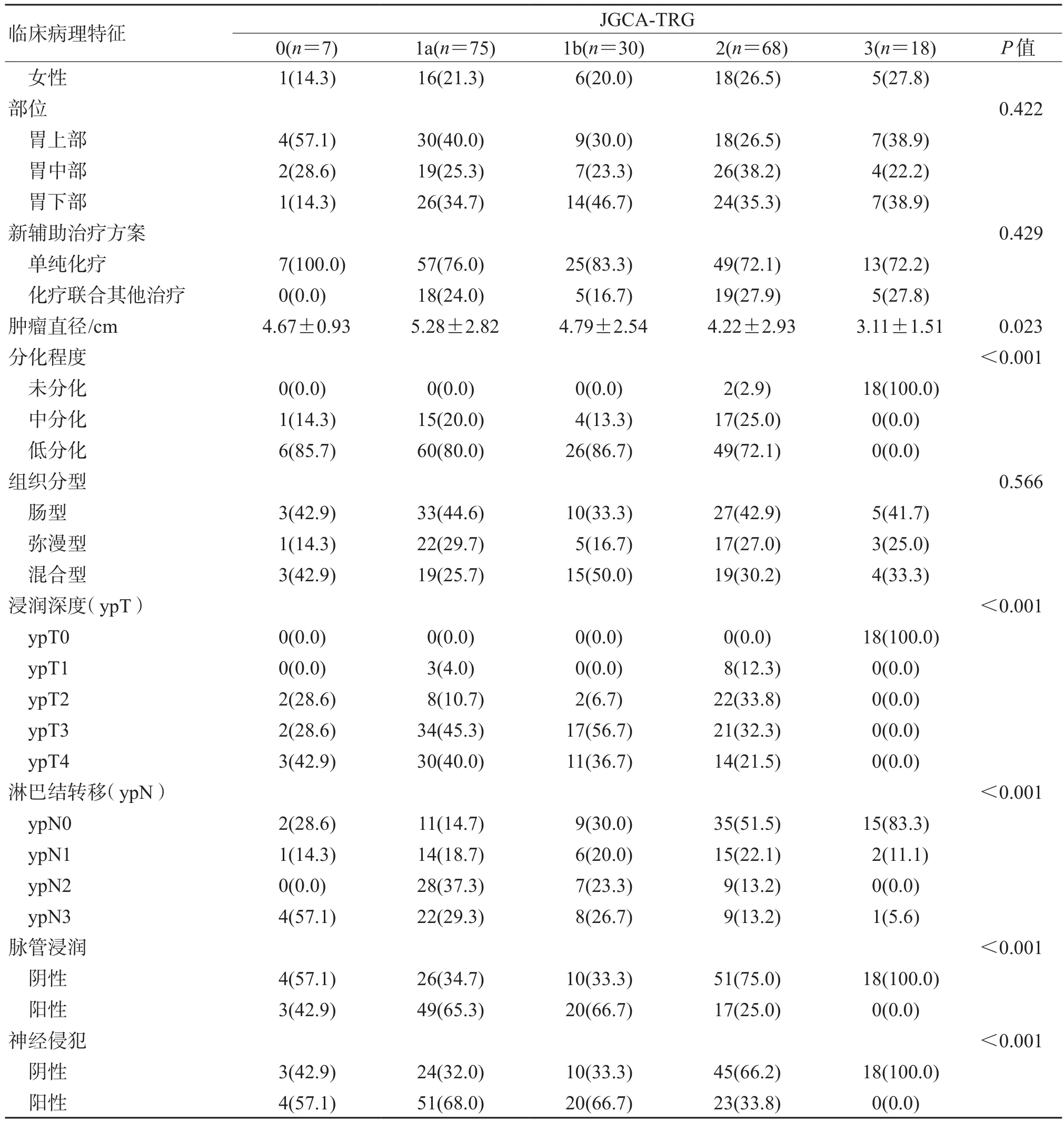
2.1 临床病理特征共纳入198例患者(图1),其中男性152例,女性46例,年龄18~79岁,中位年龄60岁。68例(34.3%)肿瘤位于胃上部,58例(29.3%)位于胃中部,72例(36.4%)位于胃下部。组织学分型为肠型78例(39.4%),弥漫型48例(24.2%),混合型60例(30.3%),另有12例因肿瘤完全退缩组织学分型不明确。151例(76.3%)患者接受新辅助单纯化疗,其中54例(35.8%)为XELOX方案,36例(23.8%)为SOX方案,44例(29.1%)为DOS方案,17例(11.3%)为包含FLOT、FOLFOX等在内的其他化疗方案。47例(23.7%)患者接受新辅助化疗联合包括放疗、介入治疗、靶向治疗、免疫治疗在内的综合治疗。接受新辅助单纯化疗的患者中,5例(3.3%)因治疗相关不良反应仅完成1个周期新辅助化疗,22例(14.6%)因影像学评估反应不佳仅完成2个周期新辅助化疗,其中17例残余肿瘤细胞>2/3,124例(82.1%)完成3个周期及以上新辅助化疗,66例(43.7%)在术后更换了辅助化疗方案,治疗周期及方案的调整由主诊医生根据患者的具体情况决定。ypT0~2、ypT3~4分别为66例(33.3%) 和132例(66.7%),ypN0 72例(36.4%),ypN+126例(63.6%)。新辅助治疗后存在脉管浸润者89例(44.9%)、神经侵犯者98例(49.5%)。各TRG分级的患者分布情况见表2。

图1 患者筛选流程
2.2 不同TRG标准分级与临床病理特征的关系结果(表2~表4)显示:不同TRG标准分级之间年龄、性别、肿瘤部位、新辅助治疗方案、Lauren分型等差异均无统计学意义。肿瘤退缩程度越高,新辅助治疗后肿瘤直径越小,且差异存在统计学意义(P=0.009、P=0.011、P=0.023)。根据3种TRG标准划分的不同分级间ypT、ypN、脉管浸润、神经侵犯的构成比例差异均有统计学意义(P<0.001)。
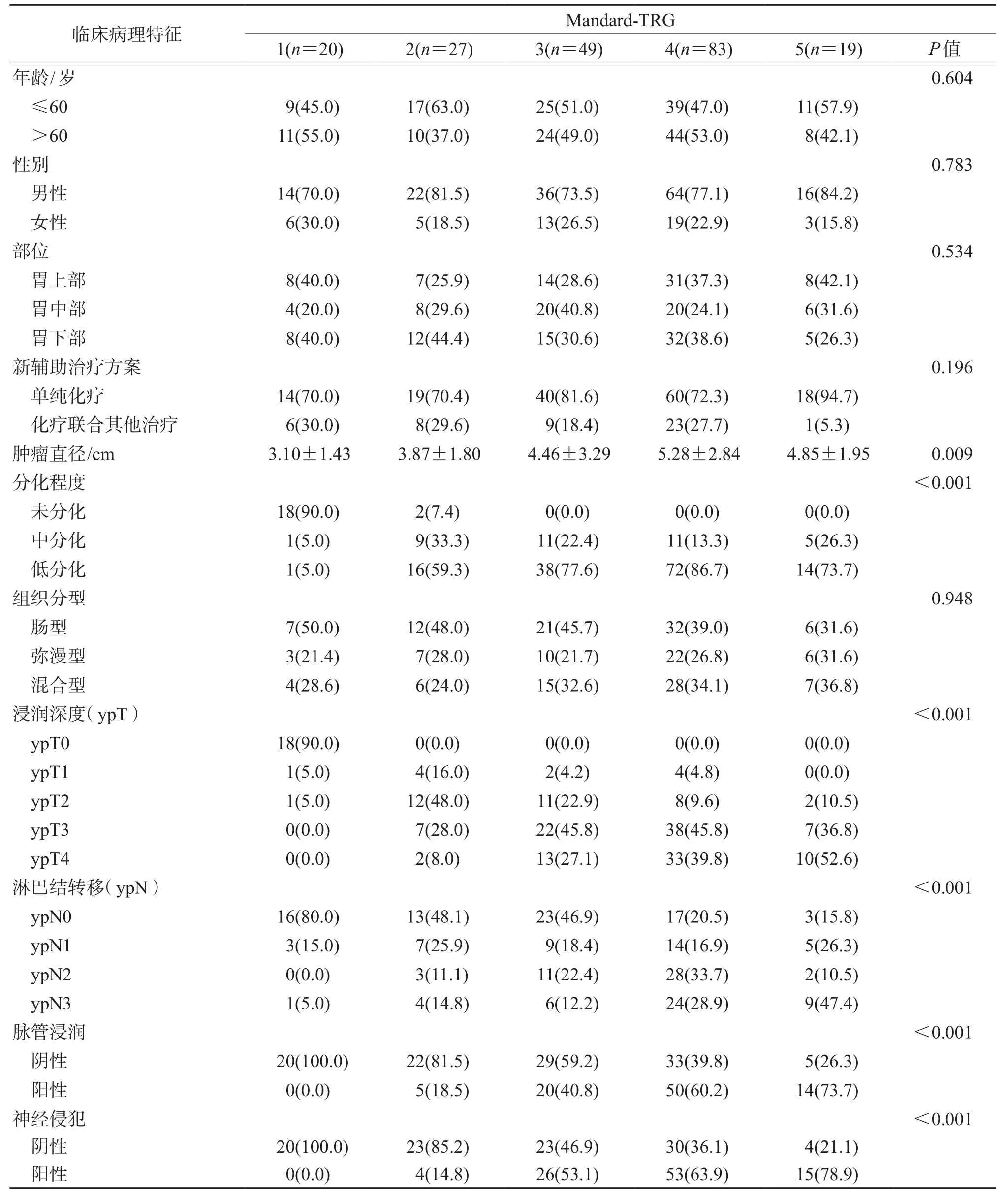
表2 采用Mandard-TRG标准不同分级间的临床病理特征分析n (%)
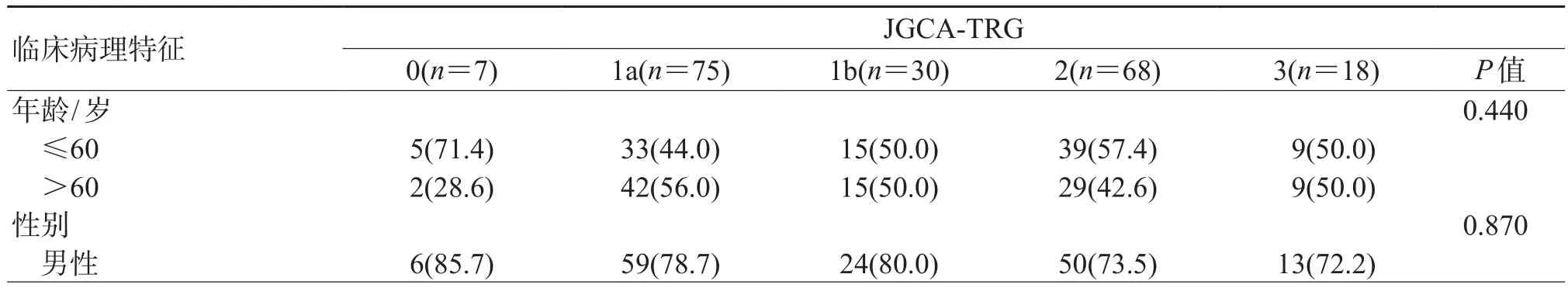
表4 采用JGCA-TRG标准不同分级间的临床病理特征分析n (%)
2.3 各病理特征与预后的关系结果(表5)显示:通过单因素Cox回归,发现JGCA分级、ypN、脉管浸润、神经侵犯与局部进展期胃癌新辅助治疗后的预后相关(P<0.05)。将上述4个因素纳入多因素Cox回归模型,发现仅ypN是预后的独立危险因素。

表5 单因素、多因素Cox回归
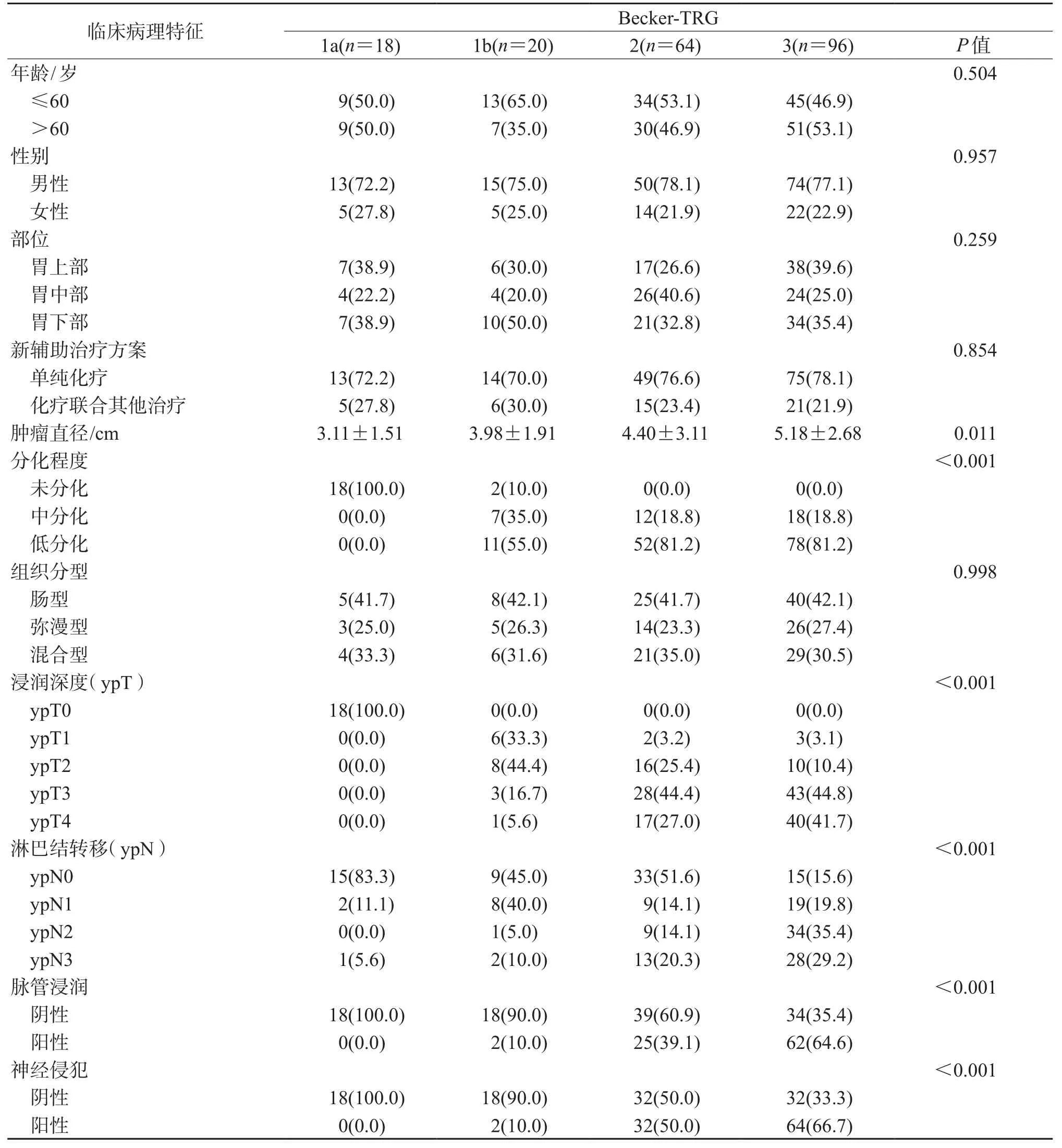
表3 采用Becker-TRG标准不同分级间的临床病理特征分析n (%)
续表4
2.4 不同TRG标准分级与OS的关系分别根据Mandard分级、Becker分级、JGCA分级将患者划分亚组并绘制生存曲线。Kaplan-Meier分析显示不同Becker分级或JGCA分级之间的OS差异有统计学意义(P=0.019,P=0.035),而不同Mandard分级之间的OS差异无统计学意义(P=0.146,图2 A~2C)。进一步比较Becker 1a级2级和Becker 3级患者的生存情况,Becker 1a级2级患者的预后显著优于Becker 3级患者(P=0.002),JGCA 2~3级患者的预后亦显著优于JGCA 0~1b级患者(P=0.006,图2 D~2E)。

图2 不同TRG标准分级的生存曲线
2.5 不同TRG标准对新辅助治疗后胃癌患者5年生存状态的预测效能Mandard分级、Becker分级和JGCA分级预测接受新辅助治疗的局部进展期胃癌患者5年生存状态的ROC曲线下面积(AUC)分别为0.608、0.624和0.611(图3)。
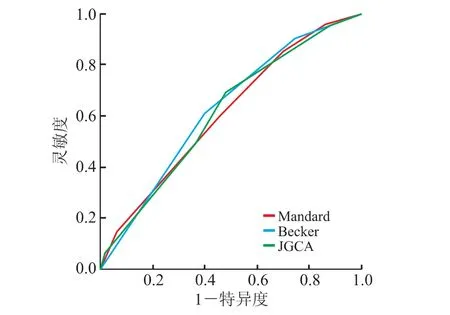
图3 不同TRG标准预测胃癌患者5年生存率的ROC曲线
3 讨 论
随着多项新辅助治疗用于局部进展期胃癌的临床研究[6-9]结果的公布,新辅助治疗在胃癌中的应用日益普遍,然而新辅助治疗后的病理评价却仍未形成统一的标准。目前,常见的新辅助治疗后病理评价标准包括第8版美国癌症联合会(AJCC)胃癌TNM分期系统中新增的ypTNM分级以及TRG标准。ypTNM分级综合原发肿瘤浸润深度、淋巴结转移情况以及远处转移情况进行评价,但该分级标准对疗效评价和预后预测的有效性欠佳[13]。此外,新辅助治疗后胃癌的退缩模式常呈离心性,即位于肿瘤中心及浅表侧的肿瘤细胞最先发生坏死及纤维化,因而良好的肿瘤退缩并不一定会导致T分期降级[14],TRG可能是对ypTNM标准的有效补充。
TRG的概念首先由Mandard等[10]提出,旨在根据残余肿瘤的比例和肿瘤的纤维化判断肿瘤对新辅助治疗的病理反应,以指导后续治疗及预测患者的预后情况。自1994年Mandard等提出Mandard-TRG标准后,研究人员一直试图探索不同的TRG并评估其可用性、可重复性及对预后的预测价值[15-20]。目前常用的TRG依据量化方式的不同分为2类:一类通过比较残余肿瘤细胞数量和纤维化程度确定分级,如Mandard-TRG和Becker-TRG;另一类则只基于残余肿瘤细胞占肿瘤瘤床的比例进行评级,如JGCA-TRG。然而,在多项回顾性研究[15-20]中,不同TRG间患者的预后差异均无统计学意义,没有明显的预后分层,均非预后的独立危险因素。
本研究根据Mandard-TRG、Becker-TRG、JGCA-TRG,将患者分成不同的亚组,发现不同Becker分级或JGCA分级之间的OS差异有统计学意义(P=0.019,P=0.035),而不同Mandard分级之间的OS差异无统计学意义(P=0.146)。通过单因素Cox回归分析发现,JGCA分级、ypN、脉管浸润、神经侵犯与局部进展期胃癌新辅助治疗后的预后相关(P<0.05),其中仅ypN是预后的独立危险因素。既往多项研究[15–20]结果也表明,相较于TRG分级,新辅助治疗后淋巴结转移情况与患者预后的相关性更显著。结合不同肿瘤退缩程度的患者淋巴结状态差异存在统计学意义这一结果,本研究认为TRG分级对预后的预测能力可能与不同的病理淋巴结分期有关。
此外,本研究还通过ROC曲线下面积评估3种TRG标准对新辅助治疗及胃癌根治术后5年生存的预测能力,发现Becker-TRG标准的AUC值高于JGCA-TRG及Mandard-TRG。与Becker-TRG标准和JGCA-TRG标准相比,Mandard-TRG标准中未对残余肿瘤细胞比例按照具体数值进行划分,这导致不同的观测者对退缩等级的划分产生个人偏倚,特别是2级(极少量肿瘤细胞残留)和3级(纤维化多于残留肿瘤细胞)之间,4级(残留肿瘤细胞多于纤维化)和5级(几乎无肿瘤退缩改变)之间的界限难以明确。
在目前的新辅助治疗临床研究及临床工作中,对治疗有效的的病理学判断标准仍以病例完全缓解(pCR)和主要病理缓解(MPR)为主,而不是连续等级变量的TRG分级。在本回顾性研究中,虽然不同Becker分级或JGCA分级之间的OS差异有统计学意义,但Becker 1a~2级和Becker 3级之间、JGCA 0~1级和JGCA 2~3级之间的生存差异更加显著,这可能提示层数较少的更简单的TRG系统在预后预测中表现更好。
此外,随着综合治疗理念深入人心以及靶向治疗、免疫治疗的发展,已有多项Ⅱ期、Ⅲ期临床研究探索全身系统化疗联合放疗[21-22]、靶向治疗[23-26]、免疫治疗[27-28]等综合治疗方案在胃癌新辅助治疗中的有效性,在这些接受术前综合治疗的病例中,现行的TRG分级对预后预测的准确性也会受到影响。例如,在全身化疗联合局部放疗的病例中,放疗对原发肿瘤强大的杀伤作用可能会导致肿瘤原发灶局部退缩明显,但无法消除其他部位可能存在的微转移病灶,导致基于原发肿瘤退缩情况预测预后的准确性降低。而免疫治疗作用反应的持久性提示单纯基于手术标本评价肿瘤退缩程度的疗效评价标准可能不能准确反映预后情况[29]。免疫治疗、靶向治疗以后肿瘤病灶的特殊的病理反应特征提示可能存在新的新辅助治疗后病理评价方法,例如肿瘤微环境中免疫浸润情况的改变等[30-31]。
综上所述,本研究分析了3个常用的TRG系统与新辅助治疗后胃癌患者临床病理特征的关系,通过Kaplan-Meier分析、Cox回归分析和ROC曲线评价3种分级对预后的预测价值,发现Becker-TRG标准对于接受新辅助治疗的胃癌患者的预后预测价值略优于JGCA-TRG和Mandard-TRG,但仍需探索更加全面精准的胃癌新辅助治疗后病理评价标准。
利益冲突:所有作者声明不存在利益冲突。

