负载血管基质片段的GelMA水凝胶用于促进皮下血管化乳头状软骨再生的实验研究
张 宇, 丁靖豪, 陈 茹
完美的乳房需要合适的乳头作点睛之笔[1]。近年来,随着国内乳房整形手术数量的逐渐增多,乳头坏死的情况时有发生。其他原因如先天性无乳头、外伤、乳腺病变切除术后等,也都会导致乳头缺失,这不仅影响女性的形体美,而且会对患者造成极大的心理压力[2]。长期以来,乳头再造一直是乳腺外科医师面临的难题之一。最常用的重建方法有自体肋软骨雕刻乳头支撑体、组织游离移植、局部皮瓣、局部皮瓣复合皮瓣内支撑物[3]。然而,利用自体肋软骨行乳头再造存在很多缺点,包括有限的软骨供区,以及供区术中术后存在血气胸、胸壁结构不完整等风险。另外,这种方法固有的一个缺点是,雕刻一个与患者正常乳头在解剖学上精准匹配的乳头软骨支撑体具有很大的难度,这需要外科医师具备良好的雕刻能力和充分的立体感。而组织游离移植及皮瓣法也面临供区损伤、乳头凸度难以长期维持等问题[4]。因此,当前临床迫切需要寻求一种更加有效的策略以精准再造乳头软骨支撑体。3D生物打印作为一项新兴技术,可以利用水凝胶作为“墨水”,通过计算机构建的图案进行个性化精准打印[5-6]。其性能优势在于:(1)良好的生物相容性、无毒性;(2)可打印性和较好的结构稳定性;(3)可生物降解和吸收性;(4)可模拟与细胞外基质相似的天然微环境等。因此,通过3D打印水凝胶有望再造精准的乳头状结构,然而其血管化仍是维持乳头状软骨再生的难点和重点[7-8]。血管基质片段(stromal vascular fraction,SVF)来源于成熟脂肪组织,是一组异质性的细胞群体,含有脂肪来源干细胞(adipose-derived stem cells,ADSCs)、内皮祖细胞、造血干细胞等[9]。体内外实验均表明SVF能分泌大量促血管生长因子,同时能分化成内皮细胞参与血管出芽[10]。因此,本文拟联合SVF和经典的甲基丙烯酸酐化明胶(methacrylate gelatin,GelMA)水凝胶,制备具有促血管化功能的GelMA/SVF复合水凝胶用于软骨再生,为后续精准乳头状软骨再生奠定基础。
1 材料与方法
1.1实验材料与动物 Gel(CAS 9000-70-8)、甲基丙烯酸酐(methacrylic anhydride,MA;CAS 760-93-0)、苯基-2,4,6-三甲基苯甲酰基亚磷酸锂盐(lithium phenyl-2,4,6-trimethylbenzoyl phosphinate,LAP),购自上海阿拉丁生化科技股份有限公司。透析袋(截留相对分子质量为1 000或3 500)购自上海源叶生物科技有限公司。倒置荧光显微镜(T12-U)购自日本Nikon公司。胎牛血清(FBS)、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、0.25%胰酶、高糖基础培养液(DMEM)等购自Gibico公司。绿色Celltracker购自Life Technologies公司。HE染色试剂盒、Safranin-O染色试剂盒、Ⅱ型胶原染色试剂盒、阿利新蓝(pH 2.5)显色试剂盒和酶联免疫分析试剂盒均购自Yeasen公司(上海,中国)。6周龄雌性新西兰大白兔1只(上海甲干生物科技有限公司)和6周龄雌性裸鼠6只(上海斯莱克生物科技有限公司)。本实验遵守实验动物伦理原则。
1.2脂肪来源SVF的获取和三项分化 无菌条件下获取兔双侧腹股沟脂肪组织,PBS清洗3次,彻底去除红细胞与组织碎片。加入预热的0.1% Ⅰ型胶原酶溶液,置37 ℃水浴震荡消化1 h。300×g离心5 min,去除上层脂肪细胞与胶原酶溶液。加入适量含10% FBS的DMEM重悬细胞,经400 μm细胞筛过滤,获得血管基质成分细胞进行计数。将血管基质成分置于37 ℃、体积分数5% CO2培养箱中,以含体积分数10% FBS的DMEM培养48 h后换液,去除未贴壁细胞及残留的红细胞。当细胞集落达到80%汇合后用胰蛋白酶消化细胞,这些细胞被称为脂肪间充质干细胞的P1。使用脂肪来源SVF经培养后的原代细胞进行诱导分化,分别添加成脂(10-6mol/L地塞米松、10 mg/L胰岛素和0.5 mmol/L 3-异丁基-1-甲基黄嘌呤)、成骨(0.1 μmol/L地塞米松、10 mmol/L β-甘油磷酸钠和50 μmol/L抗坏血酸磷酸盐)和成软骨(6.25 mg/L胰岛素、10 μg/L转化生长因子β和50 μg/L抗坏血酸)诱导培养基,观察其形态变化,并对诱导分化后的细胞分别进行油红O染色、茜素红染色与阿利新蓝染色。
1.3GelMA/SVF复合水凝胶的制备 通过Gel与MA的加成反应合成GelMA。简言之,将10 g Gel以10%质量分数溶于PBS中,缓慢加入5 ml MA,于60 ℃水浴锅中反应2 h,期间保持温度不变。待反应结束后,过滤溶液并放入透析袋(截留相对分子质量为3 500)中透析3 d。透析完成后冷冻干燥即可得到白色泡沫状的GelMA固体,将产物置于-20 ℃恒温冰箱中保存。使用生物相容性较好的LAP作为光引发剂。将GelMA、LAP及SVF以5%、0.3%及1.5%的质量分数溶解于去离子水中得到GelMA/SVF预凝胶溶液,将此溶液暴露于365 nm紫外光下15 s即可得到GelMA/SVF复合水凝胶。
1.4GelMA和GelMA/SVF复合水凝胶3D打印
分别将GelMA和GelMA/SVF复合预凝胶溶液移入注射器内,并固定于打印机(Bio-Architect® Pro,杭州捷诺飞生物科技股份有限公司)推进泵上,连接软管和打印喷头并固定。调整打印喷头速度及推进速度,以打印出网格结构组织。
1.5软骨细胞的培养 获取兔膝关节软骨,洗净,并剪碎,加入5倍体积的0.25%胶原酶,摇床消化过夜。100 μm孔径滤网过滤,1 500 r/min离心5 min,PBS漂洗2遍,以含10% FBS的高糖DMEM配成细胞悬液,按2×106cells/皿(直径10 cm培养皿)接种细胞,置入5% CO2、37 ℃培养箱培养。细胞达90%融合时进行传代。本实验所用细胞均为第2代软骨细胞。
1.6裸鼠皮下软骨再生构建 将收集的第2代软骨细胞分别与GelMA和GelMA/SVF预凝胶溶液均匀混合,配制成100×106cells/ml的细胞-水凝胶悬液,并暴露于365 nm紫外光下15 s进行固化。随后将6只裸鼠随机分为两组(每组3只),麻醉后在无菌条件下于背部划开1个0.5 cm长的切口形成腔隙,将上述构建的两组细胞-水凝胶复合物埋入腔隙,并用5-0可吸收缝线进行缝合。完成手术的裸鼠饲养在清洁环境下,保证其自由活动及充足的饮食。4周后处死裸鼠,收集标本进行体内软骨再生及血管化相关情况评价。
1.7组织学评价 将体内的标本置于4%的多聚甲醛中固定24 h,行梯度酒精脱水、石蜡包埋,并切成5 μm厚度的组织切片,通过HE和Safranin-O染色,以评价再生软骨组织和软骨特异性基质的生成情况。通过CD31免疫荧光染色,以评价再生软骨组织的血管化情况。
1.8生化成分分析 将体内获取的标本置于木瓜蛋白酶溶液中消化12 h后,采用阿利新蓝法定量检测样本中的GAG含量,采用酶联免疫吸附法测定样本中的胶原蛋白Ⅱ(collagen Ⅱ)含量。
2 结果
2.1脂肪来源SVF成分的细胞培养和鉴定 脂肪来源SVF成分细胞体外接种于培养皿中,并经过12 h培养后,细胞大多数呈现分裂期的梭形状态;再经过24~48 h的培养后,细胞数量明显增多,提示细胞具有良好的增殖活性(见图1ⓐ~ⓒ)。脂肪来源SVF成分经成脂诱导21 d后,油红O染色显示大量红染的脂质沉淀;经成骨诱导21 d后,茜素红染色结果显示有大量红染的钙结节形成;经成软骨诱导21 d后,阿利新蓝染色可见呈阳性,表明有软骨特异性细胞外基质成分产生(见图1ⓓ~ⓕ)。上述结果充分证明脂肪来源SVF成分的成功提取,并且其具有三项定向诱导分化潜能,为软骨再生提供了依据。
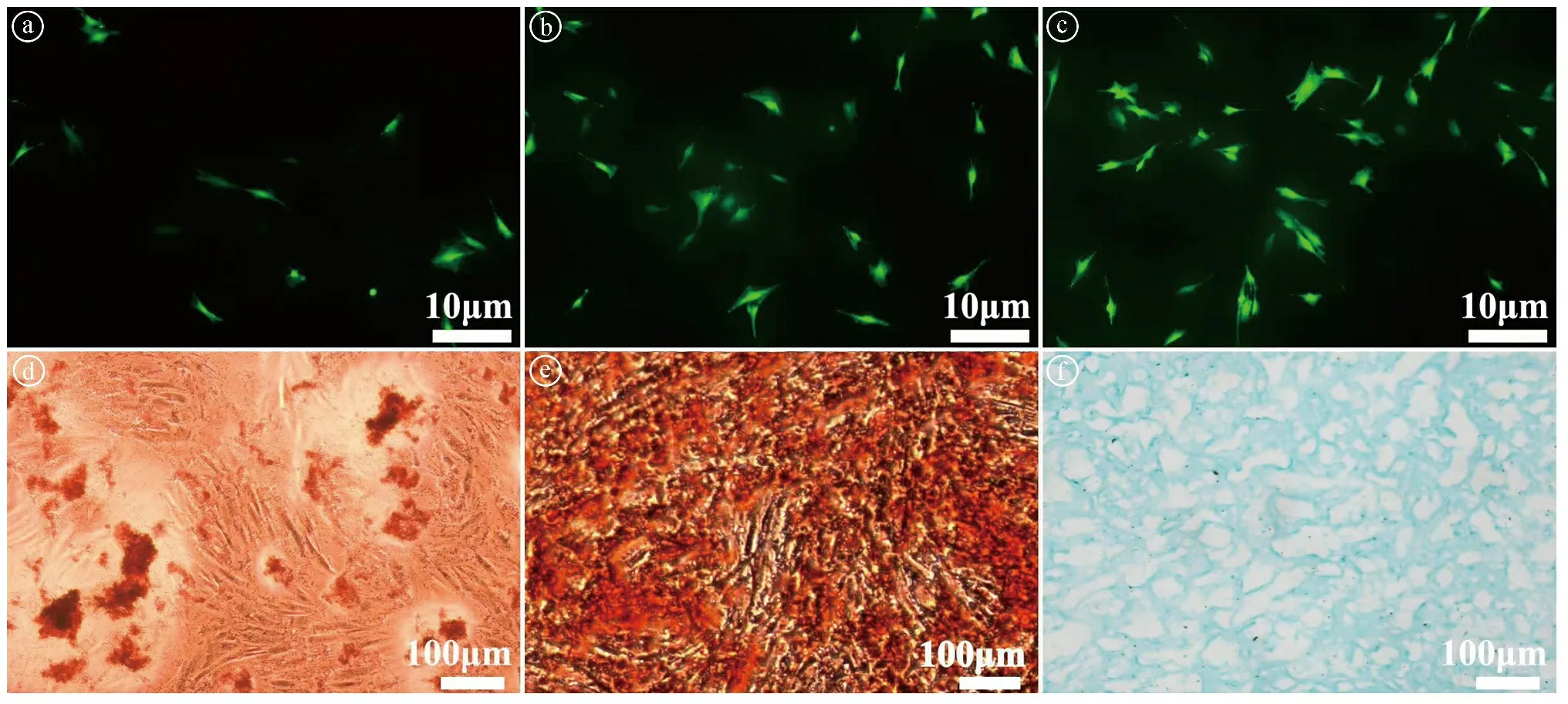
ⓐSVF成分细胞接种12 h后荧光图;ⓑSVF成分细胞接种24 h后荧光图;ⓒSVF成分细胞接种48 h后荧光图;ⓓSVF成分经成脂诱导21 d的油红O染色;ⓔSVF成分经成骨诱导21 d的茜素红染色;ⓕSVF成分经成软骨诱导21 d的阿利新蓝染色
2.2GelMA/SVF复合水凝胶的制备及其3D打印的初探结果 将脂肪来源SVF成分均匀混入GelMA水凝胶成功制备GelMA/SVF复合水凝胶,该水凝胶具有与纯GelMA一样的光交联特性。随后对GelMA和GelMA/SVF复合水凝胶分别进行3D打印,发现这两种水凝胶均可以成功打印出相对均质的网格结构(见图2),说明SVF的引入并不改变GelMA的可打印性,且为后续精准打印乳头状结构奠定基础。
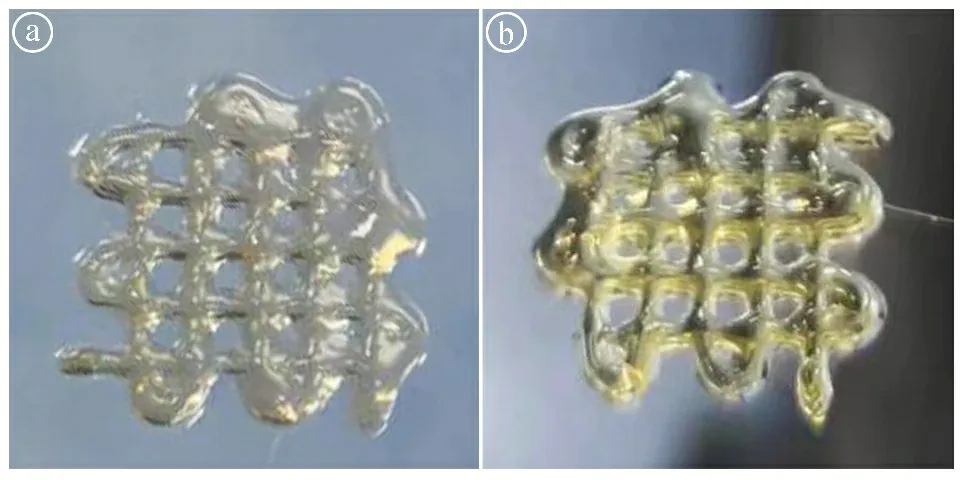
ⓐGelMA水凝胶3D打印的大体图;ⓑGelMA/SVF复合水凝胶3D打印的大体图
2.3GelMA/SVF复合水凝胶裸鼠皮下再生软骨结果 本研究分别将单纯GelMA和GelMA/SVF复合水凝胶包裹软骨细胞后,植入裸鼠皮下培养。4周后取材进行组织学检测,发现单纯GelMA组再生的软骨组织只有少量软骨特异性基质的沉积以及少许阳性Safranin-O染色(见图3ⓐⓑ),而GelMA/SVF复合水凝胶组存在大量软骨特异性基质的沉积以及大面积阳性Safranin-O染色(见图3ⓒⓓ)。软骨特异性生化成分定量分析结果显示,相比于单纯GelMA组,GelMA/SVF复合水凝胶具有更高的GAG和Collagen Ⅱ表达量(见图4)。以上结果表明,相比于单纯GelMA组再生的软骨组织,GelMA/SVF复合水凝胶组明显能再生出更加均质且丰厚的软骨基质,明显促进软骨再生,为后续精准再生乳头状软骨奠定基础。
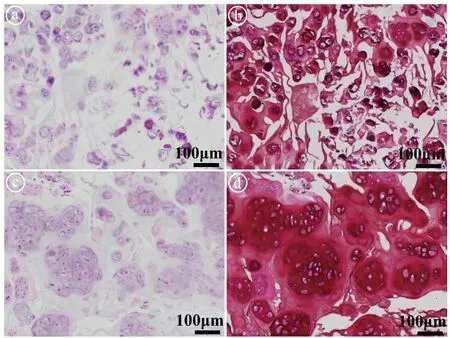
ⓐGelMA组的HE染色;ⓑGelMA组的Safranin-O染色;ⓒGelMA/SVF组的HE染色;(d)GelMA/SVF组的Safranin-O染色
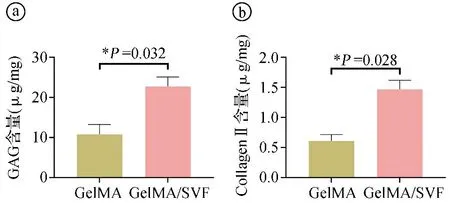
ⓐGAG含量定量分析;ⓑCollagen Ⅱ含量定量分析,*P<0.05
2.4再生软骨血管化分析结果 为了探究脂肪来源SVF促进水凝胶再生软骨的作用,本研究进一步对再生软骨进行血管化分析。CD31免疫荧光染色结果显示,GelMA组只有少量阳性的内皮细胞表达,而GelMA/SVF组出现大量阳性的内皮细胞表达(见图5)。上述结果充分说明,脂肪来源SVF的引入可以显著促进血管化,通过加强营养渗透从而促进软骨组织再生。
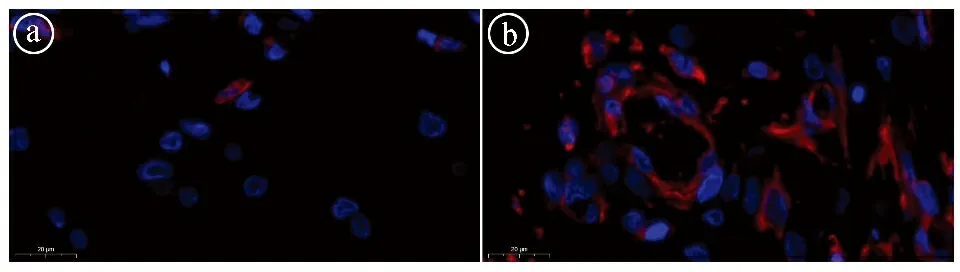
ⓐGelMA组的CD31免疫荧光染色;ⓑGelMA/SVF组CD31免疫荧光染色
3 讨论
3.1近年来,软骨组织工程技术的出现,为乳头再生提供了一条新的途径。广泛应用于生物医学领域中的3D打印技术,成为组织工程和再生医学的一种先进辅助技术手段[11]。其基本原理是以生物材料作为“打印墨水”,首先利用计算机断层扫描或计算机辅助设计进行三维模型构建,再以STL格式文件输入到计算机系统中,并分层成二维切片数据,通过计算机控制的3D打印系统进行逐层打印,叠加后最终获得三维产品。利用3D打印技术所打印出来的组织工程支架不仅具备精细的内部三维多孔结构,有利于细胞的黏附与增殖,更重要的是,支架外形可以与缺损组织的解剖结构精准匹配[11]。因此,联合软骨组织工程和3D打印技术有望创造出精准解剖外形的乳头状软骨组织。组织工程技术避免了自体肋软骨乳头再造手术所承担的软骨供区并发症,以及较长的雕刻支架的手术时间和支架移植前需反复多次试验的手术过程[12]。
3.2水凝胶具有超高的含水率和较好的吸水溶胀性能,吸水溶胀后,水凝胶内部会形成相互贯通的多孔网络,为细胞黏附、增殖和分化提供了结构支撑和微环境,是组织工程与再生医学领域重要的细胞支架来源[13]。目前基于水凝胶进行3D打印再生特定形状组织是当前研究的热点[14]。本研究采用经典的GelMA水凝胶进行3D打印,完全有望构筑精确形态的乳头状软骨。然而,软骨血管化是软骨组织工程的主要障碍[15]。水凝胶再生软骨同样存在一个重要问题是营养渗透不足,导致再生软骨质量差,远期效果出现软骨塌陷,最终不能长期维持精确乳头状软骨形态[16]。良好的血管化有望显著改善水凝胶再生软骨质量。因此,软骨再生与血管化仍是软骨组织工程技术研究的难点和重点。
3.3组织血管化主要包括血管新生和血管形成。血管新生是在原来存在的血管结构上长出新血管的生物学过程[17]。血管形成是指内皮祖细胞迁移至某部位,分化发育为新血管。组织血管化在组织工程的体外和体内实验都是制约组织工程技术使用的难点。提高组织在体外血管化的能力是目前组织工程技术的主要研究方向之一。由于灌注和氧气运输直接影响细胞的活性和分化,所以目前研究的组织仅限于几毫米厚度。此厚度受支架的体积、细胞成分的代谢特点以及营养物质的运输等条件制约,且氧气运输只能通过渗透或者建立功能性血管网络完成。目前通过提供生长因子、引导支架、灌注生物反应器、微流控芯片、细胞共同培养时、细胞的功能化、模块化组装等方法改善组织的血管化情况[18]。但是,即使这些方法在一定程度上增加了细胞的活性,或建立了类似血管网络的结构,但仍然没有与机体自身的组织代谢活动建立固定的联系,对于氧气及养料的扩散渗透的定量测量要在将来的研究中进一步观察。
3.4有研究报道,SVF体外贴壁培养获得的ADSCs,在不同诱导环境下能够分化成骨细胞、软骨细胞、脂肪细胞等;目前关于细胞移植的治疗性血管化作用的机理集中于植入细胞的直接分化和持续分泌多种生长因子[19]。但是,细胞移植入体内后成活率极低,其分化的细胞不足以促进血管化的发生。因此,其持续的旁分泌能力被认为是发挥促血管化作用的主要机理。目前,脂肪来源SVF多应用于自体脂肪移植后促进脂肪组织血管化的研究,而国内外学者将脂肪来源SVF应用于软骨组织再生以及血管化的研究甚少[20]。本研究通过将SVF载入GelMA水凝胶,结果表明SVF的引入可以显著促进GelMA水凝胶再生软骨的血管化情况,从而提供充分的营养促进皮下软骨再生。
综上所述,本研究将SVF载入GelMA水凝胶,制备出具有合格3D打印性能的GelMA/SVF复合水凝胶。更加重要的是,SVF的引入可以明显促进再生软骨的血管化,从而提供充分的营养促进皮下软骨再生,为后续精准乳头状软骨再生提供坚实基础。

