猪伪狂犬病病毒野毒株的分离鉴定及gC、gD基因序列分析
吕玉金 , 赵攀登 , 张世军 , 刘玲玲 , 李文刚 , 王湘如 , 陈焕春 , 吴凤笋
(1. 河南牧业经济学院动物医药学院 , 河南 郑州 450046 ; 2. 河南农业大学动物医学院 , 河南 郑州 450046 ; 3. 华中农业大学动物医学院 , 湖北 武汉 430070)
伪狂犬病病毒(Pseudorabies virus,PRV)属于疱疹病毒科,α疱疹病毒亚科的成员,主要引起多种家畜及野生动物的急性、热性传染病[1]。自19世纪发现PRV以来,由于其宿主范围广、致病性强、变异速度快以及目前还没有有效的治疗措施等,给多个国家的养殖业带来了巨大挑战[2-3],尤其从2011年底PRV变异毒株的出现[4],使伪狂犬病的防控变得愈加困难。
本试验对2019年采集的河南省某规模化猪场疑似伪狂犬病毒野毒感染的组织病料进行病毒的分离、鉴定和纯化,测定分离毒株的半数组织培养感染剂量(TCID50)、一步生长曲线和动物回归试验,并对分离毒株的gC和gD基因进行测序和序列分析。
1 材料与方法
1.1 组织病料 2019年1月从河南省某猪场无菌采集疑似感染PRV的病死猪的脑、肾脏、脾脏、肺脏、肝脏等组织,于-80 ℃保存。
1.2 实验动物 7周龄雌性BALB/c小鼠,购自河南省实验动物中心。
1.3 主要试剂 SanPrep柱式DNA胶回收试剂盒、HiPure Viral RNA/DNA Kit抽提试剂盒、SanPrep柱式质粒DNA小量抽提试剂盒等,均购自生工生物工程(上海)股份有限公司;rTaq酶、dNTPs、DNA Marker DL5 000、核酸电泳染料等,均购自宝生物工程(大连)有限公司。
1.4 引物的设计与合成 采用本实验室保存的PRV的鉴定引物(P2017)对病料组织提取的DNA进行扩增鉴定;此外,根据GenBank已公布的PRV全基因序列(登录号:JF797219.1),使用Primer Premier 5.0软件设计2对特异性引物,分别用于gC和gD基因的扩增,引物由生工生物工程(上海)股份有限公司合成,引物具体信息见表1。

表1 引物序列
1.5 样品处理 将采集的病料组织混合剪碎,按照约5∶1加入DMEM培养基充分研磨后反复冻融3次,离心后取上清液,经0.22 μm的滤膜过滤,过滤液于-80 ℃ 保存备用。
1.6 病毒DNA提取及病原PCR检测 将处理过的组织滤液用HiPure Viral RNA/DNA Kit提取试剂盒提取病毒DNA,以提取的DNA为模板进行PRV鉴定。
1.7 病毒的分离与纯化 将处理过的组织滤液接种至生长良好的PK-15细胞,经反复盲传,待细胞病变(Cytopathic effect,CPE)达到80%时收毒。用0.05% 中性红溶液对病毒进行3轮空斑纯化后,在PK-15细胞上传代至稳定出现CPE时收毒,用PCR方法进行病毒鉴定。
1.8 病毒TCID50和一步生长曲线测定 用96孔细胞培养板进行病毒TCID50和一步生长曲线的测定。将病毒在PK-15细胞上连续传代至稳定出现明显CPE,收取病毒液,用含2%胎牛血清的DMEM细胞培养液进行10倍倍比稀释后,分别接种于96孔细胞培养板中,每个稀释度设置8个复孔。同时设立阴性孔作为对照,置于37 ℃ 5% CO2培养箱中进行观察记录。采用Reed-Muench法计算TCID50。
将病毒液用DMEM维持液稀释至感染复数(MOI)为1,接种于PK-15细胞上,37 ℃孵育1 h后用PBS清洗3次,加入含2% FBS的DMEM细胞维持液,放入5% CO2培养箱中继续培养。分别于培养2、4、8、12、24、36、48、60、72、84 h和96 h时收样,收样后加入500 μL含2% FBS的DMEM细胞维持液继续培养。对各个时间点收取的样品进行TCID50的测定,以病毒效价为纵坐标,感染时间为横坐标,利用GraphPad Prism 8.0软件绘制一步生长曲线。
1.9 分离毒株对小鼠的致病性 将36只BALB/c雌性小鼠(7周龄)随机分成6个组,每组6只。取已知TCID50的PRV用DMEM细胞维持液连续做10倍梯度稀释,共5个稀释度,每个稀释度病毒液注射1组小鼠(6只),最后1组注射DMEM细胞维持液作为阴性对照。注射方式均采用腹部皮下注射,每只小鼠注射100 μL。随时观察小鼠临床症状及死亡数量和时间,并记录观察情况,直至小鼠不再出现明显的临床症状和死亡。根据小鼠的死亡情况,按照 Reed-Muench法计算分离毒株对BALB/c小鼠的半数致死量(Median lethal dose,LD50)。对死亡小鼠进行病理剖检,取部分脏器组织进行研磨提取基因组DNA,按照本实验室所建立的PRVgE和gB基因TaqMan双重实时荧光定量PCR对感染小鼠脏器中病毒的拷贝数进行测定[5]。
1.10 分离毒株gC和gD基因扩增 以1.6中提取的病毒DNA作为模板,进行gC、gD基因扩增,扩增条件见表2、表3。扩增的目的基因经1% 琼脂糖凝胶回收后与pMD-18T载体连接,而后转化DH5α感受态细胞,提取质粒,送生工生物工程(上海)股份有限公司测序。

表2 PRV gC基因扩增体系和程序
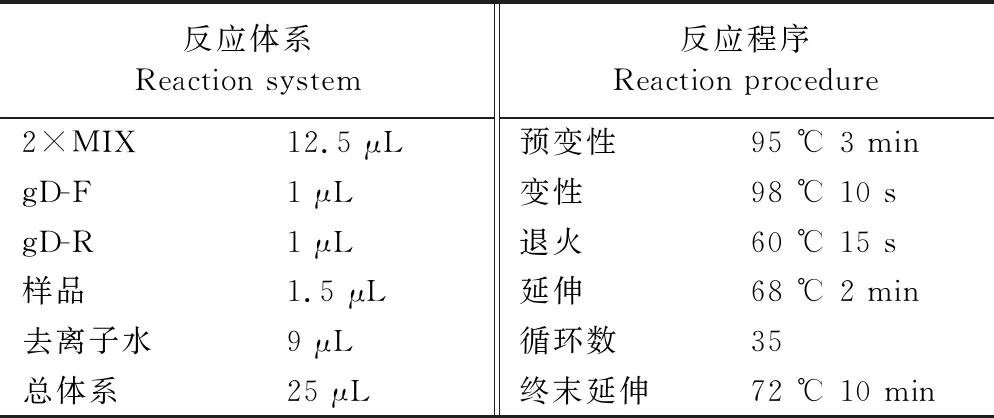
表3 PRV gD基因扩增体系和程序
1.11 分离毒株gC和gD基因序列分析 将所得序列测定结果进行对比分析,并与GenBank中已收录的国内外其他PRV流行株的gC、gD基因进行比较,用 MEGA 7.1.0 软件构建基因进化树。
2 结果
2.1 病原PCR检测 以从组织病料中提取的病毒基因组DNA为模板,用PRV鉴定引物进行扩增,得到1条约166 bp的阳性条带,与阳性对照Bartha-K61株的条带大小一致(图1)。
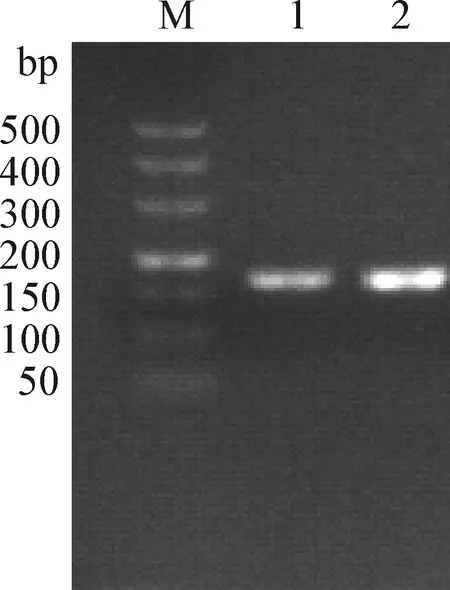
图1 组织病料PCR鉴定
2.2 病毒的分离纯化 将收取的病毒液用0.05%中性红溶液对病毒进行空斑纯化,如图2。空斑纯化后扩大培养的病毒液用PCR方法进行病毒鉴定,结果扩增出1条约166 bp的特异性条带,如图3,与预期结果一致。结果显示,成功分离到1株PRV毒株,将其命名为HNCY。
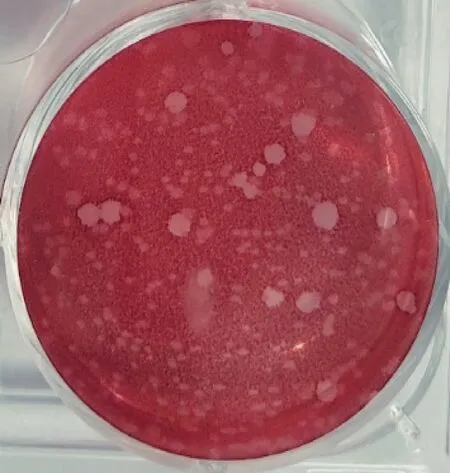
图2 病料组织PRV分离株空斑试验

图3 空斑纯化病原的PCR鉴定
2.3 分离株毒株TCID50和一步生长曲线测定 取空斑纯化的F9、F10、F11代病毒液分别做病毒滴度测定,取每个病毒液稀释度出现细胞病变孔的3次试验平均值。按照Reed-Muench法计算出分离毒株HNCY的TCID50为10-8.48/0.1 mL。
取F9代病毒液在PK-15细胞上测定一步生长曲线,以收样时间为横坐标,病毒的TCID50的对数为纵坐标,进行一步生长曲线的绘制,如图4,分离株呈现常规增殖规律,12~24 h为对数生长期,48 h达到最高,之后病毒滴度逐渐降低。
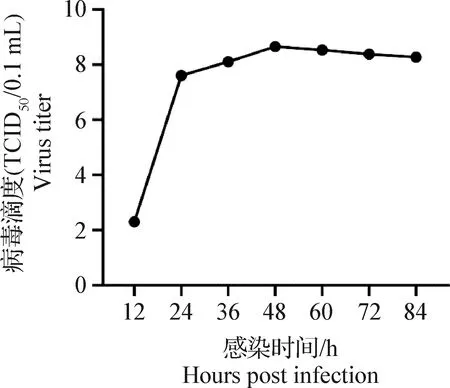
图4 PRV分离株的一步生长曲线
2.4 分离毒株对小鼠的致病性
2.4.1 分离毒株对小鼠致病性试验 将分离株病毒液进行倍比稀释后,经腹部皮下接种小鼠,观察其临床状态以及死亡情况。结果显示,试验组小鼠在接毒36 h后出现精神沉郁、呼吸加快、奇痒、啃咬和抓挠注射部位等症状。最早出现死亡的是102稀释度组在攻毒后60 h,随后的48 h内小鼠死亡率达到高峰,攻毒后144 h小鼠不再出现死亡,临床症状消失。小鼠详细的死亡情况见表4。按照Reed-Muench法计算病毒的LD50为104.14TCID50。

表4 PRV分离株LD50的测定
2.4.2 分离毒株感染小鼠组织脏器中PRV载量的检测 结果见图5,肺组织中含毒量最高,其次是脑、肾脏、脾脏和心脏等组织。
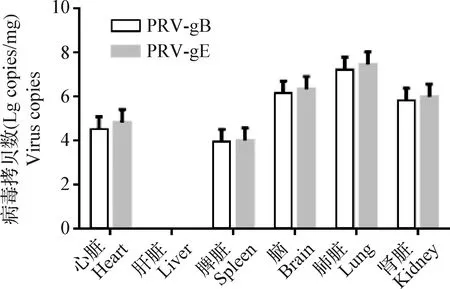
图5 PRV gE和gB基因在小鼠内脏组织中定量分布
2.5 分离毒株gC和gD基因的扩增 对PRVgC和gD基因进行PCR扩增,经1% 琼脂糖凝胶回收后与pMD-18T载体连接,提取质粒进行酶切鉴定,PRVgC质粒酶切得到2条大小分别约1 750 bp和2 640 bp的条带,PRVgD质粒酶切得到2条大小分别约1 367 bp和2 640 bp的条带,与预期结果相符(图6)。
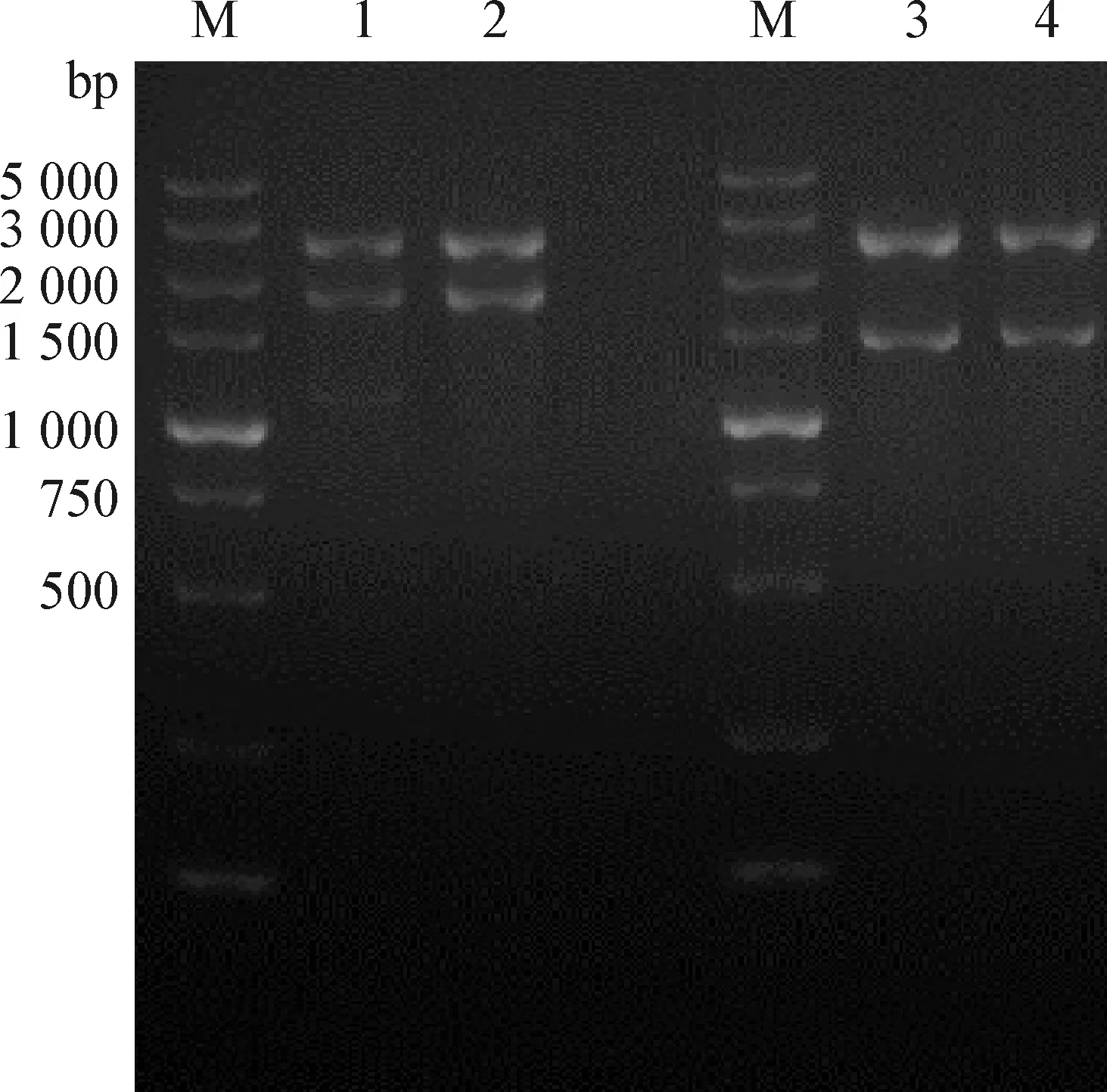
图6 PRV gC、gD基因的PCR扩增
2.6 分离毒株gC、gD基因核苷酸和氨基酸序列同源性分析 分离毒株HNCY株gC、gD基因核苷酸和氨基酸与欧美毒株和国内PRV分离毒株进行比对。结果如表5、表6所示,HNCY株与国内分离株同源性要高于欧美毒株,且gC基因与2011年之后分离的国内变异株同源性更高。

表5 HNCY株gC、gD基因与参考毒株核苷酸序列同源性比对

表6 HNCY株gC、gD基因与参考毒株氨基酸序列同源性比对
2.7 分离毒株gC、gD基因氨基酸进化分析 根据GenBank中已发表的14株国内外PRV参考毒株,运用MEGA 7.1.0软件通过Neighbor-Joining方法对gC、gD基因氨基酸序列进行分析,结果见图7。gC基因氨基酸进化树显示,HNCY-gC(●)与欧美毒株(◆)在不同的大分支上,亲缘关系最远,与国内分离株在同一分支上,与2011年之前分离的毒株(■)在不同的小分支上,与2011年之后分离的毒株在同一分支上,表明HNCY株与2011年之后分离的毒株亲缘关系较近;gD基因氨基酸进化树显示,HNCY-gD(●)与欧美毒株(◆)在不同的大分支上,与国内分离株在同一分支上,表明HNCY株与国内分离的毒株亲缘关系较近;gC、gD基因氨基酸进化树分析表明,HNCY株与国内2011年之后分离的毒株亲缘关系较近。
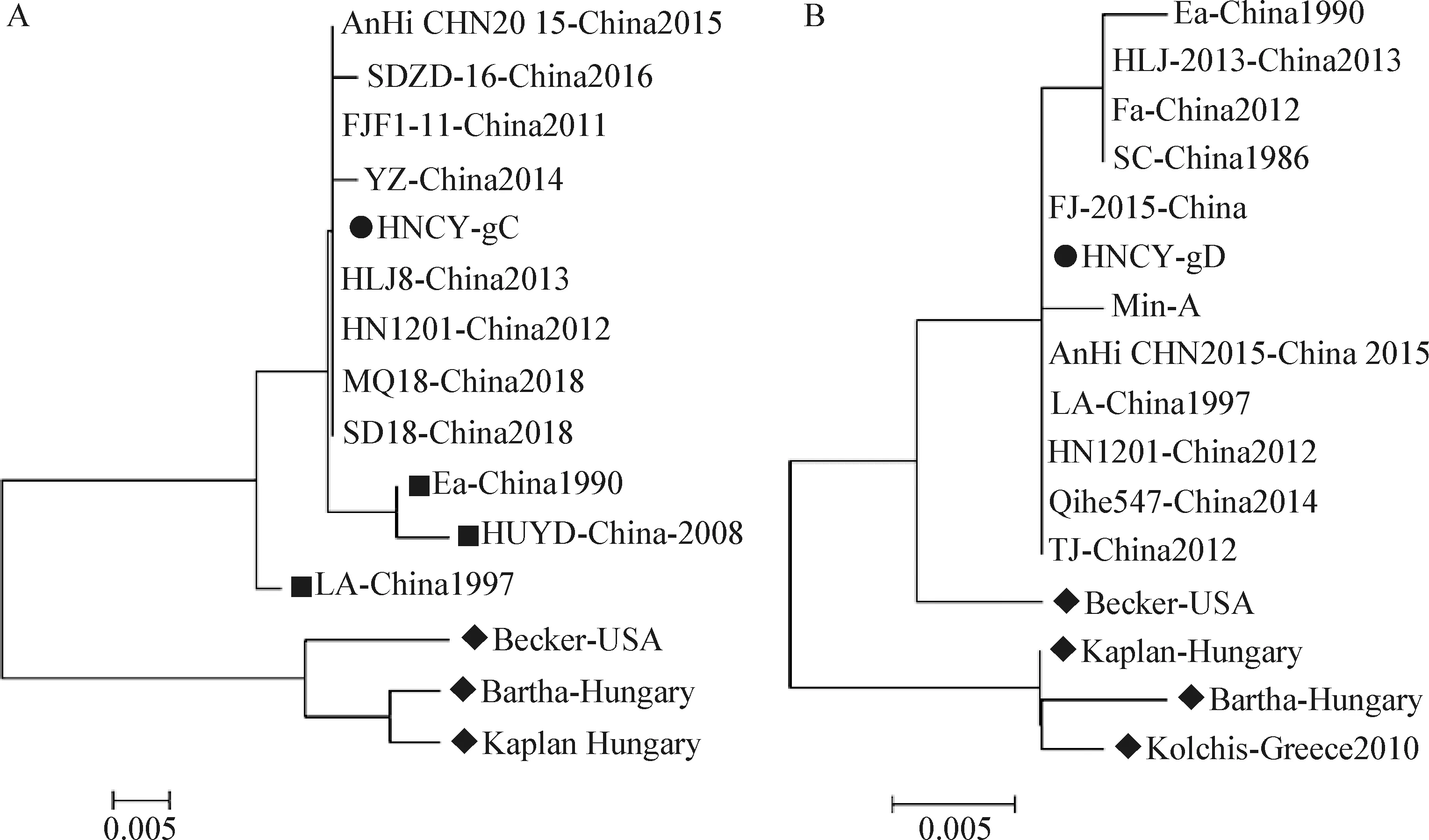
图7 HNCY株gC(A)、gD(B)基因遗传进化分析
3 讨论
PRV是危害养猪业较严重的病原之一[4,6-7]。自2011年以来,随着PRV的遗传进化和变异使得传统疫苗的保护率下降[8-10],猪伪狂犬病有暴发和流行的趋势。2018 年Sun等[11]调查了2012—2017年我国27个省份的PRV分布情况,结果发现全国PRV 的平均阳性率为8.27%。赵胜杰等[12]对2019年河南省规模化猪场猪伪狂犬病病毒gE基因进行血清学检测,gE抗体平均个体阳性率为26.69%,猪场群阳性率为53.60%。
本试验从河南某猪场进行采样,采用组织病料PCR检测、细胞培养、蚀斑纯化、病毒TCID50测定、一步生长曲线测定等方法成功分离出1株PRV野毒株,并对其进行生物学活性研究,说明河南地区有PRV野毒株流行,这与顾阳[13]和张中华[14]的报道基本一致。从免疫过Bartha-K61疫苗的猪场中分离出PRV,表明该猪场所使用的疫苗不能为猪群提供针对PRV流行毒株感染的有效保护。该分离株在PK-15细胞进行纯化后传代培养,其TCID50为10-8.48/0.1 mL,这与翟瑶等[15]所分离出的PRV培养滴度相差10倍,说明不同PRV分离株在PK-15细胞上的生长特性以及感染力存在差异,这可能与PRV吸附、侵染、复制、组装和释放功能的相关基因存在变异有关。通过小鼠试验测定分离毒株的致病性和LD50,结果显示,HNCY分离株的LD50为104.14TCID50,小鼠感染后出现精神沉郁、呼吸加快、撕咬注射部位、死亡等临床症状;剖检后小鼠脾脏、肺脏、肾脏、脑等组织均有不同程度的淤血、出血、水肿甚至坏死等病理变化;荧光定量PCR检测脏器病毒载量,显示肺组织中含毒量最高,其次是脑、肾脏、脾脏、心脏等组织,说明分离毒株对小鼠具有较强的致病性。
gC基因是PRV 基因序列中相对保守的基因,该基因的变异可导致PRV 生物学特性的改变,促使PRV 逃避感染宿主的免疫防御机制。2020年袁献宇等[16]对分离的15 株PRV与2011 年前国内分离的PRV毒株序列进行比对,结果显示,gC基因存在多个位点的变化,包括替换、插入或缺失。2020年鞠厚斌等[17]对2010—2015 年分离的15株PRV 的gD基因进行核苷酸和氨基酸序列同源性对比,同源性分别为99.7%~100% 和99.2%~100%;gC基因核苷酸和氨基酸序列同源性分别为94.9%~100% 和99.2%~100%。
本试验通过对HNCY分离株的gC、gD基因进行序列测定,并与GenBank中其他PRV流行株进行同源性和遗传进化分析。结果显示,HNCY毒株gC基因与国内外其他毒株核苷酸同源性为95.9%~100.0%,其中与欧美毒株的同源性为95.9%~96.2%,而与2011年以后国内分离毒株同源性为99.9%~100.0%;氨基酸序列同源性比核苷酸同源性稍低,HNCY毒株gC基因与欧美毒株的同源性仅为92.9%~93.1%,与2011年之后国内分离毒株的同源性为99.8%~100.0%;HNCY毒株gD基因与其他毒株的核苷酸同源性为98.9%~100.0%,其中与欧美毒株的同源性为98.9%~99.3%,与国内分离的毒株同源性为99.5%~100.0%。HNCY毒株gC基因与欧美毒株及2011年以前分离的毒株不在同一分支上,亲缘关系较远;HNCY毒株gD基因与欧美毒株不在同一大分子上,亲缘关系较远,与2011年以后分离的毒株在同一分支上,亲缘关系较近,本结果与2020年鞠厚斌等[17]分离毒株gC、gD基因氨基酸和核苷酸对比结果相似。
综上所述,HNCY分离株gC、gD基因与国内毒株的同源性均高于欧美毒株,且HNCY株gC基因与2011年之后的国内毒株同源性均高于2011年之前分离的国内毒株,生长特性、致病性与经典毒株伪狂犬病毒闽A株(Fa)和伪狂犬病毒鄂A株(Ea)也基本一致,说明HNCY分离株属于国内变异株。

