AlF3-(Li,Na)F-(Al2O3-Y2O3)熔盐体系物理化学性质研究
郝婷婷,王旭,翟玉春,常云龙
(1.沈阳工业大学材料科学与工程学院,沈阳 110870;2.江西理工大学材料冶金化学学部,江西 赣州 341000;3.东北大学冶金工程学院,沈阳 110006)
0 引言
稀土作为添加剂可以显著改善铝合金机械、热、电磁性能,因此,Al-RE 系稀土合金具有广阔的应用前景[1-3],其中,稀土Y 对Al 的性能改善及作用机理一直受国内外学者的关注,诸多研究表明,加入稀土元素Y 可以显著提高和改善铝系合金的力学性能[4-5]、电磁性能[6]、表面的抗腐蚀和耐酸性能[7]。同时,Y 与Al 的相互作用机理[8]、组织结构[9-10]、金属间化合物的性质[11]研究也不断深入。Al-Cu 系合金强度高、耐热性能和加工性能优良,但其耐蚀性较差,文献[12-13]研究表明加入稀土元素Y 对Al-Cu 系合金的抗腐性能有显著提高,有望突破其应用瓶颈。
目前,制备稀土合金主要有混熔法、铝热还原法和熔盐电解法[14]。由于熔盐电解法在冶炼过程中工艺简单、产品成分均匀易控且环境友好而被广泛采用[15]。制备稀土铝合金的研究从20 世纪六七十年代就已经开始一直延续至今,但熔盐电解制备重稀土元素铝合金的研究仍有待进一步深入开展[16-17]。近年来,GLUKHOV 等[18]尝试采用室温熔盐系统沉积还原金属Y 的探索,但局限于含Y 金属的镀层。实际上,熔盐体系物理化学性质的研究是熔盐电解制备稀土合金的关键制约点之一,20 世纪90 年代,国内外学者已经关注到高温稀土电解体系的热力学数据尤其缺乏[19-20],截至2018 年,美国能源部有关稀土电解质熔盐的立项研究报告就指出,仅有与Ce 元素相关的稀土熔盐电解体系数据可用于工业规模化生产,急需展开稀土熔盐电解体系物理化学性质数据的研究,保证稀土电解合金技术的可行性预测。
本文以Al2O3和Y2O3为原料,采用n((Li,Na)F):n(AlF3)=2.5 的AlF3-(Li,Na)F 体系进行探索性实验制备出Al-Cu-Y 合金,结果表明合金中Al、Cu、Y 相均存在,其中Al 为合金基体,Cu 元素主要分布在Al基晶界处,而Y 则分布于合金中[21],为进一步获取高质量的稀土Al-Cu-Y 合金,需要对熔盐体系的物化性质进行系统研究,本文通过实验测定了温度900~1 000 ℃,n((Li,Na)F):n(AlF3)=2.5 时AlF3-(Li,Na)F-(Al2O3-Y2O3)体系密度、黏度及电导率随温度和成分的变化规律,为进一步优化调整体系性质和电极机理提供基础。
1 实验原理及方法
1.1 原料及耗材
分析纯 的AlF3、LiF、NaF、Al2O3、Y2O3在150 ℃条件下烘干48 h 后,按比例均匀混合后放入石墨坩埚,石墨坩埚使用前表面经乙醇清洗后在低于100 ℃条件下烘干,实验均采用高纯氩气作为保护气。
1.2 实验设备及方法
采用阿基米德法测定体系密度,如图1 所示,将标定体积的钼圆柱体测头悬挂在精密天平下,测量其在大气中的质量,随后测出浸入熔体的质量。利用式(1)计算熔盐的密度所示。

图1 密度测定单元Fig 1 .Measurement unit of density

式(1)中:ρ 为熔盐密度,g/cm3;M1为钼测头在大气中的质量,g;M2为钼测头浸入熔盐后的质量,g;V1为校准的钼测头体积,cm3。
采用连续变化电导池常数(CVCC)法测定电导率,电导池装置示意图如2 所示。钼金属棒作为电极,随着温度变化,其电导率随温度进行修正。电导率仪直接测定熔池导电系数,通过连续改变电极插入电导池的深度来测定电导率值。
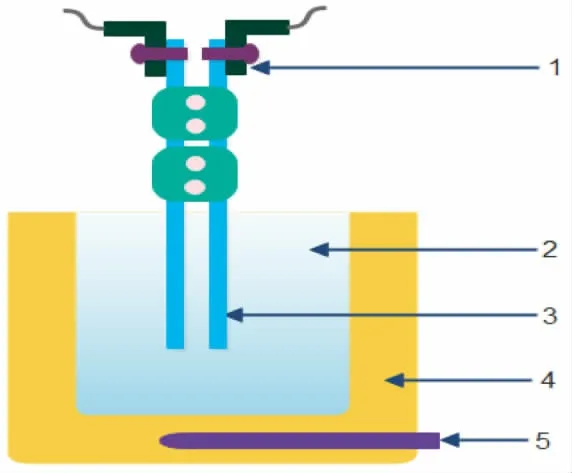
图2 电导率测定单元Fig.2 Measurement unit of conductivity
采用旋转法测定AlF3-(Li,Na)F-(Al2O3-Y2O3)熔盐体系的黏度,如图3 所示,旋转钼圆柱测头浸入待测熔盐。在一定的转速条件下,黏度与钼测头的吊丝转矩成正比,表现为脉冲信号与时间差△t 成正比,通过黏度计测出钼测头的转矩,从而通过式(2)计算出熔体的黏度。

图3 黏度测定单元Fig.3 Measurement unit of viscosity

式(2)中:η 为黏度;K 为常数,用标准黏度液标定为15.761。
2 结果与讨论
2.1 温度对AlF3-(Li,Na)F-(Al2O3-Y2O3)熔盐体系密度、电导率及黏度的影响
综合文献[22-23]的研究结果,可知在900~1 000 ℃温度范围内,Y2O3在不同比例的NaF-AlF3-LiF 体系中的溶解度为2.0%~5.0%(质量分数)之间;Al2O3在冰晶石体系内的溶解度在7.0%~10.0%(质量分数)之间。因此,实验过程Al2O3和Y2O3质量分数分别为10.0%和5.0%,均为饱和状态。
图4 所示为Al2O3和Y2O3饱和条件下AlF3-(Li,Na)F-(Al2O3-Y2O3)熔盐的密度随温度的变化,可以看出,随着温度升高,体系的密度降低,变化范围1.8~2.2 g/cm3,近似为线性关系式(3),主要原因是温度的提高,离子动能提高,平均间距增加,熔体的自由体积增大,密度随之减小。

图4 AlF3-(Li,Na)F-(Al2O3-Y2O3)体系温度-密度关系Fig.4 The relation of T-ρ in AlF3-(Li,Na)F-(Al2O3-Y2O3) melt
图5 所示为Al2O3和Y2O3饱和条件下AlF3-(Li,Na)F-(Al2O3-Y2O3)熔盐的电导率随温度的变化关系,电导率随温度升高而增大,范围在1.9~2.9 S/cm之间变化,呈式(4)所示的线性关系。一方面,温度升高使阴、阳离子间的束缚减弱,离子在电场作用下迁移能力提高;另一方面,熔体内存在的络合离子解离度增大,自由移动的离子增多,从而使得熔盐体系电导率增大。
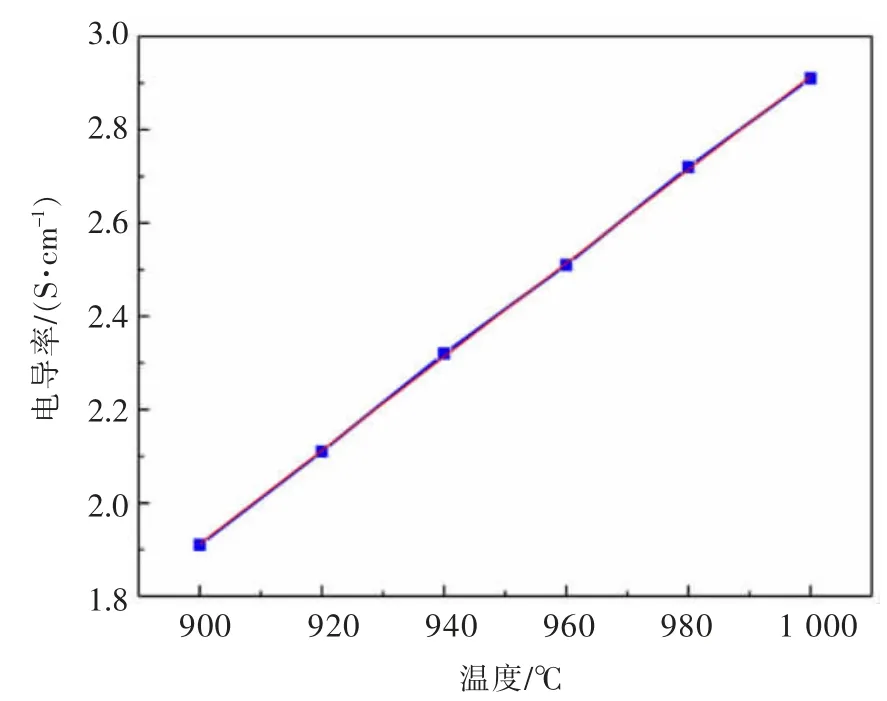
图5 AlF3-(Li,Na)F-(Al2O3-Y2O3)体系温度-电导率关系Fig.5 The relation of T-σ in AlF3-(Li,Na)F-(Al2O3-Y2O3) melt
图6 表明Al2O3和Y2O3饱和条件下AlF3-(Li,Na)F-(Al2O3-Y2O3)熔盐体系的黏度随温度上升而减小,数值在0.030~0.095 Pa·s 之间变化,呈线性关系,如式(5)所示。主因仍然是温度的升高导致体系中离子的平均动能提高,离子间隙增大,自由体积增加,相互吸引力减弱,内摩檫力减小。虽然随温度的提高会增加Al2O3、Y2O3在体系中的溶解量,氧氟络合离子也会增多,但熔体配位空穴也随之增加,离子的位阻仍然减小,因此,体系在温度900~1 000 ℃范围内结构性变化对黏度的影响并不占主导地位。

图6 AlF3-(Li,Na)F-(Al2O3-Y2O3)体系温度-黏度关系Fig.6 The relation of T-η in AlF3-(Li,Na)F-(Al2O3-Y2O3) melt
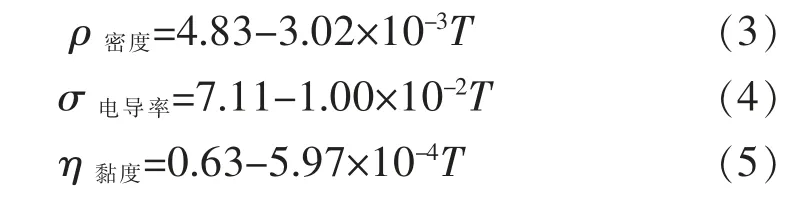
2.2 Al2O3 与Y2O3 对AlF3-(Li,Na)F 密度的影响
图7 所示为是在温度950 ℃条件下,固定Y2O3质量百分数为2%,AlF3-(Li,Na)F-(Al2O3-Y2O3)熔盐体系的密度随Al2O3含量的变化规律,可以看出,体系密度随Al2O3含量增大而减小,变化范围在1.86~2.07 g/cm3之间,近似线性关系式(6)。文献[24]研究表明,AlF3-(Li,Na)F 体系熔盐为冰晶石结构体系,随着Al2O3不断加入,与熔体中F-离子作用,生成AlOF2-、AlOF32-、AlOF54-等铝氧氟络离子,该类络合基团会显著增大体系的自由体积。同时,由于Al2O3的加入并未给体系引进重原子,不会显著增加体系总质量,所以体系的密度总体呈下降趋势。图8 中体系Al2O3的质量分数为7%,AlF3-(Li,Na)F-(Al2O3-Y2O3)体系的密度随Y2O3含量的增加而上升,近似为式(7)的线性关系,密度在1.85~2.13 g/cm3之间。胡宪伟研究表明,稀土氧化物及冰晶石体系的熔盐结构中会存在REF4-离子[25],因此,可以推测,随着Y2O3含量的增大,体系中YF4-络合离子数增加,虽然熔体的自由体积会增加,但Y2O3的加入引入了重原子,体系的总质量增加,所以体系的密度随Y2O3的加入递增。
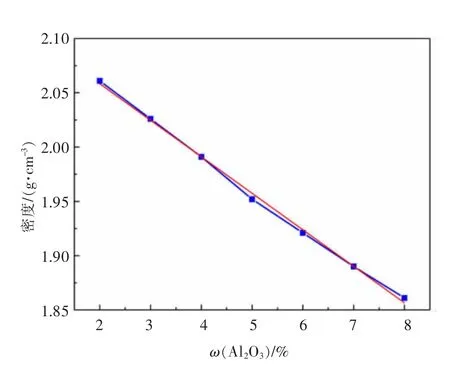
图7 Al2O3 对AlF3-(Li,Na)F 体系密度影响Fig.7 Effect of Al2O3 on the density of the AlF3-(Li,Na)F melt

图8 Y2O3 对AlF3-(Li,Na)F 体系密度影响Fig.8 Effect of Y2O3 on density of AlF3-(Li,Na)F melt

采用最小二乘法进行拟合,可得AlF3-(Li,Na)F-(Al2O3-Y2O3)体系密度与温度、Al2O3、Y2O3之间的关系如式(8)所示。

式(8)中:ρ 为黏度,g/cm3;T 为温度,℃,范围900~1 000 ℃;ω(Al2O3)为Al2O3质量含量,范围为2%~8%;ω(Y2O3)为Y2O3质量含量,范围为1%~4%。
2.3 Al2O3 与Y2O3 对AlF3-(Li,Na)F 黏度的影响
图9 和图10 分别表明了在温度为950 ℃条件下,Al2O3和Y2O3含量对AlF3-(Li,Na)F 体系黏度的影响。图9 表明,当体系中Y2O3的质量分数为2%,Al2O3的质量分数在2%~8%之间变化时,随Al2O3含量的增加,AlF3-(Li,Na)F-(Al2O3-Y2O3)熔盐体系的黏度在0.025~0.065 Pa·s 之间呈线性增大,如式(9)所示。原因是随着Al2O3的质量分数增加,氧氟铝离子也线性增加,导致体系内离子相互作用加强,黏度升高。图10 中体系固定Al2O3的质量分数为7%,Y2O3的质量分数在1%~4%范围内变化,AlF3-(Li,Na)F-(Al2O3-Y2O3)熔盐体系的黏度随Y2O3含量的增加而上升,近似为式(10)的线性关系,黏度变化值在0.020~0.050 Pa·s 之间。同样,Y2O3会与氟化物熔体发生反应生成络合离子YF4-,随着Y2O3含量升高,生成络合离子的数目也不断增加,离子内摩擦力及离子间作用力加强,黏度也随之增加。

图9 Al2O3 对AlF3-(Li,Na)F 体系黏度影响Fig.9 Effect of Al2O3 on the viscosity of the AlF3-(Li,Na)F melt
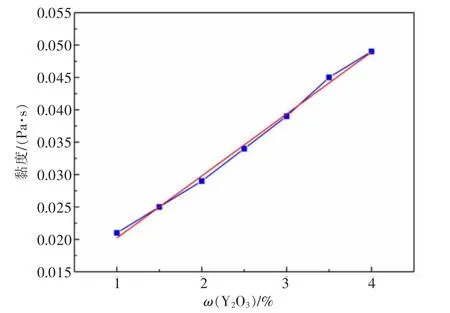
图10 Y2O3 对AlF3-(Li,Na)F体系黏度影响Fig.10 Effect of Y2O3 on the viscosity of the AlF3-(Li,Na)F melt
黏度与温度、Al2O3、Y2O3之间关系经最小二乘法进行拟合,得到如式(11)所示的回归方程。

式(11)中:η 为黏度,Pa·s;T 为温度,取值范围为900~1 000 ℃;ω(Al2O3)和ω(Y2O3)的范围分别为2.0%~8.0%和1.0%~4.0%。
2.4 Al2O3 与Y2O3 对AlF3-(Li,Na)F体系电导率的影响
图11 给出了AlF3-(Li,Na)F 体系电导率随Al2O3含量的变化关系,表明在温度为950℃,Y2O3的质量分数为2%,随着Al2O3的质量分数在2%~8%范围内增加,体系的电导率在2.35~2.75 S/cm 范围内线性减小,如式(12)所示,主要原因是Al2O3溶解到熔盐中会生成的络合阴离子(AlOF2-、AlOF32-等)定向迁移位阻增加,电迁移速率更小,传递电荷离子数目线性减少导致。图12 则展示了Y2O3含量对AlF3-(Li,Na)F 体系电导率的影响,可以看出,在温度为950 ℃时,固定Al2O3的质量分数为7%,体系的电导率随Y2O3的质量分数在1%~4%的范围内增加而减小,变化范围为2.15~2.65 S/cm,关系如式(13)。同样表明F-离子与Y2O3会发生氟化作用,形成电荷载量低且电迁移能力低的离子,且数量随Y2O3的含量线性增加,致使熔盐体系电导率下降。

图11 Al2O3 对AlF3-(Li,Na)F 体系电导率影响Fig.11 Effect of Al2O3 on the conductivity of AlF3-(Li,Na)F melt
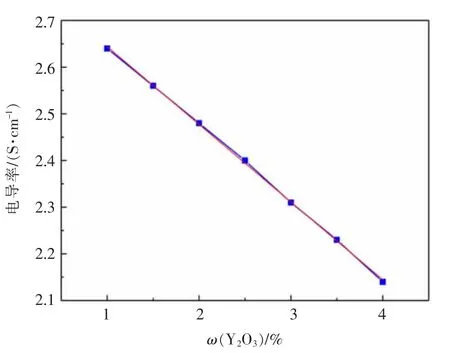
图12 Y2O3 对AlF3-(Li,Na)F 体系电导率影响Fig.12 Effect of Y2O3 on the conductivity of AlF3-(Li,Na)F melt

拟合电导率与温度、Al2O3、Y2O3之间关系,得到如式(14)所示的回归方程。

式(14)中:σ 为电导率,S/cm;T 为温度,范围在900~1 000 ℃;ω(Al2O3)和ω(Y2O3)的范围分别为2.0%~8.0%和1.0%~4.0%。
3 结论
1)在温度为900~1 000 ℃范围,AlF3-(Li,Na)F-(Al2O3-Y2O3)熔盐体系中ω(Al2O3)和ω(Y2O3)分别为10%和5%时,随温度(T)升高,体系密度(ρ)与黏度(η)线性递减,体系电导率(σ)为的线性递增。
2)温度为950 ℃时,AlF3-(Li,Na)F-(Al2O3-Y2O3)体系密度随Al2O3的增加线性递减,Y2O3含量的增加线性递增;黏度随Al2O3和Y2O3含量的增加均表现为线性递增,表明体系内生成的复杂离子的数量也线性增长;体系的电导率随Al2O3和Y2O3含量的增加均表现为线性递减,表明体系内复杂离子的电迁移能力减弱。
3)对比AlF3-(Li,Na)F 体系内引入Y2O3和Al2O3后,由于重稀土氧化物Y2O3在体系中的溶解度相对较低,体系的结构性变化较小;而由于AlF3的作用,Al2O3的溶解度显著增加,引起体系的结构性变化较大,因此影响幅度相对较大。就密度而言,Y2O3在体系中直接引入重元素Y,导致体系密度增加,与Al2O3的作用相反;而加入Y2O3和Al2O3后,体系内均会生成复杂离子,造成体系黏度增加、电导率减小,影响作用相同。

