氧化锌法矿化吸收重金属冶炼烟气中SO2的研究
范晓彬, 张伟光*, 曹雪娇, 李义兵, 蔡震雷, 张廷安
(1.桂林理工大学,a.材料科学与工程学院;b.有色金属及材料加工新技术教育部重点实验室,广西 桂林 541004;2.武汉科技大学国家环境保护矿冶资源利用与污染控制重点实验室,武汉 430081;3.东北大学冶金学院,沈阳 110819)
重金属冶炼企业中冶金炉烟气中SO2浓度一般在1%以下,属于低浓度SO2范围,直接制酸烟气浓度不够,该烟气的处理是目前亟待解决的环境污染问题[1-5]。
世界各国对冶炼烟气脱硫问题都非常重视,科研工作者研究开发了多种具有应用价值的脱硫技术[6-14]。国内重金属冶炼厂普遍采用湿法脱硫技术,包括:石灰/石灰石-石膏法[15]、钠碱法[16-17]、氧化锌法[18-21]、氨法[22]、离子液法[23]等。其中,石灰/石灰石-石膏法存在产物石膏难以综合利用的难题,且每处理1 t SO2将产生2.69 t脱硫石膏;氨法存在生产成本高、易腐蚀、净化后尾气中含有气溶胶等问题;离子液法运行过程吸收剂损耗量较大,增加了运行成本。随着国家环保政策对于烟气中SO2的排放限制越来越严格,为了满足生态环境及经济发展的要求,冶炼企业中低浓度SO2的高效、经济、环保、稳定脱除成为烟气治理的重点。氧化锌法是铅锌企业常用的脱硫方法,主要用于传统湿法炼锌回转窑烟气治理。同时,氧化锌法脱硫可与锌冶炼生产系统有机结合,解决脱硫产物的去处问题,所用吸收剂为自产的氧化锌尘或氧化锌焙砂,可大大节约脱硫剂成本,从而大幅降低脱硫系统的运行成本。相对其他工艺,氧化锌吸收工艺可作为铅锌冶炼企业脱硫的首选方法。
在实际运行过程中,氧化锌首先制成料浆进行SO2吸收,生成亚硫酸锌产物后,在脱硫塔底部继续氧化生成硫酸锌,当硫酸锌继续循环到一定浓度后返回电解车间。SO2吸收是氧化锌脱硫工艺的核心部分,由于脱硫过程中亚硫酸锌氧化速率较低,导致浆液中亚硫酸锌含量累积,浆液中固含量增加,容易在脱硫塔内壁、进料筒、喷嘴、除雾器等部位结垢。针对上述问题,本团队提出采用喷吹搅拌协同臭氧氧化的脱硫过程,氧化锌脱硫过程中直接生成硫酸锌,从而避免亚硫酸锌的生成,减少亚硫酸锌在体系中的积累和浆液固含量的增加,减少体系管道和反应器的结垢[24-26]。
本文在前期氧化锌脱硫反应器物理模拟基础上[27],重点研究氧化锌在喷吹搅拌反应器中对低浓度SO2吸收过程的规律,为氧化锌矿化吸收低浓度SO2提供理论基础。
1 试 验
1.1 材料和试剂
所用原料为分析纯氧化锌试剂(纯度99.7%)。所用烟气为模拟烟气,通过调节氮气、SO2流量在混合罐中混合而得。
1.2 试验方法
基于氧化锌脱硫反应器物理模拟的研究结果[27],采用偏心搅拌研究氧化锌脱硫过程。实验条件为采用SSB-D搅拌桨、8孔喷嘴结构、偏心度为0.4、搅拌桨浸入深度为80 mm、搅拌转速为300 r/min,考察氧化锌浓度、SO2浓度、通气流量以及硫酸锌浓度对氧化锌脱硫过程的影响,包括对脱硫率、溶液体系pH值的影响。
实验设备连接如图1所示。实验时,在反应器中加入去离子水,再加入氧化锌配成吸收液(或添加硫酸锌考察其浓度对脱硫过程的影响),从反应器底部通入模拟烟气,混合气体由氧化锌浆液吸收,尾气经SO2测定仪测定浓度后,由NaOH溶液吸收净化后排空。实验过程中SO2测定仪测量烟气进出口浓度,由PHS-3F型pH酸度计测量体系中pH值的变化,全谱直读等离子体发射光谱仪(ICP)测定溶液中锌离子浓度的变化,考察氧化锌吸收SO2的影响规律。脱硫率η(SO2)计算公式如下:
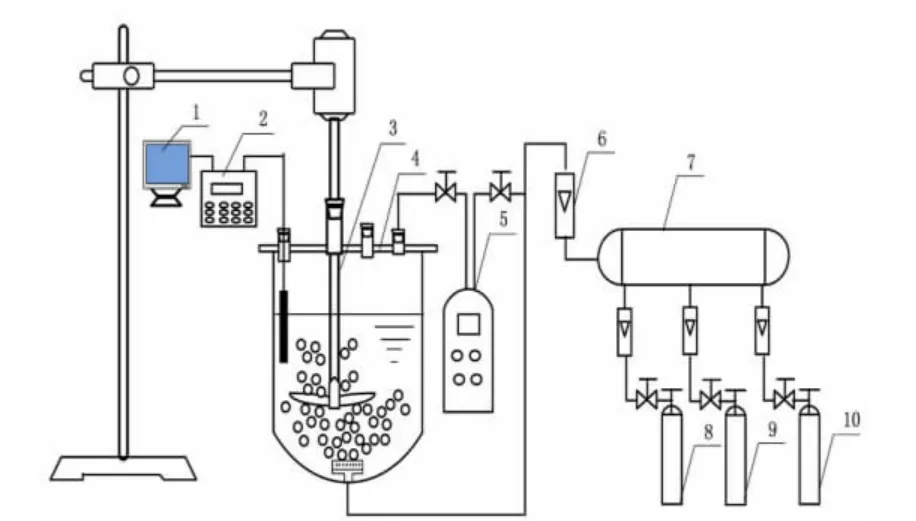
图1 氧化锌脱硫实验装置示意Fig.1 Experimental apparatus of zinc oxide desulfurization
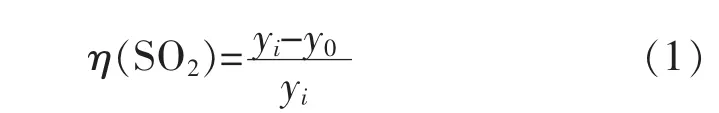
式(1)中:yi和y0分别为进气和尾气中SO2的浓度。
1.3 脱硫反应机理
氧化锌法脱硫工艺主要发生的反应如下:
1)吸收过程:氧化锌法脱硫技术的基本原理是利用氧化锌与烟气中的SO2反应生成溶解度较小的ZnSO3·H2O(25℃,Ksp=1.34×10-5)[19],进入沉渣,实现SO2的固化。当SO2过量时,吸收过程还可能生成Zn(HSO3)2,而当ZnO过量时主要以不溶性的ZnSO3·H2O为主。
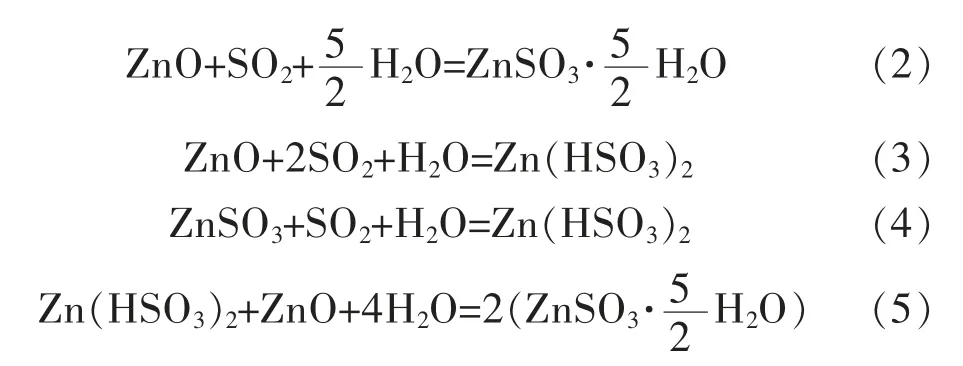
2)氧化过程:
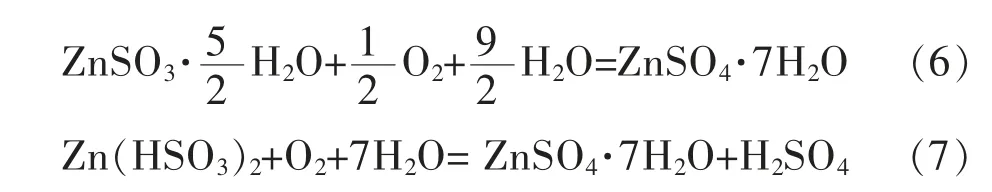
亚硫酸锌的氧化过程是一个气-液-固三相的复杂反应过程,氧化过程主要在液相中进行,该过程包括以下6个步骤[25]:
1)亚硫酸锌固体溶解为Zn2+和SO32-到水中;
2)SO32-水解成HSO3-;
3)O2通过搅拌器分散到浆料中并扩散到气-液界面;
4)HSO3-扩散到气-液界面,并与溶解的O2反应形成SO42-和H+;
5)氧化过程产生的SO42-扩散到水中;
6)步骤①产生的Zn2+扩散到液-固界面。
2 结果与讨论
2.1 ZnO浓度对脱硫过程的影响
在SO2浓度为1 200 mg/m3、O2浓度为14.29 g/m3、通气流量为360 L/h条件下,考察氧化锌浓度对脱硫过程的影响,实验过程不再补充吸收剂,实时测量出气口SO2浓度变化及溶液pH值变化。
浆液ZnO浓度对SO2脱除率的影响结果如图2所示。反应初期,脱硫率达到100%,说明在较长一段时间内吸收剂氧化锌具有较好的吸收效果;同时,溶液中没有氧化锌存在时,纯水对SO2也具有一定的吸收反应能力。随着反应的进行,喷吹搅拌反应槽中的氧化锌逐渐被消耗殆尽,烟气出口开始检测到SO2,此时SO2的吸收率也开始急剧下降。随着氧化锌浓度由0增加到0.05%,有效脱硫时间(从脱硫过程开始到脱硫率出现下降的时间)由50 min增加到180 min。
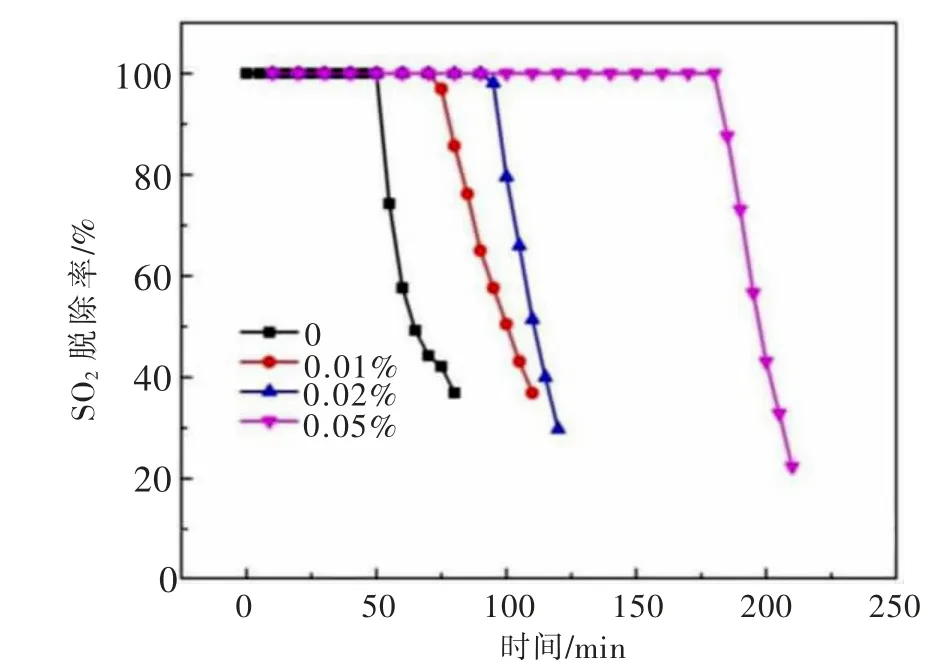
图2 ZnO浓度对SO2脱除率的影响Fig.2 Effects of ZnO concentration on the SO2 removal efficiency
浆液ZnO浓度对pH值的影响结果如图3所示。pH值变化分为3个阶段:缓慢下降、迅速下降以及基本不变。缓慢下降阶段:主要为SO2与氧化锌水解产生的氢氧化锌进行反应;迅速下降阶段:当浆液中的氧化锌消耗完毕后,pH值开始急剧下降;基本不变阶段:当溶液吸收SO2饱和后,pH值维持不变。随着氧化锌浓度的增加,pH值缓慢下降阶段的时间增加,体系维持在较高的pH值,弱碱性条件下有利于氧化锌吸收SO2。因此,增加氧化锌浓度有利于SO2的吸收。
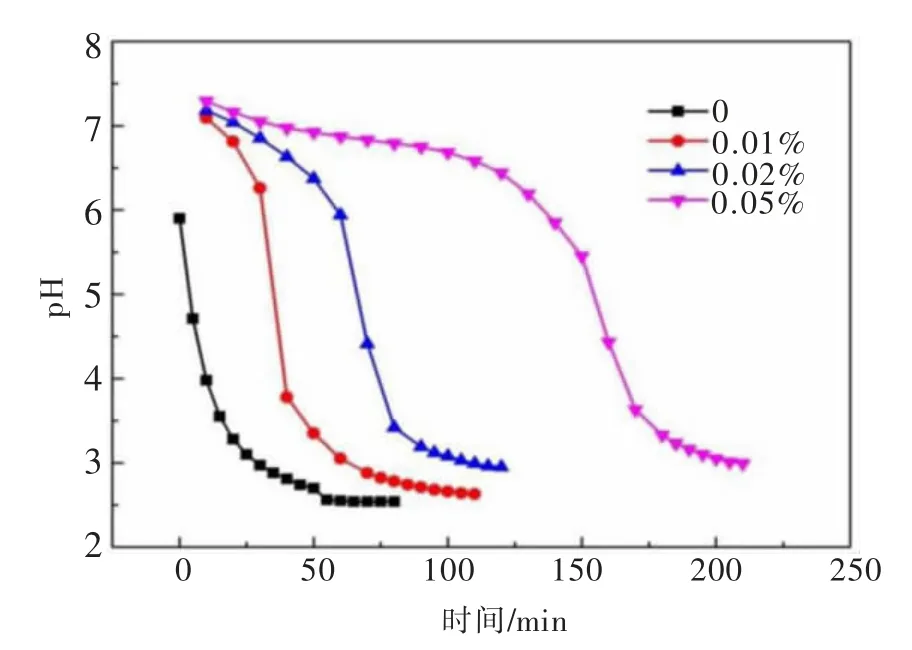
图3 ZnO浓度对溶液p H值的影响Fig.3 Effects of ZnO concentration on the solution p H value
2.2 SO 2浓度对脱硫过程的影响
氧化锌浓度为0.02%、O2浓度为14.29 g/m3、通气流量为360 L/h条件下,考察SO2浓度对脱硫过程的影响,实验过程不再补充吸收剂,实时测量出气口中SO2的浓度变化及溶液pH值变化。
图4所示为不同SO2浓度对于氧化锌脱除二氧化硫效率的影响。反应开始阶段,不同浓度的SO2脱除率均达到100%,表明喷吹搅拌反应槽具有较好的吸收反应能力。随着烟气中SO2浓度从800 mg/m3增加到2 400 mg/m3,有效脱硫时间由199 min缩短至46 min,且当SO2浓度较低时,脱硫率下降的速度减缓。体系中氧化锌浓度一定,随着SO2浓度的增加,单位时间里进入喷吹搅拌反应槽的SO2总量增加,脱硫剂失效速度变快,有效脱硫时间缩短。
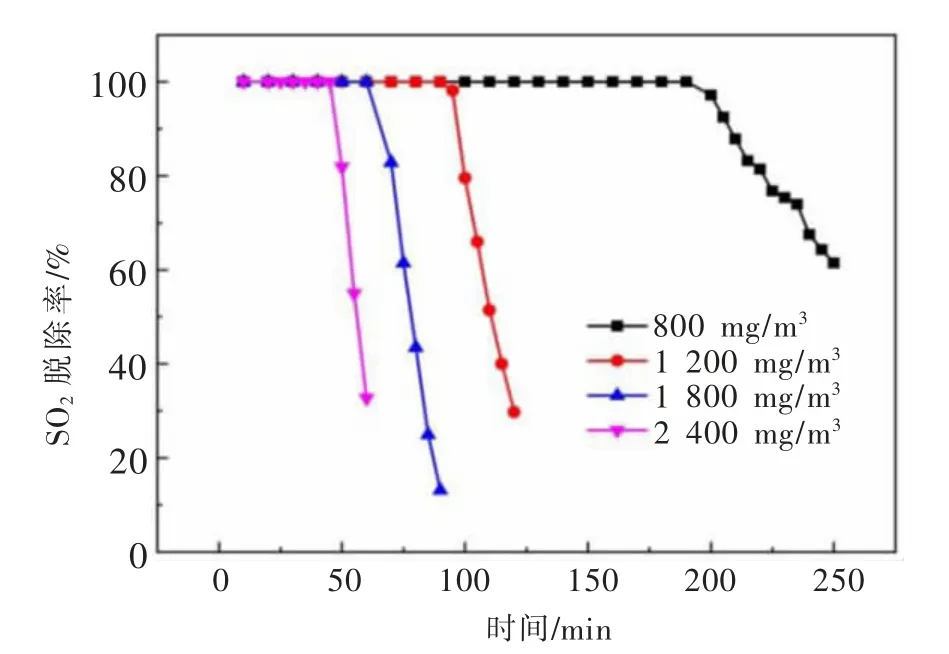
图4 SO2浓度对SO2脱除率的影响Fig.4 Effects of SO2 concentration on the SO 2 removal efficiency
不同SO2浓度对溶液pH值的影响如图5所示。氧化锌溶解后溶液pH值约为7.5,溶液pH值的变化规律同样可分为缓慢下降、迅速下降以及基本不变3个阶段。随着SO2浓度的增加,单位时间进入体系中的SO2总量增加,溶液酸化速度增加,pH值缓慢下降阶段的时间缩短。
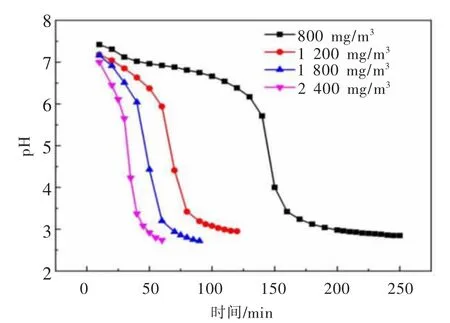
图5 SO2浓度对溶液p H的影响Fig.5 Effects of SO2 concentration on the solution p H value
2.3 通气流量对脱硫过程的影响
ZnO浓度为0.02%、SO2浓度为1 200 mg/m3、O2浓度为14.29 g/m3条件下,考察通气流量对脱硫过程的影响,实验过程不再补充吸收剂,实时测量出气口中SO2的浓度变化及溶液pH值变化。
通气流量对SO2脱除率的影响如图6所示。反应初始,由于体系中氧化锌浆液为饱和,吸收反应推动力较大,SO2迅速被氧化锌吸收,出口处SO2浓度为0,氧化锌脱硫率为100%。随着烟气通气流量的增加,液体搅动作用越发强烈,气泡直径逐渐减小,增大的气液接触界面加速了氧化锌对SO2的吸收速度。当通气流量由240 L/h增加到420 L/h时,高效脱硫时间由160 min缩短到60 min。
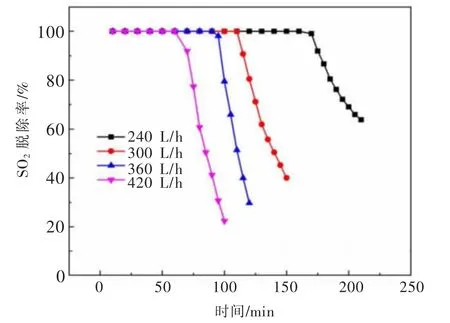
图6 通气流量对SO2脱除率的影响Fig.6 Effects of gas flow on the SO 2 removal efficiency
通气流量对溶液pH值的影响如图7所示。反应初期pH值约为7,氧化锌溶解后溶液呈中性,随着反应的进行,pH值缓慢下降。随着通气流量的增加,单位时间内向体系通入的SO2总量增加,因而其溶液酸化速度增加,吸收剂消耗的速度增加,体系的pH值下降速度增加,因此pH值维持缓慢下降的时间缩短。
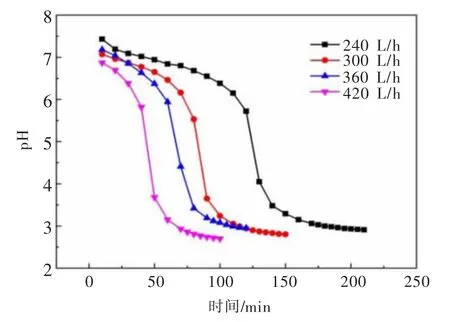
图7 通气流量对溶液p H的影响Fig.7 Effects of gas flow on the slurry p H value
2.4 浆液ZnSO 4浓度对脱硫过程的影响
ZnO浓度为0.02%、SO2浓度为1 200 mg/m3、O2浓度为14.29 g/m3、通气流量为360 L/h条件下,考察浆液ZnSO4浓度对脱硫过程的影响,实时测量出气口中SO2的浓度变化及溶液pH值变化。
浆液ZnSO4浓度对SO2脱除率的影响如图8所示。反应初期,氧化锌吸收SO2脱硫率达到100%,说明在较长一段时间内吸收剂具有较好的吸收效果。当浆液中硫酸锌浓度为0时,高效脱硫时间为95 min。随着浆液硫酸锌浓度从0.5 mol/L增加到1.5 mol/L时,高效脱硫时间从140 min缩短至117 min,其原因为:过多的Zn2+络合了OH-,溶液p H值降低,进而影响了脱硫效率,导致脱硫时间不断缩短。
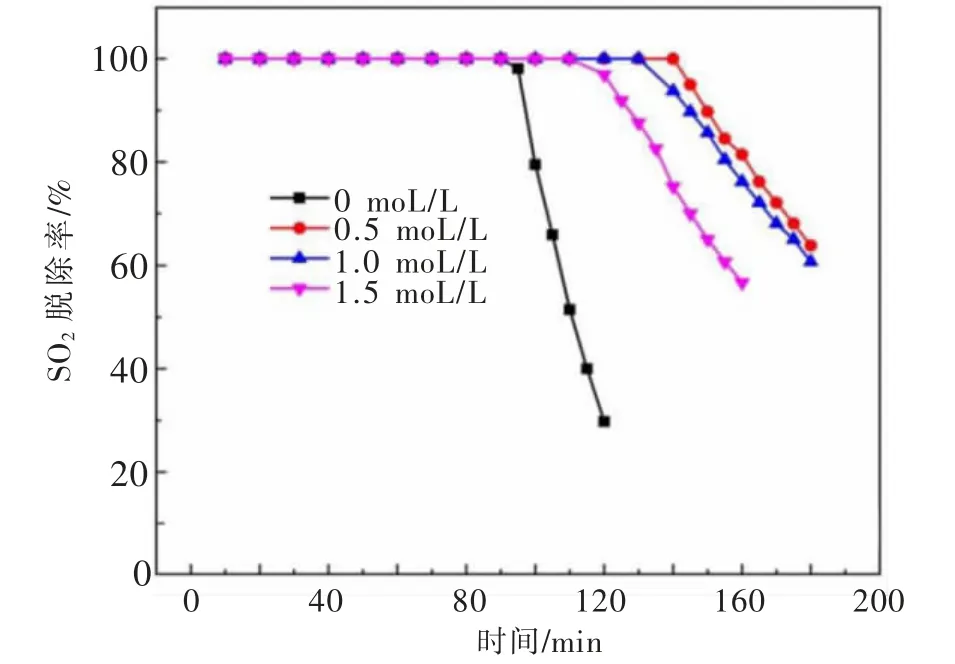
图8 浆液ZnSO4浓度对SO2脱除率的影响Fig.8 Effects of ZnSO4 concentration on the SO2 removal efficiency
浆液ZnSO4浓度对溶液pH值的影响如图9所示。加入硫酸锌,溶液中Zn2+与OH-发生络合反应,使得溶液中H+浓度增加,相应地溶液pH值(5~5.5)较没有添加硫酸锌时要低(pH约为7.2)。随着硫酸锌溶液的增加,反应起始的pH值逐渐降低,其吸收过程pH值的下降速度基本一致,均随反应的进行而逐渐下降。当出口检测到SO2浓度时,溶液pH值下降较小,基本不变。当浆液吸收SO2饱和时,溶液pH值将维持不变。
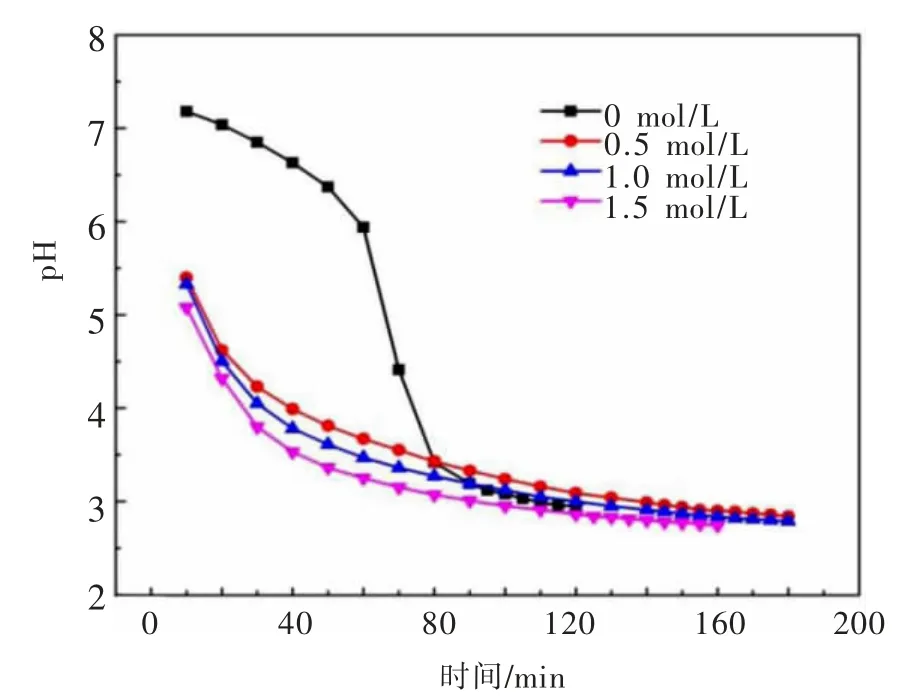
图9 浆液硫酸锌浓度对溶液p H的影响Fig.9 Effects of zinc sulfate concentration on the solution p H value
3 结 论
针对重金属冶炼烟气中低浓度SO2问题,采用喷吹搅拌反应装置进行氧化锌脱硫实验规律研究,考察了ZnO浓度、SO2浓度、通气流量、浆液ZnSO4浓度对氧化锌脱硫过程的影响,得到以下结论:
1)随着ZnO浓度从0提高到0.05%,有效脱硫时间由50 min延长至180 min;ZnO浓度一定时,随着SO2浓度、通气流量及浆液ZnSO4浓度的增加,有效脱硫时间缩短。
2)浆液的pH值变化可分为3个阶段:缓慢下降阶段,迅速下降阶段以及基本不变阶段(pH值由6~7下降至2~3)。随着ZnO浓度的增加,浆液的pH值下降缓慢,而随着SO2浓度、通气流量及硫酸锌浓度的增加,浆液的pH值下降速度加快。

