胶体溶液制备碳纳米管负载钌纳米颗粒的电催化合成氨性能
谢程露,黄贤坤,2,康丽霞,2,刘永忠,2
(1西安交通大学化学工程与技术学院;2新能源系统工程与装备陕西省高校工程研究中心,陕西 西安710049)
氨作为肥料及其他化学品的重要原料,在国民经济中具有重要地位[1]。同时,氨的含氢质量分数高达17.6%,储能密度为4.3 kWh/L,且具有易于储存运输的特点。因此,氨已经成为了具有前景的储氢介质及燃料[2]。目前,工业上生产的氨主要来源于高温(400~600 ℃)高压(15~30 MPa)的哈伯-博施法[3]。该能源密集型的生产方式伴随着大量的能量消耗及全球近1%的CO2气体排放[4]。因此,人们期望寻找一种能够在温和条件下合成氨的方法以替代传统的哈伯-博施法。
近些年来,电化学合成氨(electrochemical nitrogen reduction reaction, ENRR)的方法由于装置简单,反应条件温和,低排放,可由可再生能源供应能量,并实现小规模分散式合成氨的优势,吸引了研究人员的注意。然而,由于惰性的N≡N三键难于活化,克服945 kJ/mol 的N≡N 键能[5]是合成氨过程中一个很大的挑战。同时,电化学合成氨的过程在水溶液体系下还存在竞争性析氢反应(hydrogen evolution reaction,HER)[6],表现出较低的法拉第效率。因此,高活性、高选择性的催化剂开发是目前电化学合成氨的主要研究方向[7]。
目前,ENRR催化剂可分为金属催化剂以及非金属催化剂。在金属催化剂中,Au[8-9]、Ag[10]、Pt[11-12]、Pd[13]、Rh[14]、Cu[15-16]、Co[17]等都具有优异的电催化性能。钌(Ru)作为目前工业化合成氨的催化剂之一,因其在ENRR的理论研究中[18]具有较好的N2吸附性能而被认为是具有ENRR 应用前景的催化剂之一[19-21]。然而,水溶液体系下Ru的ENRR过程伴随着同样强烈的氢吸附,加剧了竞争性的HER,导致Ru对ENRR选择性降低。
提高催化剂的ENRR 选择性可通过提高N2吸附来提高催化剂的氨产率[22]。氮掺杂的Ru SAs/N-C可有效提高N2的吸附效果,从而提高ENRR 选择性[23]。而Yu 等人[24]则通过使用g-C3N4负载Ru,在增强催化剂对N2吸附能力的同时降低催化剂与H+的反应活性,从而提升催化剂的ENRR 催化性能。抑制竞争性的HER 同样可以提高催化剂的ENRR选择性。Tao等人[25]尝试在单原子Ru催化剂中添加ZrO2,在不影响氨产率的前提下,抑制HER,从而提高了法拉第效率。
此外,催化剂颗粒纳米化对提高ENRR选择性具有促进作用。Au 纳米颗粒的尺寸效应会影响颗粒的内部活性,在4~10 nm 的Au 纳米颗粒尺寸中,8 nm的Au纳米颗粒表现出最好的ENRR催化性能[9]。Zhang等人[26]通过缩小Rh纳米颗粒,促进了Rh 纳米颗粒与底物之间的电荷交换,得到高达23.48%的法拉第效率。Lin等人[15]通过结合聚酰亚胺(PI)与Cu,使Cu 纳米颗粒上的电子重新分配,形成抑制HER的缺电子Cu。因此,纳米颗粒与载体的结合也能提高其ENRR催化性能。性能优异的载体能够实现更加快速地转移电荷,提高催化剂颗粒活性。
碳纳米管载体(CNT)具有一定的疏水性,在水溶液体系下能够降低催化剂表面的氢吸附,抑制竞争性HER。同时,CNT 优异的导电性能可实现ENRR过程中更快的电子转移,丰富的比表面积可提供更多的ENRR催化活性位点,并且还具有良好的稳定性[27]。因此,CNT在ENRR中备受欢迎。各种负载在CNT 上的金属催化剂应用于ENRR 的研究,如Fe2O3-CNT[28]、Co2O3@CNT[29]、Au-CNT[30]等均实现了较高的氨产率及法拉第效率。除了提高催化剂对ENRR的选择性,载体负载纳米颗粒的应用还能够减少金属催化剂负载,大幅降低成本[31]。
综上所述,本研究提出通过胶体溶液制备碳纳米管负载Ru 纳米颗粒的催化剂制备方法,并与常规的回流法还原得到Ru/CNT进行对比研究,试图通过在CNT 载体上分散更均匀、催化活性位点更多、缩小Ru粒径等策略,进一步提升ENRR性能,为ENRR催化剂的研究和开发提供新思路。
1 实验部分
1.1 化学试剂与材料
商用多壁碳纳米管(>97%),购自穗衡科技;水合三氯化钌(99.99%),购自上海易恩化学技术有限公司;氢氧化钠(AR),购自天津大华科技有限公司;氯化铵(99%),购自成都市科隆化学品有限公司;水杨酸(99.5%),柠檬酸钠(98%),硝普钠(99.0%),购自上海麦克林生化科技有限公司;盐酸(36.5%~38.0%),购自阿法埃莎(中国)化学有限公司;Nafion 溶液(5%),Nafion 膜(Nafion 117),购自杜邦有限责任公司;硝酸(65.0%~68.0%),乙醇(>99.7%),购自中国医药集团有限公司;乙二醇(AR),购自天津市富宇精细化工有限公司;疏水碳纸(20% 疏水),购自日本东丽株式会社;氮气(99.999%),氩气(99.999%),购自陕西快特气体有限公司;超纯水自制。
1.2 碳纳米管负载Ru纳米颗粒Ruc/CNT催化剂及对比样品Ru/CNT的制备
1.2.1 碳纳米管负载Ru 纳米颗粒Ruc/CNT催化剂的制备
①Ru 纳米颗粒的制备:首先,将0.15 g RuCl3·nH2O 与0.2 g NaOH 加入50 mL 乙二醇中,在室温下搅拌30 min。随后,将搅拌后的溶液迅速加热至160 ℃并保持该温度回流3 h[32]。然后,在空气中冷却到室温,得到深棕色的含Ru 颗粒的溶液,记为Ru胶体溶液。②Ruc/CNT催化剂的制备:量取80 mL 去离子水,加入50 mg CNT,超声分散1 h 后,分别加入0.455、0.685、1.185和2.370 mL的Ru胶体溶液,用0.1 mol/L HCl 将溶液pH 值调节至3以下,搅拌24 h。之后,用去离子水离心洗涤3 次,分离后在60 ℃下干燥12 h,得到理论Ru 负载量分别为碳纳米管质量的1.0%、1.5%、2.5%及5.0%的0.010-Ruc/CNT、0.015-Ruc/CNT、0.025-Ruc/CNT 及0.050-Ruc/CNT 粉末样品,具体流程如图1所示。

图1 Ruc/CNT制备流程图Fig.1 Schematic illustration of the preparation of Ruc/CNT
1.2.2 对比样品碳纳米管负载Ru 颗粒Ru/CNT 催化剂的制备
称取80 mg 预处理过后的CNT、NaOH 及50 mg RuCl3·nH2O,加入100 mL乙二醇,超声分散1 h后移入圆底烧瓶中,在160 ℃下回流3 h,待其冷却至室温后离心分离,并用去离子水清洗3 次,乙醇清洗1次,60 ℃下干燥12 h,得到Ru/CNT粉末样品。
1.3 样品表征
采用型号为XRD-6100的X射线衍射(XRD)仪,测定样品的晶相结构,射线源为Cu Kα靶,2θ扫描范 围20° ~90° 。 采 用 型 号 为Thermo Fisher ESCALAB Xi+的X射线光电子能谱仪(XPS)对样品的表面元素组成和价态进行表征。采用型号为NETZSCH STA 449F5的同步热分析仪测定样品的组分比例。采用型号为Talos-F200X的洛伦兹透射电镜(TEM)观察样品表面形貌。采用型号为DSA100 的接触角测量仪对样品接触角进行测试。采用TU-1900 型的紫外-分光光度计对溶液吸光度进行测定。
1.4 工作电极的制备
称取2 mg催化剂,加入600 μL乙醇、200 μL去离子水以及200 μL 5% Nafion 溶液,超声1 h,制成催化剂墨水。量取150 μL 催化剂墨水滴加在碳纸上,滴加面积为1cm×1 cm,催化剂负载量约为0.3 mg。
1.5 电化学测试
电化学测试在电化学工作站(辰华CHI 660e)下进行,采用三电极系统进行测试。在三电极系统中,负载催化剂的碳纸作为固定的工作电极,1 cm×1 cm铂片为对电极,Ag/AgCl为参比电极。选用H型电解池,通过Nafion 117膜隔开阴极室与阳极室,电解池内电解液为0.1 mol/L HCl,容积均为50 mL。测试过程中持续向电解池内通入气体,通气速率为20 mL/min。所有实验均在常温常压下进行。
通过式(1)将电位换算为可逆氢电位
E(RHE)=E(Ag/AgCl)+ 0.197 + 0.059pH (1)
1.5.1 线性伏安扫描测试
线性伏安扫描(LSV)测试前,分别向电解液中通入30 minAr 或N2,排出反应器内其他气体,扫描电压范围为0.0 V(vs.RHE)至-0.5 V(vs.RHE),扫描速率为5 mV/s。
1.5.2 电化学氮气还原测试
电化学氮气还原在-0.05、-0.10、-0.15、-0.25、-0.35 V (vs. RHE)的恒定电位下进行2 h 测试。每次ENRR 反应前先通入N230 min,排出反应器内其他气体并且使溶液中溶解的N2饱和。反应过程中保持N2速率。
1.5.3 循环稳定性测试
反应前通入30 min N2,在-0.10 V (vs. RHE)电压下反应2 h后,更换溶液,再次进行前述操作,重复5次循环。
1.5.4 长时间稳定性测试
反应前通入30 minN2,在-0.10 V(vs.RHE)电压下反应12 h.
1.6 产物测定
通过靛酚蓝法对ENRR 的NH3产物进行测定。取2 mL 待测溶液,加入2 mL 含5%水杨酸、5%柠檬酸钠与1 mol/L NaOH 的水杨酸溶液,再加入1 mL 用2 mol/L NaOH 稀释 的0. 05 mol/L 次氯酸钠溶液及0.2 mL 1%硝普钠溶液,静置2 h 后使用紫外-分光光度计测定溶液在约655 nm 处的吸光度。
建立氨浓度梯度,其靛酚蓝的吸光度曲线、标准曲线及计算公式由图2(a)、(b)中曲线给出。氨产率及法拉第效率通过式(2)、(3)进行计算

图2 氨浓度梯度紫外-可见光谱及标准曲线Fig.2 UV-vis spectra and standard curve for ammonia standard solutions with different concentrations

其中,[NH3]表示反应后溶液中的氨浓度;V为阴极室溶液容积;t为反应时间;m为碳纸负载催化剂质量;F为法拉第常数;Q为反应总电荷。
采用Watt-Chrisp 法对N2H4进行检测。称取5.99 g 二甲氨基苯甲醛加入30 mL 浓盐酸及300 mL乙醇作为显色液。向5 mL待测溶液中加入5 mL显色液静置10 min后使用紫外-分光光度计测量455 nm 处的吸光度。图3 给出了N2H4的标准曲线及计算公式。

图3 N2H4标准曲线Fig.3 Standard curve for N2H4 standard solutions with different concentrations
2 结果与讨论
2.1 结构和形貌分析
Ruc/CNT 及Ru/CNT 粉末样品的XRD 测试结果如图4所示。
从图4 中可以看出,通过胶体溶液还原的Ru纳米颗粒负载在CNT 上得到的Ruc/CNT 无明显的Ru 的特征衍射峰出现,仅有对应于碳纳米管标准卡片PDF#41-1487 在26°、42°、54°及77°处的峰,推测是由于Ru 颗粒太小无法检测出峰。而Ru/CNT 位于38°、42°、44°、58°、69°、78°、82°、84°及85°的衍射峰与Ru 的标准卡片PDF#06-0663 对应,证明Ru 成功在CNT 上还原。采用X 射线光电子能谱(XPS)对Ru/CNT 和0.025-Ruc/CNT表面化学状态进行研究,以进一步分析其表面元素构成。

图4 CNT、Ruc/CNT及Ru/CNT的XRD图Fig.4 XRD patterns of CNT,Ruc/CNT,and Ru/CNT
图5(a)、(b)分别给出了0.025-Ruc/CNT 和Ru/CNT 两种样品的Ru 3d 及C 1s 的XPS 拟合谱图。图5(a)中Ru 3d 峰的存在表明0.025-Ruc/CNT 与Ru/CNT 均有Ru 负载。图5(b)中284.4 eV、285.5 eV处的峰分别对应C—C及C—O键。XPS的峰强度还能用于定性元素含量,峰强度越高代表元素含量越高。Ru/CNT 的Ru 3d 峰较0.025-Ruc/CNT 更高,表明Ru/CNT 中Ru 负载量较0.025-Ruc/CNT高。这与热重分析结果一致。如图5(c)的热重分析图所示,0.025-Ruc/CNT 和Ru/CNT 中Ru 含量分别为1.35%及13.19%。

图5 0.025-Ruc/CNT及Ru/CNT的XPS及热重分析图Fig.5 XPS spectra and TGA curves of 0.025-Ruc/CNT and Ru/CNT
两种催化剂表面形貌如图6(a)、(b)中的TEM图所示,从两图中均可观察到碳纳米管的管状结构以及代表Ru 颗粒的亮点。对比两图的Ru 颗粒,0.025-Ruc/CNT 的Ru 颗粒直径为1~5 nm,Ru/CNT 上的Ru 颗粒直径在5~25 nm。0.025-Ruc/CNT的Ru颗粒在CNT上的分散性较Ru/CNT更好,且负载位点更多。图6(c)中0.025-Ruc/CNT的EDX能谱进一步证明0.025-Ruc/CNT上的亮点为Ru颗粒。

图6 0.025-Ruc/CNT 及Ru/CNT的TEM图像Fig.6 TEM images of 0.025-Ruc/CNT and Ru/CNT
2.2 电化学测试
2.2.1 线性扫描测试
LSV 曲线如图7(a)所示,碳纸负载的0.025-Ruc/CNT 通入N2时的电流密度大于通入Ar 时的电流密度,表明在通入N2时0.025-Ruc/CNT上发生了N2参与的电催化还原反应,产生了额外的电流。0.025-Ruc/CNT 的LSV 电流密度从-0.05 V (vs.RHE)处开始增大,在低于-0.35 V (vs. RHE)后,电流密度波动较大,可能由于发生了较为剧烈的析氢反应,对电极表面产生影响。
对比图7(b)中0.010-Ruc/CNT、0.015-Ruc/CNT、0.025-Ruc/CNT 及0.050-Ruc/CNT 在 通 入N2时 的LSV 曲线可以看出,Ru 负载量从1.0%、1.5%到2.5%,LSV 电流密度随着Ru 负载量增大而增大。再继续将负载量增加至5.0%,电流密度与负载量为2.5%时相差无几,表明此时活性位点数目不再随着Ru负载量的增大而增多。
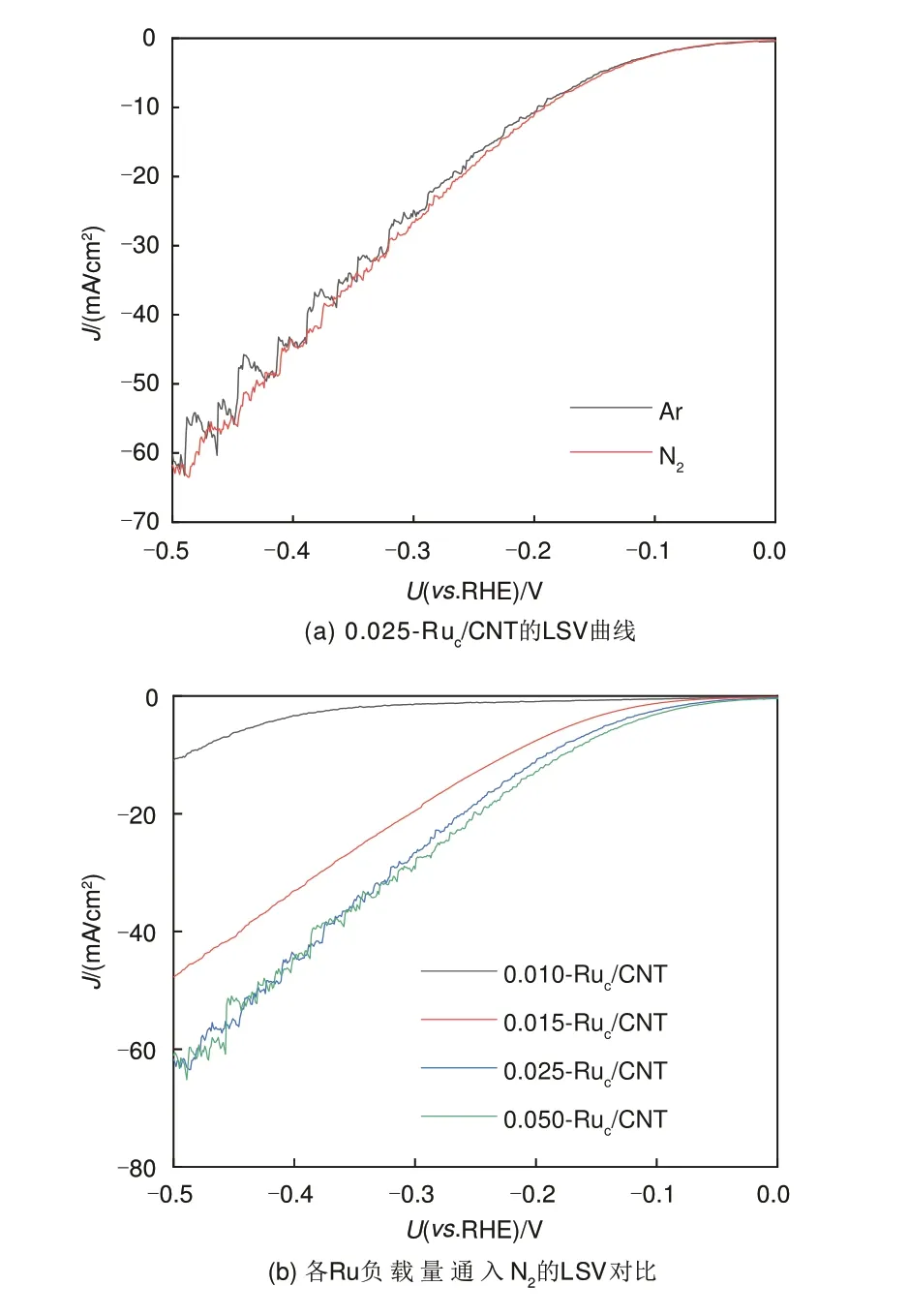
图7 Ruc/CNT上不同Ru负载量的线性扫描曲线Fig.7 LSV curve of different Ru loading on Ruc/CNT
2.2.2 电化学氮气还原测试
Ruc/CNT 的ENRR 反应结果如图8(a)所示,Ruc/CNT 在-0.10 V(vs. RHE)电位下反应得到最高的氨产率。其中,Ru 负载量为2.5%的0.025-Ruc/CNT 在-0.10 V(vs. RHE)下得到10.98 μg/(h·mgcat.)的氨产率及2.18%的法拉第效率。随着电位进一步降低,加剧的竞争性HER 抑制了ENRR,从而使得各催化剂氨产率降低。
Ru负载量会影响Ruc/CNT的ENRR催化性能,并存在最优范围。这与Rossettii 等人[31]得出的结论一致。Ruc/CNT 上较低的Ru 负载量由于金属颗粒较小或者活性位点较少对ENRR 催化较弱。当Ruc/CNT 上Ru 负载量超过一定值以后,由于碳纳米管上能够负载Ru的负载位点有限,更高的Ru负载量可能会使得Ru颗粒团聚。
图8(b)、(c)对比了Ru/CNT 和0.025-Ruc/CNT的氨产率及法拉第效率。相比于普通回流法还原的Ru/CNT 催 化 的5.19 μg/(h·mgcat.)的 氨 产 率 及0.05%的法拉第效率,胶体溶液制备的Ru 颗粒负载的0.025-Ruc/CNT能够实现更高的氨产率及法拉第效率。

图8 催化剂各电压下的氨产率及法拉第效率Fig.8 Ammonia yield and Faraday efficiency of the catalyst at different potentials
CNT较好的疏水性和高比表面积也可能会提升Ruc/CNT的ENRR催化性能。采用接触角测试表征CNT的疏水性如图9所示,CNT与水的接触角达到119.2°,表明CNT 具有一定的疏水性能。由于H+在水溶液中是以水合形式存在的,疏水的CNT 载体对水的排斥作用能够抑制Ruc/CNT表面与水的接触,减少H+在Ruc/CNT 上的吸附,从而起到抑制竞争性的HER的效果,提高催化剂的法拉第效率。此外,根据CNT的生产厂家穗衡科技提供的一些性能参数如BET测试结果,其比表面积约为231.86 m2/g,电阻率为8×10-4Ω·m,可见CNT的比表面积较大,电阻率较小,从而可为Ru 纳米颗粒提供更多的负载位点,以实现更快速的电子转移,提高ENRR的反应速率和氨产率。

图9 CNT与水的接触角Fig.9 Contact angle of CNTs with water
表1 对比了0.025-Ruc/CNT 与其他类型的催化剂的氨产率及法拉第效率。0.025-Ruc/CNT 相比于Ru NPs在一定程度上提高了氨产率及法拉第效率,说明疏水碳纳米管能够抑制HER 且其较高的比表面积有利于提高活性Ru纳米颗粒的负载量。另外,相比于其他非金属及金属氧化物催化剂,如氮掺杂的多孔碳、二维硼、Fe2(MoO4)3、Ce1/3NbO3以及掺杂LaFeO3的钙钛矿,0.025-Ruc/CNT 也表现出了更高的氨产率,体现了贵金属催化剂在ENRR催化中更高的催化活性。综上,Ru 纳米颗粒化及疏水碳纳米管载体的应用能够提高0.025-Ruc/CNT 对ENRR的催化性能。

表1 各催化剂电化学合成氨的氨产率及法拉第效率Table 1 Ammonia yield and Faradaic efficiency of catalysts for electrochemical ammonia synthesis
此外,对ENRR 过程中可能存在的副产物N2H4进行了检测,各电位下均没有检测到N2H4,由此可见无副产物产出。
以上结果表明,减小Ru 颗粒对ENRR 的选择性具有促进作用。推测小粒径的Ru 颗粒会表现出高度自旋状态[26],高自旋状态下Ru纳米颗粒上的正电荷分布有利于N2吸附。因此,随着0.025-Ruc/CNT上Ru颗粒的减小,实现最高氨产率电压由Ru/CNT的-0.25 V(vs.RHE)降低至-0.10 V(vs.RHE)。而在碳纳米管负载Ru 纳米颗粒位点数目一定的情况下,Ru 完全占据负载位点后,随着Ru 负载量增多,载体上的Ru 颗粒团聚增大,小团簇带来的优势减弱,催化性能下降。在1.0%、1.5%、2.5%及5.0%的Ru负载量中,2.5%的Ru负载量表现出最佳ENRR催化性能。
除了选择性,催化剂的稳定性也是重要的性能评价指标之一。对0.025-Ruc/CNT 在-0.10 V (vs.RHE)电位下进行循环稳定性测试及长时间稳定性测试。图10(a)中循环稳定性测试结果显示,0.025-Ruc/CNT 在-0.10 V (vs. RHE)下的循环催化性能较为稳定。长时间稳定性测试结果如图10(b)所示,图中的J-t曲线显示电流密度在反应过程中有略微上升。图10(c)对比了0.025-Ruc/CNT 在12 h 测试前后的性能,其氨产率及法拉第效率均有一定程度的降低。0.025-Ruc/CNT 性能下降的原因可能是长时间催化导致的活性位点中毒及活性位点数目降低。

图10 0.025-Ruc/CNT稳定性测试及氨来源测试结果Fig.10 Stability test and ammonia source inspection of 0.025-Ruc/CNT
为了证明氨来源于Ru 纳米颗粒催化的ENRR过程,分别进行了只通入2 h 30 min N2,通入Ar在-0.10 V(vs.RHE)下反应,以及碳纸负载的经过12 h搅拌过滤处理的CNT在通入N2时-0.10 V (vs.RHE)下反应的测试。结果如图10(d)所示,仅当催化剂为0.025-Ruc/CNT 时,通入N2并施加-0.10 V(vs.RHE)的电位有明显的氨产出。由此可见,氨主要来源于ENRR 过程,Ru 纳米颗粒是ENRR催化过程中的主要活性位点。
3 结 论
(1)为了提高钌对电化学合成氨的选择性,本工作通过胶体溶液制备Ru纳米颗粒并将其负载至碳纳米管上得到Ruc/CNT,在常温常压条件下实现了碳纳米管负载Ru纳米颗粒Ruc/CNT的电催化合成氨。其中,0.025-Ruc/CNT 实现了最高10.89 μg/(h·mgcat.)的氨产率及2.18%的法拉第效率;
(2)Ru 纳米颗粒能够促进Ru 与N2间电子转移,增强Ru 与N2的吸附,提高Ru 对ENRR 的选择性。同时,CNT 载体的应用使得Ru 纳米颗粒具有更高的分散性,暴露出更多的活性位点,抑制竞争性HER,从而更利于提升ENRR催化性能;
(3)本工作提出了一种简便的金属纳米颗粒催化剂的制备方法。该方法还可用于制备其他载体负载的金属纳米颗粒催化剂。所制备的纳米颗粒化催化剂可在一定程度上提高其ENRR的选择性,为类似的电化学还原体系提供了一种催化剂开发的思路,通过金属纳米颗粒催化剂与载体的结合,提高催化剂对N2还原、CO2还原、O2还原等的选择性。

