硅基负极与电解液化学反应的分析与抑制策略
于春辉,何姿颖,张晨曦,林贤清,肖哲熙,魏 飞
(清华大学化工系,北京绿色化学反应工程与技术重点实验室, 北京100084)
随着锂离子电池在电动汽车、智能电网等场景的使用,人们对锂离子电池的能量密度提出了更高的要求[1-2]。目前的材料体系(正极为层状过渡金属氧化物,负极为石墨[3])已经逐渐达到其理论能量密度的天花板[4]。为进一步提高电池的能量密度,就需要对现有的电池材料体系进行改变[5]。硅作为锂离子电池负极材料,具有最高的理论能量密度,可以有效提高全电池的能量密度。因此,硅基负极近年来也成为了人们研究的一个热点。然而,硅基负极材料较差的循环稳定性严重阻碍其实际应用进程。一般认为硅较差的循环稳定性来源于充放电过程中的体积大幅膨胀。研究者们通过纳米化与结构设计来抑制硅颗粒的破碎[6],通过硅表面的改性来稳定硅基材料在充放电过程中的循环稳定性[7]。上述策略忽略了硅基材料与电解液之间的本征化学反应对循环稳定性的影响[8]。在有机硅领域,硅在铜催化剂的条件下可发生如下化学反应
Si + 2CH3Cl=== ===== (CH3)2SiCl2
即经典的罗乔反应(rochow reaction),该反应的活化能约为90 kJ/mol 在较为缓和的条件下即可发生[9]。对于锂离子电池体系,铜作为负极集流体,电解液中含有碳酸酯类溶剂和含有卤素的LiPF6,当氟元素取代氯之后,反应的活化能会进一步降低。因此,在电池体系里罗乔反应发生的条件都具备,因此硅可与电解液发生化学反应。本文综述了清华大学魏飞课题组近年来针对硅负极材料与电解液化学反应的系列工作,并提出了通过引入陶瓷层作为人造SEI来抑制上述化学反应的策略。
1 硅基负极与电解液本征化学反应的研究
1.1 非法拉第过程硅基负极与电解液化学反应
硅基负极与电解液在充放电过程中,既受法拉第过程锂离子脱嵌的影响,同时硅基负极材料也与电解液发生化学反应。为了排除电化学反应的影响,如图1(a)所示,基于高压反应釜与质谱联用并通过变温方法对硅基负极与电解质本征化学反应进行分析[10]。值得强调的是,为了防止电解液的分解,严格控制反应温度低于LiPF6的分解温度200 ℃[11-13]。
为了排除电解液的影响,首先将50 mL的电解液(1 mol/L LiPF6,溶剂为EC∶DEC∶EMC=2∶1∶2)密封于高压反应釜内,反应5 h 之后,将反应产生的气体通入质谱中检测其气相组分。如图1(b)所示质谱数据可知,电解液溶剂受热会发生分解产生CH4、CO2、H2等气体。上述气体主要来源于有机酯类的分解。与此相对应,将硅粉浸入到相同电解液中,在相同的反应条件下进行反应并进行质谱分析。结果发现,除了电解液溶剂分解产生的CH4、CO2、H2等气体之外,也出现了新的气体PF3。由反应的元素平衡可知,PF3只能来源于LiPF6,说明硅粉可与LiPF6发生化学反应生成气相PF3,且其可视为定量分析Si 与电解质溶液化学反应深度的指标。如图1(d)所示,反应后的固体材料XRD 结果可看出硅粉中出现了新相Li2SiF6,同样说明硅基负极与电解液LiPF6发生了化学反应。如图1(e)的XPS所示,硅基负极与电解液在界面处反应出现了Si—F键,与上述XRD的结果相吻合。如图1(f)、(g)所示,硅基负极与电解液反应前后的TEM 对比可看出反应之后出现了大的团聚体;如图1(h)所示,EDS Mapping 结果说明在硅粉界面出现了氟的聚集体,这与上述XRD和XPS的测量结果一致。
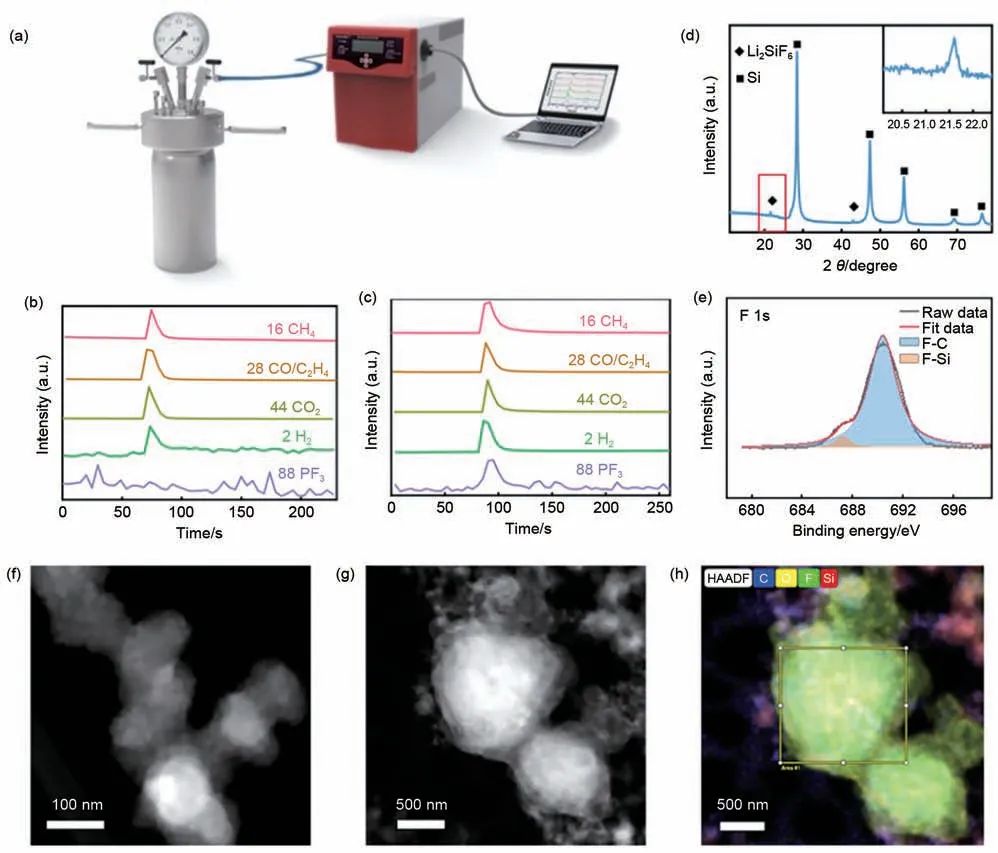
图1 硅基负极与电解液化学反应的探究。(a)高压釜--质谱联用的研究装置;(b)单一电解液反应后的质谱结果;(c)硅与电解液反应后的质谱结果;(d)硅与电解液反应之后固相XRD结果;(e)硅与电解液反应之后固相XPS结果;Si@C与电解液反应前(f)后(g)TEM照片以及反应后的EDS Mapping(h)Fig.1 Study of the chemical reaction.(a)Illustration of the experiment;(b)and(c)MS results of the electrolyte and Si after the reaction,respectively;(d)XRD data of Si after the reaction;(e)F1s spectrum results for Si@C after the reaction;TEM image of Si@C before(f)and after(g)reaction;(h)EDS Mapping of Si@C after reaction
结合上述气相与固体颗粒相的分析结果可得出如下的反应方程式
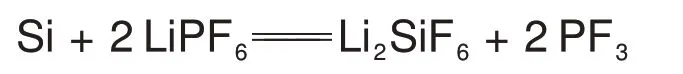
因此,基于上述测量结果可证明硅与电解液中的溶质LiPF6发生化学反应。由于硅基负极颗粒在电解质溶液中以固相存在,所以该液固多相反应主要发生在电解液中的LiPF6以离子形式与硅基负极的界面处。由于硅基负极材料与电解液的反应也会有损于硅基负极的循环稳定性,且为有别于电化学条件下脱嵌锂行为对硅基负极稳定性的影响,这里定义硅基负极与电解液的反应为“副反应”。
1.2 Si@C与电解液的副反应
由于硅基负极材料的导电性较差,在正常的充放电过程中通常使用碳包覆以增加其导电性。在正常的充放电循环过程中,硅基材料表面会生成SEI;一般认为其是能够阻止硅和电解液接触,然而如图2所示在硅表面包覆上碳层之后副反应仍会发生且变温实验显示反应更容易发生,表观活化能从77 kJ/mol 下降至39 kJ/mol 说明碳是该副反应的催化剂,包碳不仅无法阻止硅与电解液的副反应,反而会加快该副反应的过程[14]。因此,硅和LiPF6的反应主要是由于F 离子能够自由地渗入到SEI层和碳层导致的。要想阻止副反应的发生,需要有效地抑制氟离子与硅的接触。

图2 Si@C与Si副反应活化能对比Fig.2 The activation energy for the reactions of Si and Si@SiC with LiPF6
1.3 电化学体系副反应的贡献
在实际的电化学体系下,副反应占比是一个重要指标。通过上述对副反应的分析可知,只要硅与电解液接触,副反应就会持续发生,且其反应深度是时间的函数。在实际电化学过程中,若维持电极的电势不变,电化学反应就不会发生,可视为仅存在硅负极与电解液的副反应。因此,可基于静置实验来验证副反应在实际的电化学体系里对循环稳定性的贡献即:在每完成一次充放电之后,增加10 h的静置时间,并对比分析静置和非静置实验的结果。这里以0.2 A/g 的电流密度进行活化并以活化之后的容量对0.5 A/g的电流密度下的容量进行归一化。
如图3(a)所示,相同的循环圈数情况下静置实验的容量保持率会低于正常条件下进行测试的容量保持率。这一方面说明在实际的电化学反应过程中会伴随着副反应的发生,另一方面也说明副反应会随着时间的增加而不断发生。进一步地,通过对不同循环圈数之后副反应所占的比例进行分析:副反应所占的比例由第5 圈的87.7%到25 圈之后的49.6%。这是因为在电化学反应初期,电池的硅负极需先与电解液充分浸润,此阶段会使得硅负极与电解液的化学反应非常剧烈。综上所述,副反应所占的比例是显著的,在实际的电池体系下不能被忽略。如图3(c)所示,将电池测试所用的时间与容量保持率作图,可以看出容量保持率与时间呈线性关系。对于正常测试的电池,在相同的时间之后其容量保持率是和加了静置时间进行测试的电池的容量保持率是一致的。而我们的研究是以小电流进行活化之后进行的,电极表面已经形成了比较稳定的SEI,这一结果也说明电化学过程中SEI 并不能阻碍副反应的发生,即SEI 不能阻止氟离子的渗入。这也进一步说明副反应在实际的电池体系里是不可忽略的,因此在接下来的研究中我们主要抑制副反应来提高电池的循环稳定性。

图3 副反应在实际电化学过程中所占的比例探究。(a)循环性能测试;(b)副反应所占比例;(c)容量保持率随时间变化Fig.3 The proportion of side reaction in actual electrochemical process.(a)Cycling performance test;(b)The proportion of side reaction;(c)Capacity retention rate changing with time
2 硅基负极副反应抑制策略
为了提升硅基负极的循环稳定性,需要对副反应加以抑制,这样才能在进一步提高硅含量的同时,提高硅基材料的循环稳定性。常用的思路是在硅基材料表面包覆一层保护层,以期望能够达到隔绝硅负极和电解液的目的。同时也考虑到对于一个电池体系,在抑制氟离子渗入的同时,也不能影响锂离子和电子的传输,以保证正常的电化学过程。通过上一节的分析可知,在硅基材料表面引入一层保护层,其需要满足以下条件:①保护层能够阻止氟离子的渗入,避免与硅的直接接触;②保护层有足够高的锂离子导率和电子导率。保护层如若满足以上两个条件,则其具备了离子选择性透过层的特性,即Li+可自由导通但F-会被显著抑制。
2.1 氮化钛陶瓷层对副反应的抑制
钛基材料是良好的人造牙齿的材料,口腔中的氟会对钛基底进行腐蚀,进而减少人造牙齿的使用寿命[15-19]。为了对钛基材料进行保护,领域内常使用在钛基材料的表面引入一层氮化钛薄膜,其能够有效抑制氟元素对钛基材料的腐蚀,进而保护人造牙齿[17,20-21]。因此,我们选择氮化钛层作为硅基材料的保护层用以阻止氟离子渗入;氮化钛既可有效抑制副反应,又是导电性良好的材料,可促进电子的传输。
首先将一定量的硅粉均匀地分散在无水乙醇溶液中,由于原料是纳米级的硅粉,普通的搅拌很难保证硅粉能够充分分散开,因此,我们采用超声分散的方式在超声波发生器里分散5 h,以使得硅粉颗粒能够尽可能地均匀分散。接下来加入适量的去离子水和氨水,使得溶液里有适当的水分,达到最优的水解条件。再接下来通过注射泵,逐滴滴加一定量的异丙醇钛到溶液里。保证混合均匀后再升温至80 ℃进行水解反应。反应结束之后通过抽滤的方式得到所需要的固体粉末。在抽滤的过程中应当注意使用无水乙醇进行清洗,如若使用去离子水,会导致残余的异丙醇钛与水发生水解作用,生成大量的白色的TiO2,进而不能保证材料的均匀性。最终得到的固体粉末依然是棕色,则说明固体颗粒得到了充分的清洗同时二氧化钛的包覆也比较均匀。得到Si@TiO2颗粒之后,将一定量的颗粒均匀地盛放在石英舟里,然后放入到管式炉里。管式炉在进行升温之前,先通入1 h Ar以尽可能排除管内的空气,接着以10 ℃/min 的升温速率升到850 ℃,保持炉内Ar 的氛围。达到反应温度之后,再将Ar 切换成NH3,充分反应3 h 得到最终的产品Si@TiN。同时应该注意,尾气出来的氨气要进行处理。对于少量的氨气,可以通过接入气洗瓶的方式来进行处理。
氮化钛层引入到硅表面之后,首先对其副反应情况进行探究。如图5(a)的质谱结果可知,包覆上氮化钛之后,PF3的峰基本消失,不能看到明显的峰。进一步地,反应后固体粉末XPS 表征分析,通过F1s 结果可以看出,并没有看到Si—F 键形成,与Si@C反应之后的结果形成鲜明对比,说明硅负极与电解液的副反应被显著抑制。
氮化钛在实际电化学条件下对副反应的抑制情况也通过静置的循环测试进行表征分析。在进行了相同的静置实验之后,其循环测试如图4(d)所示,与正常的测试相比,静置测试的电池在每完成一次充放电循环之后增加10 h 的静置时间。其结果表明,两种模式下的容量保持率的差别远远小于图3所示Si@C的差别。通过不同循环圈数之后副反应所占的比例进行分析可以看出,硅表面引入氮化钛之后,在前5 圈其副反应所占的比例由原来的87.7%下降到47.7%,循环20 圈之后副反应所占的比例9%,而Si@C 副反应所占的比例仍占49.6%以上。说明氮化钛的引入确实可以有效抑制氟离子的渗入,进而抑制副反应的发生。
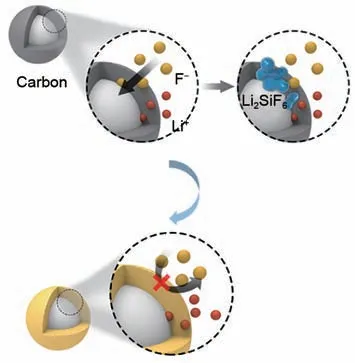
图4 硅基负极抑制副反应策略示意图Fig.4 Illustration of suppressing the side reaction
通常额外的包覆层会增加传质阻力,为了研究陶瓷层对锂离子扩散的影响,测试了不同循环圈数之后的半电池的电化学阻抗谱(EIS),通过EIS可以看出循环前后锂离子扩散阻力大小的变化。两个材料都表现出了典型的EIS阻抗信号,在中高频区能奎斯特图为半圆,在低频区为直线。对应的在中高频区主要反映锂离子扩散的阻力,半圆直径代表了阻力的大小。通过图5(a)可以看出,5 圈和100 圈之后,Si@C的半圆直径变化非常大,说明在这两个状态下锂离子扩散的阻力变化非常大。与之相比,Si@TiN 在两个状态下的直径是基本接近的,而且值比较小,说明锂离子的扩散阻力是比较小的,引入保护层之后锂离子扩散系数得到了稳定。进一步地,可以利用低频区的数据计算出锂离子扩散系数,虽然在纽扣里进行测试,锂离子扩散系数的准确性有待考验,但是针对同一个样品,在经历过不同循环圈数之后的变化还是可以得到准确信息的。通过结果对比可以看出,初始阶段,Si@C和Si@TiN 具有相似的锂离子扩散系数。但是随着循环圈数的增加,Si@C 的锂离子扩散系数急速降低,说明在充放电的过程中不断生成的SEI阻碍了锂离子的扩散。而对于Si@TiN,在循环100 圈之后,其锂离子扩散系数基本保持不变,说明在这一过程中,Si@TiN 表面的SEI 是稳定的。以上结果进一步证明了氮化钛作为保护层对副反应的抑制,同时不影响锂离子的传输,维持锂离子扩散阻力基本不变的特性。这与自然形成的SEI 有本质不同,由于自然形成的SEI不能阻止副反应,同时又造成了对锂离子扩散阻力数量级的提高,是造成硅负极循环稳定性下降的核心。而一层陶瓷层选择性的透过膜不仅可以让锂离子正常通过,也会阻挡F离子发生的副反应。
图5 Si@TiN对副反应的抑制情况。(a)反应质谱结果;(b)XPS表征;(c)不同循环圈数后容量保持率对比;(d)副反应所占比例对比Fig.5 Inhibition of side reaction for Si@TiN.(a)MS results;(b)XPS results;(c)Capacity rate with different cycles;(d)Proportion of side reaction
对电极的完整形貌做了表征,以探究副反应对于电极的膨胀所产生的影响。图7(a)~(h)反映了不同极片反应前后的变化。对于两种电极,在反应之前,其表面都是相对光滑、致密的。但是循环5圈之后,其电极的形貌发生了不一样的变化。对于Si@C,循环之后出现了巨大的裂纹,同时电极的厚度由初始的25 μm增长到40 μm,其体积膨胀率变化了80%。而对于Si@TiN,其电极表面相对还是比较光滑的,裂纹也基本上没有,电极的厚度由初始的23 μm 变为25 μm,体积膨胀率为8.7%。在循环后的测试中,所有的极片都是在完全充满电的状态下进行表征的,所以由于嵌锂导致的体积膨胀在这里是可以忽略的。通过以上分析可以看出,不断生成的SEI是电极膨胀的主要原因。这一结果与前面通过HRTEM 观测到的SEI 的厚度变化是相吻合的。上述结果表明,副反应也会引起电极的体积变化。引入选择性包覆层是防止副反应、稳定SEI和阳极膨胀的有效策略。
为了对SEI进行详尽的表征,循环后的极片也做了XPS 测试。通过图7(i)、(k)的结果可以看出,对于Si@C,其表面SEI在循环5圈和100圈之后,其各组分变化很大,各个组分用柱状图来表示,可以看出ROCO2Li、Li2CO3、LiF 三个组分的差别是比较大的。而与之对应的Si@TiN,其在循环5 圈和100圈之后,各个组分的含量是基本稳定的,说明电极表面的SEI也是比较稳定的。

图7 Si@C和Si@TiN循环前后对比。(a)Si@C循环之前的SEM;(b)Si@C循环前的截面图;(c)Si@C循环5圈之后的SEM;(d)Si@C循环5圈之后的截面图;(e)Si@TiN循环之前的SEM;(f)Si@TiN 循环前的截面图;(g)Si@TiN循环5圈之后的SEM;(h)Si@TiN循环5圈之后的截面图;(i)Si@C循环5圈后100圈后的XPS结果对比;(g)Si@TiN循环5圈后100圈后的XPS结果对比;(k)Si@C循环5圈后100圈后的各组分结果对比;(l)Si@TiN循环5圈后100圈后的各组分结果对比Fig.7 The Comparison of Si@C and Si@TiN after different cycles.(a)SEM image of fresh Si@C;(b)SEM image of Si@C after 5 cycles;(c)Top-view SEM image of fresh Si@C;(d)Top-view SEM image of Si@C after 5 cycles;(e)SEM image of fresh Si@TiN;(f)SEM image of Si@TiN after 5 cycles;(g)Top-view SEM image of fresh Si@TiN;(h)Top-view SEM image of Si@C after 5 cycles;(i)XPS data of Si@C after different cycles;(j)XPS data of Si@TiN after different cycles;(k)Relative percentage of different components for Si@C;(l)Relative percentage of different components for Si@TiN
但是材料在前期的循环过程中,容量会有一个急速衰减的过程,进而使得材料在前期循环过程中容量下降得很快,这使得材料不能满足实用的要求。在这里我们对循环前后的材料做详细的TEM表征。通过HAADF 结果可以看出,在循环之前氮化钛均匀地包覆在硅表面,但是在循环之后硅表面的TiN层发生了破碎,包覆状态变得不完整,进而会导致有一部分的硅失效。因此,这一部分的失效,可能的原因是利用液相方法进行包覆,很难保证包覆层的缺陷,硅基材料在循环过程中的巨大的体积膨胀容易将包覆层撑破,进而使得材料的容量在前期出现一个快速衰减的过程。

图6 Si@C与Si@TiN循环前后电化学阻抗谱对比。(a)Si@C不同循环圈数的EIS对比;(b)Si@TiN不同循环圈数的EIS对比;(c)Si@C与Si@TiN不同循环圈数之后锂离子扩散系数对比Fig.6 EIS results of different cycles.(a)EIS data of Si@C after different cycles;(b)EIS data of Si@C after different cycles;(c)Comparison of diffusion coefficients of lithium ions
2.2 碳化硅陶瓷层对副反应的抑制
引入选择性透过层确实可以有效抑制副反应的发生,进而提高材料的循环稳定性。但是也注意到,由于硅基负极在嵌锂过程中会有巨大的体积膨胀,引入的氮化钛层会遭到破坏进而导致材料在前期的循环过程中有一个容量快速衰减的过程,其主要原因是氮化钛的强度不够导致的。为了进一步提高材料的循环稳定性,需要对选择性透过层进行进一步的改进。
由于硅在充放电过程中有巨大的体积膨胀,进而会导致强大的应力发生,因此如果要避免材料的破碎,一个有效的方法是在硅基材料表面引入一层强度足够的保护层,这里材质的选择就成为了关键。在核反应堆里,由于核燃料在反应过程中会生成有放射性的氡气,在实际的应用中,在核燃料的表面包覆一层致密的碳化硅层,其示意图如图9(a)所示[22],其可以有效地抑制住放射性气体的溢出。另一方面,反应之后,由于有放射性气体的产生,在核燃料的内部,其也会有强大的压力。一般的材料很难保证包覆的稳定性[22-25],但是碳化硅陶瓷能够在实际的过程中保持结构的完整性,说明其强度也是非常优异的。基于以上分析,我们现有的硅体系与核反应堆是相类似的,在反应过程中也会有剧烈的压力产生。因此我们可以选择将碳化硅作为保护层来抑制硅基负极在循环过程中的破碎。
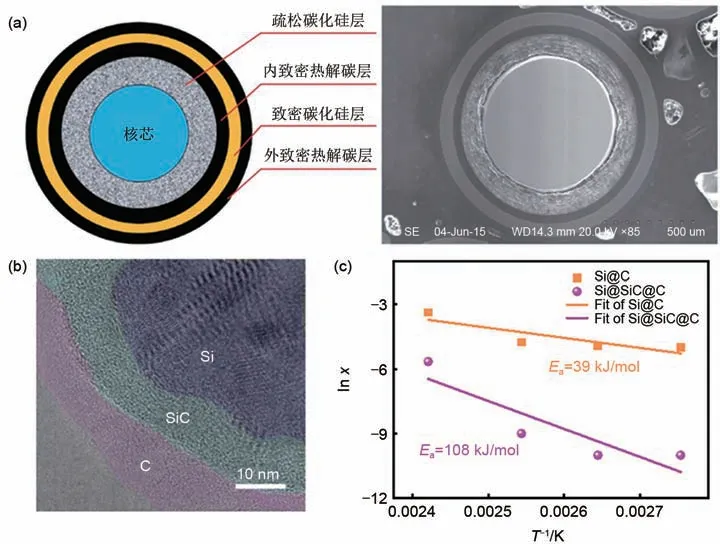
图9 碳化硅陶瓷层对副反应的抑制。(a)碳化硅陶瓷层在核反应堆中的应用[22];(b)Si@Si@C TEM;(c)Si@SiC@C和Si@C反应活化能对比Fig.9 Inhibition of side reaction by silicon carbide ceramic layer.(a)The application of SiC in nuclear reactor[22];(b)The TEM image of Si@SiC@C;(c)The activation energy for the reactions
首先将一定量的硅粉放置于石英舟里,均匀铺开,然后将其置于管式炉内。接下来先通入惰性气体Ar 1 h 尽可能排空里面的空气,然后再以10 ℃/min的升温速率升温至850 ℃,将气体由惰性气氛转变为含有乙烯的气源,反应一定时间之后切换到惰性气体并自然降温,得到Si@C材料。在实验的过程中,可以通过控制碳源的流量和反应时间,控制碳的含量。为了得到碳化硅,将得到的Si@C材料置于刚玉坩埚里,然后在惰性的气氛下,1300 ℃反应20 min,然后再自然降温便得到Si@SiC。由于反应是高温反应,在高温下对水很敏感,因此需要在反应之前将刚玉坩埚先以相同的程序空烧一次,去除坩埚表面吸附的水和氧,然后再进行碳化反应。
通过化学气相沉积法在硅表面引入了碳化硅陶瓷层,为了进一步提高材料的导电性,又设计在最外层引入了碳层。在成功制备Si@SiC@C之后,通过对副反应的活化能进行测量,发现引入碳化硅之后,反应的活化能由39 kJ/mol提高到108 kJ/mol,对应地可以算出反应速率降低为原来的1/300。
接下来我们对材料在充放电过程中的结构稳定性进行了测试,为了实时观测材料的结构变化,我们进行了原位的电化学实验,模拟其在实际电化学体系时的状态变化。图10 展示了材料在充放电过程中的结构变化,在前30 s进行放电测试,对应着锂离子的进入,后续过程进行充电过程,对应着锂离子的脱出。通过不同时刻的结果可以看出,在充放电的过程中Si@SiC@C 的形貌结构维持稳定,并没有发生破裂的现象。原位实验的结果表明,硅表面包覆上碳化硅之后,确实可以有效地抑制材料的破裂。
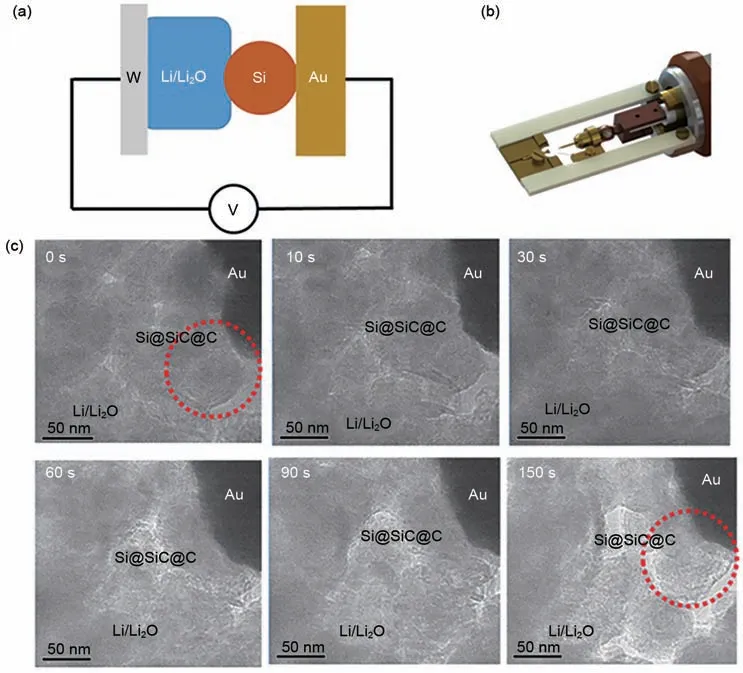
图10 原位电化学实验结果。(a)原位电化学装置示意图;(b)原位电化学装置照片;(c)不同时间下原位电镜结果Fig.10 In-situ TEM results.(a)The model of in-situ TEM sample holder;(b)Digital photo of in-situ TEM sample holder;(c)In-situ results
为了进一步证明碳化硅包覆层的选择性透过层的作用,我们对循环20 圈后的Si@SiC@C 做了EELS 元素分布,与EDS Mapping 相比,EELS 可以检测到Li 的分布,进而可以通过Li、F 的元素分布来证明碳化硅层的作用。通过图8(a)可以看出,循环之后的Si@SiC@C 的形貌是维持稳定的。对应的Li 和F 的元素分布则表明,F 元素主要分布在材料的表面,Li元素在材料的内部和外部都能检测到。这一结果表明,碳化硅层确实起到了选择性透过层的作用,其有效地抑制住了氟离子的渗入,进而可以抑制副反应的发生。同时碳化硅层也不影响锂离子的传输,从而可以保证锂离子正常的嵌入和脱出。

图8 TiN层的不足。(a)Si@TiN电化学性能;Si@TiN循环前(b)后(c)TEMFig.8 The shortage of TiN layer.(a)The cycling performance of Si@TiN;the TEM image of Si@TiN before(b)and after(c)cycles
受益于碳化硅陶瓷层超高强度以及对Li+/F-的选择通透性,其倍率性能非常优异,在5 A/g 的高电流密度下,其容量依然能够维持在1000 mAh/g,当电流密度恢复到1 A/g 时,其容量也能够恢复到1800 mAh/g 左右。最后在1 A/g 的电流密度下,Si@SiC@C 在循环900 圈的超长循环之后,容量还可维持在950 mAh/g 左右。Si@SiC@C 优异的循环稳定性,表明碳化硅层在电化学过程中维持材料结构稳定,抑制副反应方面发挥重要作用。

图11 碳化硅陶瓷层对循环性能的改进。(a)~(c)Si@SiC@C循环20圈的HAADF照片以及对应的Li、F EELSE Mapping;(d)Si@SiC@C倍率性能测试;(e)1 A/g电流密度下的循环性能测试Fig.11 The enhancement of SiC layer for cycling performance.(a)-(c)HAADF image and corresponding Li,F EELS Mapping after 20 cycles;(d)The rate performance of Si@SiC@C;(e)The cycling performance of Si@SiC@C at alarge current of 1 A/g
3 结 论
硅基负极材料由于其具有高的理论能量密度,丰富的储量和合适的充放电平台,被认为是取代目前的石墨材料的最具有优势的负极材料。但是其较差的循环稳定性阻碍了其实用化进程。目前的改进策略主要是从电化学的角度进行出发,忽略了硅与电解液之间本征的化学反应。本综述主要从硅与电解液之间本征的化学反应出发,阐述了影响硅基负极界面稳定性的本征化学反应,并对其进行深入研究,进而提出了陶瓷层包覆形成人造SEI层抑制副反应的策略,以提高硅基负极的循环稳定性,希望能够促进高性能硅基负极材料的商业化。

