鸡软骨细胞体外分离培养鉴定以及过表达miR-15a对软骨细胞的影响
张真真,李建增,蒋瑞瑞,2,马岩超,蔡春霞,张露洁,郭玉洁,吉进卿,韩 露,田亚东,2,康相涛,2,韩瑞丽,2*
(1.河南农业大学动物科技学院,郑州 450002; 2.河南省家禽种质资源创新与利用重点实验室,郑州 450002; 3.河南省畜牧总站,郑州 450008)
肉鸡腿病问题一直是现代化养殖行业无法规避的话题。肢体内外翻畸形(valgus-varus deformity, VVD)是一种长骨畸形病,以胫跗骨和跗趾骨发生一定角度的翻转为特征。患病肉鸡跛行难以接近饮食和水,严重的会导致死亡。VVD发病原因至今尚未阐明,前期研究发现,VVD肉鸡的腿部骨骼存在软骨细胞矿化障碍或延迟的现象。软骨内成骨是骨生成的两种方式之一,而长骨的成骨方式主要是软骨内成骨。因此,体外分离培养软骨细胞对研究VVD的发生具有十分重要的意义。软骨细胞是软骨组织中唯一的细胞,周围被胶原蛋白和蛋白聚糖等一些大分子包裹,这些大分子使软骨组织成为半固态,具有较强的抗压性,这导致体外分离软骨细胞存在一定的难度。体外传代培养的软骨细胞容易退变和去分化,随着传代次数的增多软骨细胞形态由多边形向长梭形发展,II型胶原表达情况随着传代次数增多而下降。关节软骨被肌肉、脂肪和结缔组织包裹,在体外分离细胞时如果处理不当,会出现其他杂细胞,比如成纤维细胞。因此,为保证体外分离出的细胞是软骨细胞,需要对其进行鉴定。
miRNA是长度为22 nt的非编码RNA,在转录水平上调控基因表达。已有多项研究表明,miRNA在疾病、生长发育、免疫应答等方面发挥重要作用。有研究显示,miRNA在调节软骨细胞表型中发挥作用,比如抑制miR-138可以维持软骨的稳态,miR-29b可以靶向抑制ColⅡa1表达,导致维持软骨形态的胶原失衡。miR-15a是我们前期对脾测序得到的差异miRNA之一。在人类癌症的研究中发现,miR-15a参与了细胞分化、增殖、成熟、凋亡和血管生成等过程。此外,miR-15a参与NK细胞成熟、T细胞发育、巨噬细胞吞噬等多种免疫过程。在人类膝关节炎的相关研究中发现,与健康骨关节相比,miR-15a在骨关节炎中差异高表达。骨免疫学是2000年由Arron和Choi首次提出用来描述骨骼系统和免疫系统相互作用关系的新概念。最初研究发现,骨免疫学是免疫系统对骨骼系统的影响,像一些经典的免疫调节因子-1β、-6、-7、-、-影响成骨细胞和破骨细胞的生成和活性。后来,研究者发现骨免疫系统不仅仅是免疫系统通过免疫细胞因子来影响骨骼的形成和发育,还发现骨骼系统也反作用于免疫系统。比如研究发现成骨细胞有助于造血干细胞向B淋巴细胞分化。骨免疫学的研究大都集中在破骨细胞、成骨细胞与免疫细胞之间,软骨细胞在骨免疫学中的作用少有报道。有研究表明,-1β诱导软骨细胞凋亡和代谢分解活性增加,进而导致骨关节炎的发生。miR-15a参与免疫应答和骨关节炎的发生都有报道,其对鸡软骨细胞的影响报道较少。为了探究过表达miR-15a对鸡软骨细胞的影响,为后续研究VVD的发病机制以及肉鸡抗病育种提供研究依据。本研究对软骨细胞体外分离培养方法进行了改良,在软骨细胞中过表达miR-15a之后,检测软骨细胞标志基因、成熟分化基因以及炎性因子和凋亡因子的表达量。
1 材料与方法
1.1 试验材料
胎牛血清、双抗(青霉素+链霉素)、高糖培养基(上海逍鹏,中国);II型胶原酶、透明质酸酶、胰蛋白酶、PBS、甲苯胺蓝染液、Lipofectamine 2000(赛默斯,中国);Trizol、反转率试剂盒、PCR试剂盒(南京诺唯赞,中国);CCK8试剂盒(美仑,中国); EDU试剂盒、miR-15a mimic、mimic NC(锐博,广州,中国)。
1.2 组织样样品收集
分离软骨细胞所用材料为3周龄AA肉鸡。本研究所用组织样来自唐山某养殖场随机选取的6只35日龄的哈伯德肉鸡(3只正常3只VVD),颈部放血致死,收集心、肝、软骨、脾、胸腺、胰腺、法氏囊、胸肌、腿肌样品,液氮冷冻后放-80 ℃保存备用。
1.3 鸡软骨细胞体外分离与培养
将鸡颈部放血致死,浸泡在75%的酒精里3 min, 彻底消毒。将鸡腿从股骨关节处完整的从躯体上取下,清理被毛后喷洒75%的酒精放进自封袋中。在超净台靠近酒精灯火焰处从股骨和胫骨的关节处剖开,去除软骨组织周围的脂肪和结缔组织,将软骨组织削成透明薄片,并用含有2%双抗的高糖培养基冲洗3遍。用眼科剪将其充分剪碎(注意保持湿润),加2倍体积的胰蛋白酶,5% CO、37 ℃细胞培养箱消化30 min,每隔15 min再次进行充分剪碎。弃胰蛋白酶,添加软骨组织2倍体积的0.2%的Ⅱ型胶原酶和0.1%透明质酸酶,之后在5% CO、37 ℃细胞培养箱消化8~12 h。加完全培养基终止消化,依次100目、200目细胞筛过滤消化液,将滤液1 500 r·min离心15 min,完全培养基重悬,重复3次离心。将重悬细胞接种在25 cm的细胞培养瓶中,5% CO和37 ℃细胞培养箱中进行培养,每隔48 h换一次培养液。
1.4 鸡软骨细胞鉴定
1.4.1 软骨细胞形态观察及甲苯胺蓝染色 细胞完全贴壁后通过倒置显微镜观察细胞形态。将细胞在放有盖玻片的6孔板中培养至80%时,PBS清洗3次, 加4%的多聚甲醛,4 ℃固定30 min。PBS清洗3次,滴加70%乙醇室温固定20 min。PBS清洗3遍, 滴加0.04%甲苯胺蓝染液室温染色30 min。无水乙醇快速漂洗一次,晾干封片,倒置显微镜观察记录。
1.4.2 软骨细胞标志物检测 软骨细胞可以分泌大量的Ⅱ型胶原和蛋白聚糖,以维持细胞形态。Ⅹ型胶原是肥大化即将钙化的软骨细胞所特有的物质。原代软骨细胞培养至80%~90%时,加Trizol,放-80 ℃保存备用。PCR电泳检测软骨细胞分泌物蛋白聚糖和Ⅱ型胶原,以及软骨细胞肥大化标志物Ⅹ型胶原。PCR引物以及程序参照郭亚苹的研究。
1.5 软骨细胞的传代培养与铺板
当原代细胞培养至融合度为80%~90%时,倒掉旧培养基,PBS清洗两遍,向培养瓶中加入1 mL 0.25%胰蛋白酶消化1 min,向培养瓶中加入2 mL的完全培养基终止消化。所得液体转移至15 mL离心管中,1 000 r·min离心3 min,丢弃上清,完全培养基重悬细胞,按照一定密度,将软骨细胞接种到新的培养瓶或培养板中进行培养。
1.6 软骨细胞转染miR-15a mimics
当培养板中的软骨细胞培养至融合度为50%~60%时,弃去旧培养基,PBS清洗一次,添加双无培养基进行饥饿处理,用Lipofectamine 2000进行miR-15a mimics 和mimics NC转染。转染4~6 h后更换培养基为完全培养基。
1.7 CCK8法检测软骨细胞活力和EDU细胞增殖检测
软骨细胞接种在96孔板中,对F1、F2代软骨细胞每隔12 h进行细胞活力检测。转染miR-15a mimics和mimics NC后的软骨细胞,每隔12 h用CCK8法检测细胞活力。每孔添加10 μL的CCK8,在细胞培养箱中孵育2 h,酶标仪在450 nm波长处检测吸光度值(OD)。在软骨细胞转染miR-15a mimics和mimics NC 36 h后,按照EDU使用说明书进行染色,荧光显微镜对EDU染色细胞成像并计数。
1.8 总RNA提取及cDNA合成
软骨细胞转染miR-15a mimics和mimics NC成功后培养48 h,弃去旧培养基,4 ℃预冷PBS清洗后,添加Trizol放在-80 ℃保存用于RNA提取。收集的组织样和细胞按照RNAiso plus试剂说明书提取RNA。按照反转录试剂盒说明书反转录为cDNA,-20 ℃保存备用。
1.9 实时荧光定量PCR
根据NCBI公布的基因序列进行引物设计,基因引物由尚亚生物技术公司合成,miR-15a和6的引物购自广州锐博,引物序列见表1。PCR反应体系为10 μL,定量PCR程序:95 ℃预变性5 min;94 ℃ 变性30 s,60 ℃退火30 s,72 ℃延伸30 s,进行40个循环。以6为内参,测定miR-15a的表达量。以为内参,测定软骨细胞标志基因Ⅱ型胶原(-2)、蛋白聚糖()、Ⅹ型胶原(-10),软骨发育成熟基因2、9、、9,炎性因子-1β、-6、-8、-10、-、-3以及凋亡因子、、-2的表达量。采用相对定量2法对定量数据进行分析。

表1 引物序列信息
1.10 miR-15a靶基因预测与验证
通过软件预测miR-15a与基因5的结合位点。构建含有结合位点的5基因3′UTR野生型和突变型载体。当细胞达到60%~70%时,共转染miR-15a mimics、mimics NC以及5的野生型和突变型载体,48 h后根据双荧光素酶检测试剂盒(Promega)说明书进行靶向关系验证。
1.11 数据分析
该试验所得数据通过SPSS 24.0进行独立样本检验显著性分析,<0.05表示差异显著,<0.01表示差异极显著。
2 结 果
2.1 软骨细胞体外分离培养观察
通过倒置显微镜观察到未贴壁的细胞为发光圆形,原代软骨细胞接种到培养瓶中3 h开始贴壁,8 h 后75%的细胞贴壁,12 h完全贴壁,贴壁细胞为折光性较强的圆形、四方形或多边形,当原代软骨细胞完全融合后呈铺路石状(图1)。F1、F2、F3代细胞形态多为多边形,F4代软骨细胞形态开始出现梭形和长条状的成纤维样细胞(图2)。
2.2 软骨细胞鉴定与细胞生长曲线
对软骨细胞标志基因进行PCR和凝胶电泳分析,结果如图3A所示,琼脂糖凝胶图显示,II型胶原和蛋白聚糖片段分别为248、155 bp,符合预期,且X型胶原并未显示,说明该细胞具有正常软骨细胞的特性和生理。软骨细胞能够大量分泌粘多糖和蛋白多糖,甲苯胺蓝染液能将酸性粘多糖染成蓝紫色。如图3B所示,细胞核被染成深蓝色,细胞质周围有蓝紫色颗粒物质,说明该细胞大量分泌粘多糖。用CCK8分析法绘制F1、F2代生长曲线,结果如图3C所示,软骨细胞F1代和F2代细胞在96 h之前稳定而快速增殖,96 h后生长速度开始下降。F2代软骨细胞能够快速而稳定增殖,且细胞形态完好,综合考虑选用F2代细胞进行后续试验。

A. 原代软骨细胞培养24 h(100×); B. 原代软骨细胞培养48 h(100×); C. 原代软骨细胞培养72 h(200×)A. Primary chondrocytes were cultured for 24 h(100×); B. Primary chondrocytes were cultured for 48 h(100×); C. Primary chondrocytes were cultured for 72 h(200×)图1 原代软骨细胞倒置显微镜形态观察Fig.1 The morphological observation of the original generation of chondrocytes under inverted microscope

A.F4代软骨细胞培养12 h(100×); B. F4代软骨细胞培养48 h(100×)A. F4 generation chondrocytes were cultured for 12 h(100×); B. F4 generation chondrocytes were cultured for 48 h(100×)图2 F4代软骨细胞倒置显微镜形态观察Fig.2 Morphological observation of F4 generation chondrocytes under inverted microscope

A. PCR扩增电泳图; B. 甲苯胺蓝染色(100×); C. F1、F2代软骨细胞生长曲线A. PCR amplification electrophoresis; B. Toluidine blue staining(100×); C. Growth curve of F1 and F2 generation chondrocytes图3 软骨细胞鉴定和生长曲线Fig.3 Chondrocytes identification and growth curve
2.3 miR-15a组织表达谱
通过荧光定量PCR检测miR-15a在各组织的表达情况。结果如图4所示,miR-15a在各组织都有表达,与健康组相比,miR-15a在VVD组的肝(<0.01)、 脾(<0.05)和胸腺(<0.01)的表达量显著升高,心和胸肌组织中miR-15a的表达量显著下降(<0.01)。
2.4 过表达miR-15a对软骨细胞的影响
软骨细胞过表达miR-15a后检测细胞增殖情况,结果如图5所示。CCK8结果显示,与NC组相比,过表达miR-15a组软骨细胞增殖率显著降低(<0.01,图5A)。EDU结果显示,过表达miR-15a组软骨细胞增殖数量显著下降(<0.01,图5B、C)。qPCR检测软骨细胞标志基因表达量,如图6A所示,过表达组II型胶原、蛋白聚糖、X型胶原表达量都低于NC组,其中蛋白聚糖差异显著(<0.05)。检测软骨成熟分化基因发现2和9基因的表达量mimics组极显著低于NC组(<0.01, 图6B)。与NC组相比,过表达miR-15a组的基因极显著升高(<0.01),极显著降低(<0.01),抗凋亡基因-2表达量极显著降低(<0.01,图6D)。结果提示,过表达miR-15a可以抑制软骨细胞增殖,抑制软骨细胞分泌标志物的能力,抑制软骨细胞成熟和分化,并促进软骨细胞凋亡。

*.差异显著(P<0.05); **.差异极显著(P<0.01);下同*. Significant difference (P<0.05); * *. Extremely significant difference (P<0.01);The same as below图4 miR-15a在不同组织中的相对表达水平Fig.4 Relative expression levels of miR-15a in different tissues

A. CCK8测定细胞增殖; B,C. EDU测定细胞增殖(图C, 100×)A. Cell proliferation was determined by CCK8; B, C. EDU to determine cell proliferation(figure C,100×)图5 miR-15a抑制软骨细胞增殖Fig.5 miR-15a inhibits chondrocytes proliferation
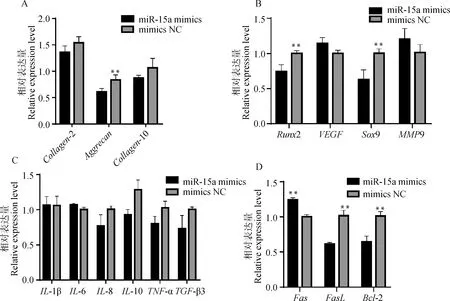
A. 软骨细胞标志基因; B. 成熟分化基因; C. 炎症因子; D. 凋亡因子A. Chondrocyte marker genes; B. Mature differentiated genes; C. Inflammatory cytokines; D. Apoptosis factor图6 软骨细胞转染miR-15a mimics后各基因表达水平Fig.6 Expression level of related genes after miR-15a mimics transfected into chondrocytes
2.5 miR-15a靶基因筛选与验证
通过软件预测到miR-15a的种子区与5的3′UTR有稳定结合位点(图7A)。初步验证两者靶向关系,结果显示(图7B),软骨细胞成功过表达miR-15a后,发现miR-15a表达量显著升高而5表达量显著降低(<0.01)。为进一步验证两者的靶向关系,成功构建了有结合位点的5的3′UTR的野生型(5-WT)和突变型(5-Mut)载体。软骨细胞共转染miR-15a mimics、mimics NC、5野生型质粒、突变型质粒48 h后进行双荧光素酶检测报告。结果显示,miR-15a mimics+5-WT组的荧光活性显著提高,表明miR-15a与5在鸡软骨细胞中没有靶向关系(图7C)。而当过表达miR-15a时,5表达量下降的原因可能是两者之间存在其他调控方式。

A. FKBP5与miR-15a结合位点; B. 软骨细胞初步验证靶向关系; C. 双荧光素酶检测系统验证靶向关系A. FKBP5 binding site with miR-15a; B. Chondrocytes preliminarily verified the targeting relationship; C. Validation of targeted relationship by double-luciferase detection reporter system图7 miR-15a与FKBP5靶向关系验证Fig.7 Verification of the targeting relationship between miR-15a and FKBP5
3 讨 论
VVD的发病机制至今尚未阐明,在此前的研究中发现VVD病鸡存在软骨细胞矿化障碍的现象。体外分离培养软骨细胞对研究VVD的发生有重要意义。软骨细胞是软骨组织中存在的唯一细胞。软骨细胞被丰富的胶原纤维蛋白和蛋白聚糖包裹,很难被消化分离出软骨细胞。本试验用3种酶对软骨组织进行消化,且在消化时增大软骨组织与酶的接触面积,使得软骨细胞大量游离出来。软骨细胞作为软骨组织中唯一的细胞,由于软骨组织内没有血管,营养物质通过渗透作用进入软骨组织中,进而被软骨细胞吸收,这成为体外软骨细胞培养的依据。本研究分离出的软骨细胞数量较多,经过观察和鉴定得到体态、生理特征和生物学特性良好,且可以稳定传至F4代的软骨细胞。当软骨细胞传到F4代时,软骨细胞呈现长梭形,出现明显去分化现象。综合生长曲线、细胞生长状态等多种因素考虑,选择生长速度稳定、状态良好的F2代软骨细胞进行后续试验。
骨免疫学是强调骨骼系统和免疫系统关系的概念。随着深入研究,学者发现免疫系统和骨骼系统相互作用维护机体平衡。比如免疫系统通过T细胞、B细胞等分泌的细胞因子直接作用于骨骼系统,骨细胞也可以反过来调节免疫系统。我们希望找到一些在免疫系统和骨骼系统两者之间发挥重要作用的关键基因,并对其进行研究,期待为VVD的研究和抗病育种提供参考依据。通过前人的研究,我们了解到miR-15a在骨骼疾病和免疫功能等方面发挥重要作用。比如Wei等发现,miR-15a与5靶向结合促进炎症发生和细胞迁徙。颜世举发现,在关节炎软骨细胞中miR-15a显著高表达;他还发现软骨细胞过表达miR-15a可以抑制软骨细胞的增殖,促进细胞凋亡;过表达miR-15a抑制II型胶原的合成,影响软骨基质的完整性,从而促进骨关节炎发病。
本研究发现,miR-15a在VVD组鸡的软骨中低表达,揭示miR-15a在VVD中的作用机制可能与其在骨关节炎中的作用机制不同。本研究通过检测过表达miR-15a对软骨细胞的标志基因、炎性细胞因子以及凋亡基因表达的影响,初步探究了miR-15a对软骨细胞的影响。研究发现,鸡软骨细胞过表达miR-15a后,II型胶原、蛋白聚糖、X型胶原表达量有所下降,其中蛋白聚糖显著下降(<0.05)。蛋白聚糖影响软骨细胞的黏附、迁移能力,且对软骨细胞增殖分化起着重要作用。本研究还发现,软骨细胞过表达miR-15a后,成熟分化基因2、9表达量显著下降(<0.05),极显著升高,较NC组表达量极显著降低(<0.01),抗凋亡因子-2显著下降(<0.05)。软骨细胞的凋亡机制涉及到Caspas家族、P53和Bcl-2家族等多种凋亡途径,而-2是凋亡中最常见的终末通路。与两者结合可促进细胞凋亡,一般作用于诱导阶段。有研究表明,与的凋亡诱导过程与-2的表达有一定的关系,-2可以抑制或阻断介导的凋亡。本试验发现,软骨细胞过表达miR-15a后,表达量极显著升高,较NC组表达量极显著降低(<0.01),抗凋亡因子-2极显著下降(<0.05)。提示诱导凋亡机制与-2凋亡机制可能在过表达miR-15a导致软骨细胞凋亡的过程中发挥作用,具体机制有待进一步研究。
4 结 论
本试验通过改良软骨细胞体外分离方法成功获得了状态和生理特性良好的软骨细胞。综合试验结果发现,过表达miR-15a抑制软骨细胞的增殖、成熟和分化并促进细胞凋亡,为后续研究肉鸡VVD发病机制和肉鸡抗病育种提供了参考依据。

