NAD+/SIRT2途径调节衰老卵母细胞成熟质量的分子机制
徐德军,赵中权,赵永聚
(西南大学动物科学技术学院 草食动物科学重庆市重点实验室,重庆 400715)
卵巢是哺乳动物衰老过程中较早出现退行性变化的器官之一,其衰老表现为卵巢结构发生改变以及卵子发生障碍。卵巢早衰引起的排卵数量和卵子质量下降是制约家畜繁殖利用年限的重要因素之一。卵母细胞具备完全的受精和发育能力需要核与胞质的同步成熟,这表明在成熟过程中需要大量能量供给以维持纺锤体组装、染色体分离、细胞器重新分布等成熟事件的精确调控。既往研究大多从外源营养因素的角度关注卵母细胞发育成熟的能量代谢途径,忽略了线粒体能量代谢的协调效应。特别是卵母细胞极易受到老龄相关功能障碍的影响,引起线粒体功能下降、活性氧(reactive oxygen species, ROS)增加及染色体分离异常等分子变化。衰老卵母细胞发生这种成熟缺陷的分子机制仍不完全清晰,阐明何种生理环节参与这一缺陷的分子或代谢途径,将有助于找到延缓生殖衰老的方法。近年的研究发现,酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依赖性去乙酰化酶2(sirtuin2,SIRT2)具有延长卵巢寿命、减缓卵母细胞衰老及提高其成熟质量的功能,激活NAD+/SIRT2途径有可能为提高母畜胚胎利用潜能提供新策略。最初的研究认为,抗衰老因子SIRT2与纺锤体形成有关,而最新的证据表明NAD+/SIRT2维持卵母细胞能量代谢稳态,并且直接控制线粒体质量。本文总结NAD+/SIRT2与卵母细胞衰老的内在关系,阐述了其通过减数分裂、能量代谢、线粒体质量控制等关键生理环节影响卵母细胞成熟的作用机理,以期为提高老龄母畜的繁殖效率提供参考。
1 NAD+/SIRT2与衰老卵母细胞成熟质量
1.1 衰老卵母细胞成熟障碍的分子基础
卵母细胞成熟是一个复杂的生理过程,涉及到纺锤体形成、染色体分离和细胞器重新分布等多种分子变化。能量代谢在卵母细胞成熟事件中至关重要,尤其作为卵母细胞中最为丰富的母源细胞器,线粒体通过氧化磷酸化为卵母细胞的核和胞质成熟提供了大部分能量。线粒体功能障碍引起的能量失衡是导致低质量卵母细胞成熟过程中染色体分离、胞质成熟异常等成熟障碍事件发生的重要原因。不管是生殖衰老还是排卵后老化,卵母细胞均出现相似的衰老表型,如纺锤体畸变、染色体过早分离及非整倍体。伴随着卵巢功能衰老,卵母细胞也出现衰老现象。研究发现,人类(>30岁)、牛(>8.3岁)、小鼠(>12月)等哺乳动物的卵母细胞质量随着年龄的增加而明显下降,出现纺锤体形成、染色体分离异常等成熟障碍。迄今有关卵巢衰老的机制仍不完全清楚,许多因素可能会影响衰老进程,包括端粒的缩短,缺陷的DNA修复机制以及核基因组中突变积累等。然而,大量的证据表明,线粒体功能缺陷引起的能量代谢紊乱和线粒体氧化应激是直接导致卵母细胞衰老的关键机制。线粒体分布和定位在ATP需求较高的胞质区域,为卵母细胞胞质和核成熟提供能量,包括生发泡破裂,微管组装以形成减数分裂纺锤体。
研究认为,衰老靶向抑制卵母细胞的胞质成熟,特别是线粒体功能,并产生包括核染色体异常在内的各种缺陷。有证据表明,老年不孕症患者的卵母细胞线粒体活性异常,ATP的产生减少,从而限制了卵母细胞的正常发育成熟。研究者通过对比分析老龄与青年小鼠卵母细胞的基因表达模式,发现衰老引起线粒体功能与抗氧化的相关基因表达下调。由于线粒体DNA(mitochondrial deoxyribonucleic acid, mtDNA)位于线粒体内膜电子传递链附近,缺乏组蛋白保护机制,很容易受到氧化应激损伤。特别是ROS导致的mtDNA损伤,影响了线粒体呼吸链蛋白的正常编码,从而抑制氧化磷酸化,进一步加剧线粒体氧化应激,形成恶性循环。最近,Wang等通过单细胞测序揭示老龄猴和人类卵巢组织的转录图谱,发现抗氧化信号在衰老卵母细胞特异性传导障碍。临床上的研究也证实,许多纺锤体异常和卵母细胞非整倍体病例可能很大程度上是由于氧化应激对mtDNA损伤引起的线粒体功能障碍。在人类医学上的研究表明,高龄女性的卵母细胞mtDNA含量明显低于年轻女性。研究者在牛、猪等家畜上也观察到衰老引起的低质量卵母细胞伴随着线粒体功能缺陷的现象。可见,卵母细胞的衰老与氧化还原反应失衡及线粒体功能密切相关,阐明这些重要环节的调控机理将是延缓卵母细胞衰老的关键。
1.2 NAD+/SIRT2改善衰老卵母细胞成熟障碍

2 NAD+/SIRT2调控衰老卵母细胞减数分裂的机制
在减数分裂期间,卵母细胞需要正确分离染色体,以保证受精时产生整倍体受精卵。在这个过程中,任何一个步骤的错误都可能导致非整倍体卵子的产生。精确控制纺锤体装配对于卵母细胞正常染色体分离,并形成整倍体至关重要。研究发现,卵母细胞减数分裂缺陷和非整倍体的频率与衰老密切相关。这种衰老引起的染色体和纺锤体缺陷是导致母畜流产和出生缺陷发生率增加的主要原因。尽管研究者已经提出了不同的分子和途径导致卵母细胞减数分裂中与年龄相关的缺陷,但调节减数分裂的机制仍不清楚。SIRT2在有丝分裂进程、氧化应激反应、微管动力学、染色质凝聚和细胞迁移等众多生理过程中的功能已有深入研究。近年来,越来越多的证据表明,依赖NAD+的SIRT2在减数分裂中扮演着重要角色。SIRT2通过去乙酰化α-tubulin和H4K16影响纺锤体形成和染色体排列,并且过表达SIRT2减缓了衰老相关的卵母细胞减数分裂缺陷。尽管H4K16和α-tubulin被认为是卵母细胞中SIRT2的去乙酰化底物,但SIRT2下调与衰老相关成熟缺陷之间的潜在机制仍不清楚。最近,Selesniemi等报道了热量限制或代谢调节蛋白PGC-1缺失可改善老年雌性小鼠的卵母细胞质量,进一步发现了SIRT2影响卵母细胞衰老的新途径。因此,SIRT2和PGC-1之间的互作关系值得深入研究。有丝分裂检验点蛋白(BubR1)参与卵母细胞减数分裂的关键步骤,如纺锤体组装检查点活性、第一次减数分裂的时间以及染色体与纺锤体的稳定附着。值得注意的是,在人类和小鼠的衰老卵母细胞中均检测到BubR1水平显著降低。研究报道,SIRT2-BubR1是决定衰老卵母细胞核成熟事件的重要途径,衰老诱导的SIRT2蛋白丢失引起BubR1在赖氨酸243位点高度乙酰化,最终导致纺锤体缺陷、染色体错位和非整倍体卵子生成。这些证据表明,NAD+依赖的SIRT2通过对其下游底物蛋白(如α-tubulin、H4K16及BubR1)的去乙酰化作用来调节卵母细胞纺锤体组装与染色体分离,从而影响衰老卵母细胞的减数分裂。
3 NAD+/SIRT2维持衰老卵母细胞能量代谢稳态的机制
NAD+依赖的去乙酰化酶SIRT2是Sirtuins家族(SIRT1-7)中唯一主要位于细胞质,但也存在于线粒体和核的成员,其表达和活性与细胞能量/氧化还原状态的变化紧密相关。在哺乳动物中,SIRT2拥有一个高度保守的NAD+结合位点和催化结构域。随后的研究发现,衰老肌细胞低浓度的NAD+抑制SIRT2去乙酰化活性,引起SIRT2的底物高度乙酰化。这些证据表明,NAD+水平直接影响SIRT2的去乙酰化活性。SIRT2在代谢相关组织中高表达,包括大脑、睾丸、卵巢、肝和脂肪等组织。研究发现,SIRT2在卵母细胞成熟阶段特异高表达。卵母细胞在其成熟阶段需要大量能量以维持减数分裂。尽管很多研究强调,卵丘细胞生成的丙酮酸在卵母细胞成熟过程中的重要性,但越来越多的证据表明,卵母细胞的糖脂代谢同样决定卵母细胞的成熟。遗憾的是,目前大多数葡萄糖、脂肪酸等底物的代谢相关酶在卵母细胞成熟过程中的调控机制尚未阐明,代谢底物的转运机制仍不清楚。
最初研究发现,SIRT2通过对微管蛋白(Tubulin)去乙酰化作用参与卵母细胞的纺锤体形成。近年来,研究者在不同类型细胞中发现一些新的SIRT2去乙酰化底物,这暗示SIRT2介导的去乙酰化途径可能通过新的调控机制改善衰老卵母细胞成熟质量(图1)。在葡萄糖代谢上,SIRT2在葡萄糖缺乏的情况下使糖异生代谢途径限速酶(PEPCK1)去乙酰化并使其稳定,更重要的是,SIRT2通过激活糖酵解途径关键酶GADPH、G6PD的活性调节牛卵母细胞线粒体能量代谢;在胰岛素敏感性上,SIRT2过表达增强胰岛素诱导的AKT激活和下游GSK-3β磷酸化;在脂肪酸代谢上,SIRT2介导的PGC-1α/FoxO1去乙酰化修饰调节下游转录因子的活性,这些转录因子可以促进脂肪酸β氧化、三羧酸(TCA)循环和电子传递链相关蛋白的表达。研究显示,SIRT2参与AMPK、PI3K/AKT、mTOR等能量代谢通路关键信号分子的赖氨酸位点去乙酰化修饰,这表明SIRT2可能通过去乙酰化途径调控卵母细胞糖脂代谢的信号转导。然而,衰老卵母细胞在成熟过程中能量代谢通路的信号转导机制却鲜为人知。以往的观点认为主要定位于线粒体的SIRT3、SIRT4、SIRT5参与线粒体功能,然而SIRT3敲除小鼠模型并没有表现出明显的代谢障碍表型,SIRT2敲除小鼠表现出线粒体耗竭引起的能量衰竭和氧化还原异常。研究发现,SIRT2也存在于小鼠大脑细胞的线粒体内膜,能够直接参与线粒体蛋白的去乙酰化修饰,并且SIRT2的缺失改变了线粒体的正常形态,引起线粒体的能量代谢异常。在牛卵母细胞上也观察到类似的现象,抑制SIRT2活性引起了线粒体功能紊乱。尽管这些证据表明,SIRT2途径与衰老卵母细胞的能量代谢关系密切,但目前仍未完全揭示NAD+/SIRT2介导的能量代谢途径调控衰老卵母细胞成熟的具体机制,NAD+依赖的SIRT2通过何种生理环节参与线粒体功能也有待进一步研究。
4 NAD+/SIRT2调节衰老卵母细胞线粒体质量控制的机制
4.1 NAD+/SIRT2缓解线粒体氧化应激
尽管ATP为卵母细胞成熟事件提供能量,但线粒体的氧化磷酸化过程也会导致大量ROS的发生。氧化还原信号的失衡会导致线粒体功能受损,进一步促进ROS形成。线粒体损伤导致的ATP减少和谷胱甘肽(glutathione, GSH)降低是引起卵母细胞成熟障碍的重要机制。正如在牛卵母细胞体外培养过程中高浓度的葡萄糖会增加ROS,并降低细胞内GSH,从而抑制卵子成熟。氧化应激是ROS的产生和抗氧化系统之间的不平衡引起的,并且通常与代谢紊乱有关。SIRT2在细胞的氧化损伤和抗氧化能力上起着复杂的作用。现有的研究显示,在已经确定的SIRT2去乙酰化底物中,一些与维持细胞内的氧化还原稳态有关。研究报道了参与调节ROS水平的其他SIRT2靶点,包括葡萄糖6-磷酸脱氢酶(glucose 6-phosphate dehydrogenase, G6PD)、磷酸甘油酸突变酶(phosphoglycerate mutase 2, PGAM2)等代谢相关酶。在人类医学上的研究表明,SIRT2也可以对FoxO1进行去乙酰化修饰,表明SIRT2对氧化应激的保护作用可能依赖FoxO1途径。在脂肪细胞,SIRT2已被证明可以在氧化应激反应中去乙酰化并激活FoxO3a。值得注意的是,FoxO3a作为MnSOD抗氧化基因的转录激活因子参与氧化还原信号的平衡。随后的研究证实,依赖SIRT2的FoxO3a去乙酰化上调了MnSOD表达,从而降低细胞ROS水平。在牛卵母细胞中利用SIRT2特异性抑制剂也发现FoxO3a乙酰化修饰和ROS水平升高的现象。但目前仍不清晰SIRT2介导衰老卵母细胞氧化还原信号的分子调控网络。
4.2 NAD+/SIRT2调节线粒体生物合成与动力学
大部分线粒体功能蛋白通过表观遗传修饰调节其在细胞质与线粒体之间的转运,这表明SIRT2介导的去乙酰化修饰可能在线粒体转位中具有独特的功能。研究发现,SIRT2也存在于小鼠大脑细胞的线粒体内膜,能够在线粒体直接参与线粒体蛋白的去乙酰化修饰,并且SIRT2缺失改变了线粒体的正常形态,引起线粒体的能量代谢异常。线粒体质量控制机制主要包括线粒体生物合成、动力学(分裂-融合)及线粒体自噬。卵母细胞通过控制线粒体质量清除损伤的线粒体、维持其数量和质量的稳定。TFAM进入线粒体后促进mtDNA的编码,进而调控线粒体的生物合成。卵母细胞通过线粒体不断的融合与分裂隔离来交换损伤的蛋白质及突变mtDNA,从而促进线粒体更新。研究报道,NAD+依赖的SIRT2通过介导肝细胞中线粒体生物合成和动力学相关蛋白的表达,减轻了ROS诱导的线粒体功能障碍。先前的研究也发现,抑制牛卵母细胞的SIRT2活性下调了TFAM和线粒体融合蛋白2(mitofusin-2, Mfn2)的表达,促进了线粒体分裂蛋白1(dynamin-related protein, Drp1)表达。这些证据表明,SIRT2失活扰乱了线粒体的生物合成和分裂-融合平衡,但其具体的调节机制仍不清楚。
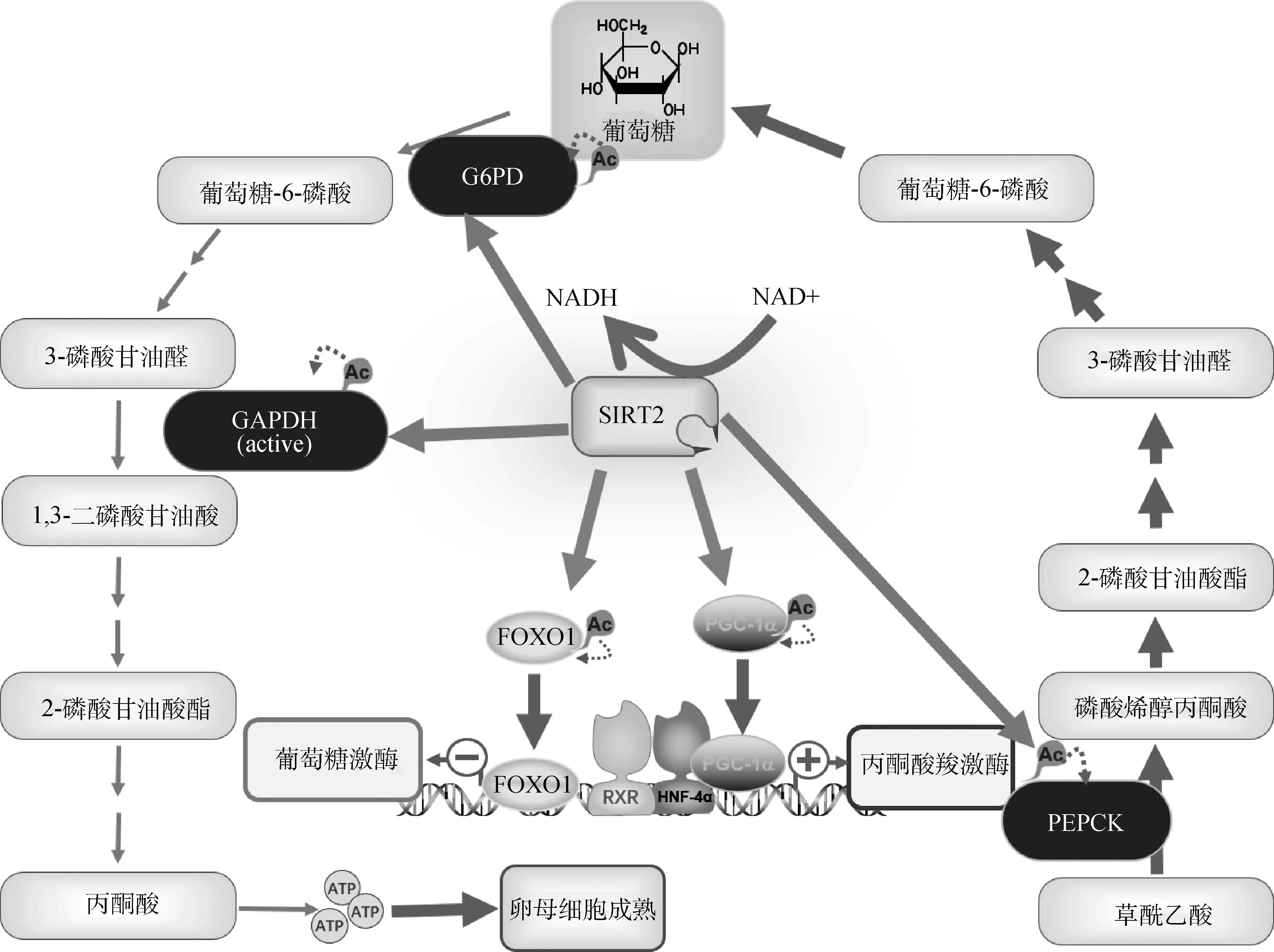
SIRT2. 沉默信息调节因子2;NAD+. 烟酰胺腺嘌呤二核苷酸;NADH. 还原型烟酰胺腺嘌呤二核苷酸;FOXO1. 叉头框转录因子O1;PGC-1α. 过氧化物酶体增殖物激活受体-γ共激活因子-1α;GAPDH. 3-磷酸甘油醛脱氢酶;G6PD. 葡萄糖-6-磷酸脱氢酶;PEPCK. 磷酸烯醇丙酮酸羧激酶;RXR. 维甲酸X受体;HNF-4α. 肝细胞核因子4α;ATP. 腺嘌呤核苷三磷酸;Ac. 乙酰化修饰。下同SIRT2. Sirtuin2; NAD+. Nicotinamide adenine dinucleotide; NADH. Reduced form of nicotinamide-adenine dinucleotide; FOXO1. Forkhead box O1; PGC-1α. Peroxlsome proliferator-activated receptor-γ coactlvator-1α; GAPDH. Glyceraldehyde-3-phosphate dehydrogenase; G6PD. Glucose-6-phosphate dehydrogenase; PEPCK. Phosphoenolpyruvate carboxylase; RXR. Retinoid X receptor; HNF-4α. Hepatocyte nuclear factor 4 alpha; ATP. Adenosine triphosphate; Ac. Acetylation. The same as below图1 NAD+/SIRT2调节卵母细胞糖代谢的可能机制Fig.1 The possible mechanism of NAD+/SIRT2 regulating oocyte glucose metabolism
4.3 NAD+/SIRT2调节线粒体自噬
线粒体通过不断的分裂、融合和线粒体自噬来维持代谢平衡,而线粒体自噬对维持线粒体的质量和数量至关重要。尽管现有的证据显示SIRT2与自噬有关,而SIRT2调节自噬的研究不如SIRT1深入,SIRT2与自噬之间关系仍不明确。SIRT2水平的降低导致正常HCT116细胞自噬水平的升高;添加SIRT2抑制剂AGK2可加剧HO诱导的细胞内ATP降低并增加PC12细胞坏死,但不影响大自噬活性变化;SIRT2过表达通过干扰SN56细胞和SH-SY5Y细胞聚集体的形成,从而抑制溶酶体介导的自噬转运;在神经细胞,SIRT2缺失影响线粒体自噬通路,并直接去乙酰化自噬相关蛋白ATG5,从而扰乱线粒体自噬进程。自噬流高度依赖于微管(microtubules, MTs),微管蛋白Tubulins通过乙酰化修饰调节微管网络的稳定性。值得关注的是,SIRT2能够对Tubulin去乙酰化修饰,这表明SIRT2很可能调控卵母细胞的自噬流。研究发现,SIRT2主要通过调节微管蛋白网络和自噬相关蛋白来影响自噬。长期缺乏维生素E的小鼠表现出2的mRNA表达下降,并引起微管蛋白乙酰化水平和自噬活性变化,从而导致轴突损伤。目前SIRT2介导自噬反应的研究领域主要集中在神经退行性疾病模型中,SIRT2在卵母细胞自噬中的作用机制仍不清楚。尽管SIRT2介导自噬在不同病理过程或刺激下可能具有不同的结果,但SIRT2的去乙酰化功能似乎在自噬的维持中具有独特的作用。尤其我们的研究发现,SIRT2失活参与了牛衰老卵母细胞的自噬反应。上述研究表明,NAD+/SIRT2通过线粒体的生物合成、分裂-融合及线粒体自噬等重要生理环节调节线粒体质量(图2),但其通过何种分子途径介导衰老卵母细胞的线粒体质量控制仍未知,需要进一步深入研究。
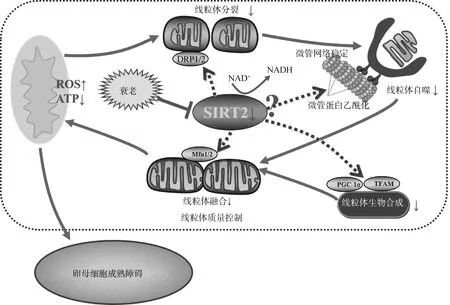
DRP1/2. 线粒体分裂相关蛋白1/2;Mfn1/2. 线粒体融合蛋白1/2;TFAM. 线粒体转录因子A;ROS. 活性氧。下同DRP1/2. Dynamin-related protein 1/2; Mfn1/2. Mitofusin1/2; PGC-1α. Peroxlsome proliferator-activated receptor-γ coactlvator-1α; TFAM. Mitochondrial transcription factor A; ROS. Reactive oxygen species. The same as below图2 NAD+/SIRT2在衰老卵母细胞中参与线粒体质量控制的可能机制Fig.2 The possible mechanisms of NAD+/SIRT2 involvement in mitochondrial quality control in aging oocytes
5 结语与展望
哺乳动物卵母细胞成熟是受精和胚胎发育的基本前提,而卵巢早衰会直接导致卵母细胞质量低下,引起不孕。尤其对于家畜,受卵巢过度利用的影响,其卵巢更容易早衰,从而极大地限制了家畜繁殖年限。如何提高衰老卵母细胞的成熟质量一直是生殖衰老研究领域的前沿热点问题。近年来,研究者试图通过添加NAD+代谢前体NMN或SIRT2潜在激活剂白藜芦醇的方式提高衰老卵母细胞的成熟质量,这表明NAD+/SIRT2途径对卵母细胞的成熟与衰老事件具有重要的调控功能。但其中仍存在一些问题:1)目前有关NAD+/SIRT2对卵母细胞成熟的报道更多地集中在减数分裂及核成熟的调控作用,虽然有研究报道了SIRT2敲除小鼠表现出线粒体缺失,导致能量衰竭和氧化还原代谢失衡,并引起衰老相关的生殖障碍,但其发挥作用的内在机制尚不清晰;2)卵母细胞成熟受到众多调控通路和基因的调节,涉及到已知的所有表观遗传修饰,相比于甲基化修饰,我们对乙酰化修饰调控机制了解甚少,尽管已有研究发现SIRT2通过多种底物的去乙酰化修饰参与衰老卵母细胞的成熟缺陷(图3),但目前仍未完全揭示SIRT2介导的去乙酰化作用调控衰老卵母细胞成熟的分子网络;3)目前主要从人类医学与小鼠生理上研究了NAD+/SIRT2参与衰老卵母细胞成熟,但对于猪、牛、羊等家畜的研究较少,其在家畜卵母细胞纺锤体组装、能量代谢及线粒体质量控制等决定成熟事件中的具体功能尚未见研究。未来研究应重点揭示NAD+/SIRT2与衰老相关通路的互作机制,特别是NAD+/SIRT2介导的去乙酰化作用影响线粒体生物合成、分裂-融合及线粒体自噬等关键环节的分子途径,将有望为靶向提高衰老卵母细胞的成熟质量提供新思路。

FoxO3a. 叉头框转录因子O3a;AMPK. 腺苷酸活化蛋白激酶;PI3K. 磷脂酰肌醇3-激酶;mTOR. 哺乳动物雷帕霉素靶蛋白;Tubulin. 微管蛋白;Drp. 线粒体分裂蛋白;BubR1. 有丝分裂检验点蛋白;H4K16. 组蛋白H4第16位赖氨酸FoxO3a. Forkhead box O3a; AMPK. Adenosine 5′-monophosphate-activated protein kinase; PI3K. Phosphatidylinositol 3 kinase; mTOR. Mammalian target of rapamycin; DrP. Dynamin-related protein; BubR1. Mitotic checkpoint serine/threonine-protein kinase BUB1 beta; H4K16. Histone 4 lysine 16图3 NAD+/SIRT2通过去乙酰化底物途径调控衰老卵母细胞的成熟质量Fig.3 NAD+/SIRT2 regulates the maturation quality of aged oocytes through deacetylated substrate pathways

