过表达TaGS1/TaGS2对烟草氮素吸收的影响
王潇然,于美琴,韦一昊,张志勇,李会强,王小纯,*
过表达对烟草氮素吸收的影响
王潇然1,于美琴1,韦一昊2,张志勇2,李会强1,王小纯1,2*
1 河南农业大学,生命科学学院,河南 郑州 450002;2 河南农业大学,河南粮食作物协同创新中心,河南 郑州 450002
【】为揭示小麦氮素同化关键酶谷氨酰胺合成酶(TaGS1/TaGS2)在烟草中过表达对烟草氮素吸收同化能力的影响及其机制。【】以烟草栽培品种K326为对照,测定分析过表达/烟草的生长及氮代谢指标;利用转录组结合进化树分析,确定烟草硝酸转运蛋白家族(NtNRT/NPF)及其表达水平。【】过表达/烟草根系发达、叶片变大,氮素吸收同化积累显著升高;在烟草中鉴定到36个/家族基因;过表达/引起其中28个/家族基因表达变化,与qRT-PCR结果一致。【】过表达/可能通过提高、、等/家族基因表达,促进烟草氮素吸收、同化与积累,为烟草生长发育提供充足氮源。
GS;氮吸收;硝酸转运蛋白;过表达;烟草
氮是影响植物生长发育的重要营养元素,是构成蛋白质、核酸、叶绿素、辅酶、维生素以及烟碱、烟气致香物质的组成成分,对烟叶的产量和品质起着关键作用[1-4]。探索提升烟草氮素吸收和利用效率的途径,挖掘其分子机制,不仅对提高烟草产量及品质,降低生产成本具有重要价值,同时对缓解氮肥过度使用造成的农业面源污染具有积极意义。
在高等植物中,氮素的同化是通过谷氨酰胺合成酶/谷氨酸合成酶循环(GS/GOGAT)完成的,其中谷氨酰胺合成酶(Glutamine Synthetase,GS)作为无机氮转化为有机氮关键节点的催化酶,在氮素利用过程中至关重要[1]。高等植物中按照其亚细胞定位的不同可将GS分为2类:胞质型GS(GS1)和质体型GS(GS2)[5]。GS1主要参与植物根系NH4+的初始同化和衰老叶中氮的再转移[6-7]。而GS2主要在叶绿体表达,负责植物光呼吸释放的NH4+及NO3-还原产生的NH4+的同化过程[8]。Oliveira等研究证实,烟草过表达大豆基因可以显著提高其干重和鲜重[9]。烟草过表达基因可促进烟草氨基酸积累,加速幼苗生长,使植株鲜重提高20%~30%[10]。由此可知,过表达基因可提高烟草对氮的利用效率,然而,过表达基因是否通过调节/家族基因表达实现对氮素利用效率的提高尚不清楚。
植物根系主要以硝态氮(NO3-)和铵态氮(NH4+)两种形式从土壤中摄取氮素,烟草以吸收土壤中硝态氮为主[11]。负责植物硝酸盐吸收和转运的是硝酸转运蛋白(Nitrate Transporter/Peptide Transporter Family,NRT/NPF),根据它们转运硝酸盐的活性,可分为高亲和性(NRT2)和低亲和性(NRT1)两类[12]。NRT2是高亲和力硝酸盐转运蛋白家族,其中NRT2.1、NRT2.2、NRT2.4、NRT2.5在根系表达,在硝酸盐的吸收过程中发挥重要作用[12-17]。NRT1(NPF)主要由低亲和力硝酸盐转运蛋白构成,其中NRT1.1(NPF6.3)、NRT1.2(NPF4.6)是植物根系对NO3-吸收的核心成员[18-20]。除了NRT2和NPF外,还有另一个成员NRT3,它与NRT2相互作用参与高亲和硝酸盐的运输[21-22]。目前在拟南芥和水稻中,/家族基因得到了较为深入的研究,然而烟草/家族基因成员数量及其功能的研究仍鲜有报道。
本研究以烟草栽培品种K326为对照,研究了过表达/基因对烟草生长发育、氮代谢、/家族基因表达水平的影响,揭示过表达/基因对烟草氮吸收的影响及其机制,为氮高效烟草种质资源创制提供理论指导。
1 材料与方法
1.1 材料
实验材料包括烟草栽培品种K326(L.)及其过表达(DQ124209)纯合株系OE-TaGS1-1、OE-TaGS1-2和OE-TaGS1-3,过表达(DQ124212)纯合株系OE-TaGS2-1、OE-TaGS2-2和OE-TaGS2-3,由本实验室保存[23]。
1.2 烟草幼苗的培养
过表达/烟草株系及K326种子分别用75%酒精处理4 min,6.25%次氯酸钠处理10min,无菌水冲洗后转入MS灭菌培养基中于25℃,光周期16/8 h条件下培养10 d。移栽到直径7 cm、高10 cm的盆钵中(蛭石与营养土以3:2混匀),培养19 d后选取生长一致的烟苗移栽到育苗盆中,每盆1株,继续培养。
苗龄45 d时(10叶期),拍照记录OE-TaGS1、OE-TaGS2及K326烟草植株地上部及根系形态,并统计干重(3次生物学重复)。同时,随机选取同批移栽OE-TaGS1、OE-TaGS2及K326各3个单株分别取根系、从下往上数第6、7、8片展开叶,液氮速冻后于-80℃保存。
1.3 氮含量测定
将烟草组织在液氮中研磨至粉末状,采用Berthelot颜色反应法测定NH4+含量[24],采用水杨酸比色法测定NO3-含量[25]。烟草组织烘干粉碎后采用流动分析仪测定总氮(Total nitrogen, TN)含量[26]。叶片(根系)氮积累量,单位干重叶片(根系)氮素含量×单株叶片(根系)总干重。
1.4 烟草根系转录组测序
取OE-TaGS1、OE-TaGS2及K326烟草的根系,每个株系2次技术重复,液氮研磨后各取3 g送北京百迈克有限公司进行转录组测序,剩余样品-80℃保存。RNA-Seq数据用R语言DESeq数据包进行差异基因筛选,筛选条件为变异倍数(上调/下调)大于等于1.5倍,且FDR≤0.001,差异基因相对表达量以log2(FPKMOE/FPKMWT)表示。
1.5 RNA提取和cDNA合成
取烟草根系样品,采用RNE35广谱型植物RNA提取试剂盒(诺贝莱)提取RNA,cDNA合成按照HiScriptⅡQ RT SurMix for qRT-PCR(+gDNA wir)说明书进行反转录。
1.6 荧光定量PCR
基于根系RNA-Seq测序结果,筛选表达丰度较高的/家族基因设计引物,引物由上海生工合成(表1)。以烟草(LOC107800553)为内参基因,设3次生物学重复,反应程序参照诺唯赞公司的AceQ qRT-PCR SYBR Green Master Mix说明书,利用Bio-Rads实时荧光定量PCR仪进行定量检测。数据利用2-ΔΔCt方法计算。(转基因植株的目标基因表达量为ΔCtOE=2-(Ct目标基因-Ct内参基因),野生型植株目标基因表达量为ΔCtWT=2-(Ct目标基因-Ct内参基因),转基因与野生型植株的差异倍数为F=ΔCtOE/ΔCtWT,即2-ΔΔCt)
表1 qRT-PCR引物序列
续表1

基因名称(Gene name)上游引物序列(5'-3')(Upstream primer sequence)下游引物序列(5'-3')(Downstream primer sequence) NPF5.6AATCTCAGTTGGGACAGGAGGGCACCAAGTAATAGTCCGCAGCATA NPF6.3ATTTTAGGAGTTGAGGCAGTGGAGGTAACAATGTTTGCGGCGTTAG NPF6.4AGCAGGCTCCTTTTCCGTCAGTATCAGTCCGATTCCAACCG NPF7.3GGGTTGTCCATGTCTTCCTCAGATCCAAGTGCCCGTCGTTTA β-actinTACTTACTGAAGCACCCTTGAATCCGATCACGACCAGCAAGATCCAAC
1.7 系统发育树的构建
基于组学数据获取K326烟草相关硝酸转运蛋白的氨基酸序列,根据Ensembl Plants(http://plants. ensembl.org/index.html)获取拟南芥及水稻相关硝酸转运蛋白的氨基酸序列,采用MEGA 7.0软件构建进化树,方法为邻接法(Neighbor-Joining),Bootstrap次数为1000。
1.8 数据处理
利用Microsoft Excel和Graphpad Prism 8进行数据处理,采用SPSS 20.0进行方差分析(S-N-K),<0.05。
2 结果
2.1 过表达TaGS1/TaGS2对烟草苗期生长的影响
烟苗生长至10叶期时,OE-TaGS1和OE-TaGS2与栽培品种K326相比叶面积增大(图1A),根系更加发达,主根显著长于野生型(图1B)。OE-TaGS1和OE-TaGS2的地上部与根系干重均呈现显著高于K326(图1C)。可见,过表达/基因能够促进烟苗生长,提高生物量。

注:(A)不同株系的表型;(B)根长;(C)干物重。不同小写字母表示不同植株间差异显著(P<0.05),下同。
2.2 过表达TaGS1/TaGS2对烟草氮素含量的影响
对K326、OE-TaGS1和OE-TaGS2的叶片和根部氮素含量及积累量的测定结果表明,每克植株干重平均氮含量表现为TN(35 mg)>NO3-(6 μg)>NH4+(0.2 μg),叶片NH4+含量与根系NH4+含量一致,仅约0.2 μg;叶片NO3-含量约50 μg,是根系的5倍。可见,叶片及根系总氮主要以蛋白质等有机氮形式存在,有机氮主要来源于根系对无机氮(主要是NO3-)吸收转运及叶片的同化,因此植株总氮可以代表烟草对无机氮的吸收转运及同化积累。OE-TaGS1和OE-TaGS2叶片总氮含量与K326没有显著差异(图2A),但氮素积累量显著高于K326(图2C);OE-TaGS1和OE-TaGS2根系总氮含量及积累量显著高于K326(图2B、图2D)。可见,过表达/可促进烟草氮素的吸收同化。OE-TaGS2和K326叶片NO3-含量及总量差异不大,但均显著高于OE-TaGS1;OE-TaGS1和OE-TaGS2根系NO3-含量及总量显著高于K326,过表达/可促进根系对NO3-吸收。叶片NH4+含量表现为OE-TaGS2>K326>OE-TaGS1,但总量差异不大;根系NH4+含量表现为K326>OE-TaGS2> OE-TaGS1,根系NH4+总量K326>OE-TaGS2>OE- TaGS1(图2B、图2D),推测过表达促进根系中NH4+同化,故而含量降低。由此可见,过表达/可促进根系对NO3-的吸收、植株对氮素的同化利用。

注:(A)叶片含氮量;(B)根系氮含量;(C)叶片氮积累量;(D)根系氮积累量。
2.3 烟草硝酸转运蛋白家族进化分析
植物NO3-的吸收与运输主要由NRT/NPF家族蛋白完成。在K326、OE-TaGS1和OE-TaGS2烟草根系转录组数据库中鉴定到36个NtNRT/NPF家族蛋白,其中30个NtNPF,4个NtNRT2,2个NtNRT3。将上述36个蛋白与拟南芥及水稻同源蛋白(拟南芥55个,水稻22个)进行进化树分析,显示烟草NtNRT/NPF家族蛋白分为3类,即NtNPF、NtNRT2及NtNRT3,且烟草NtNRT/NPF与相应的拟南芥蛋白同源性更高(图3)。
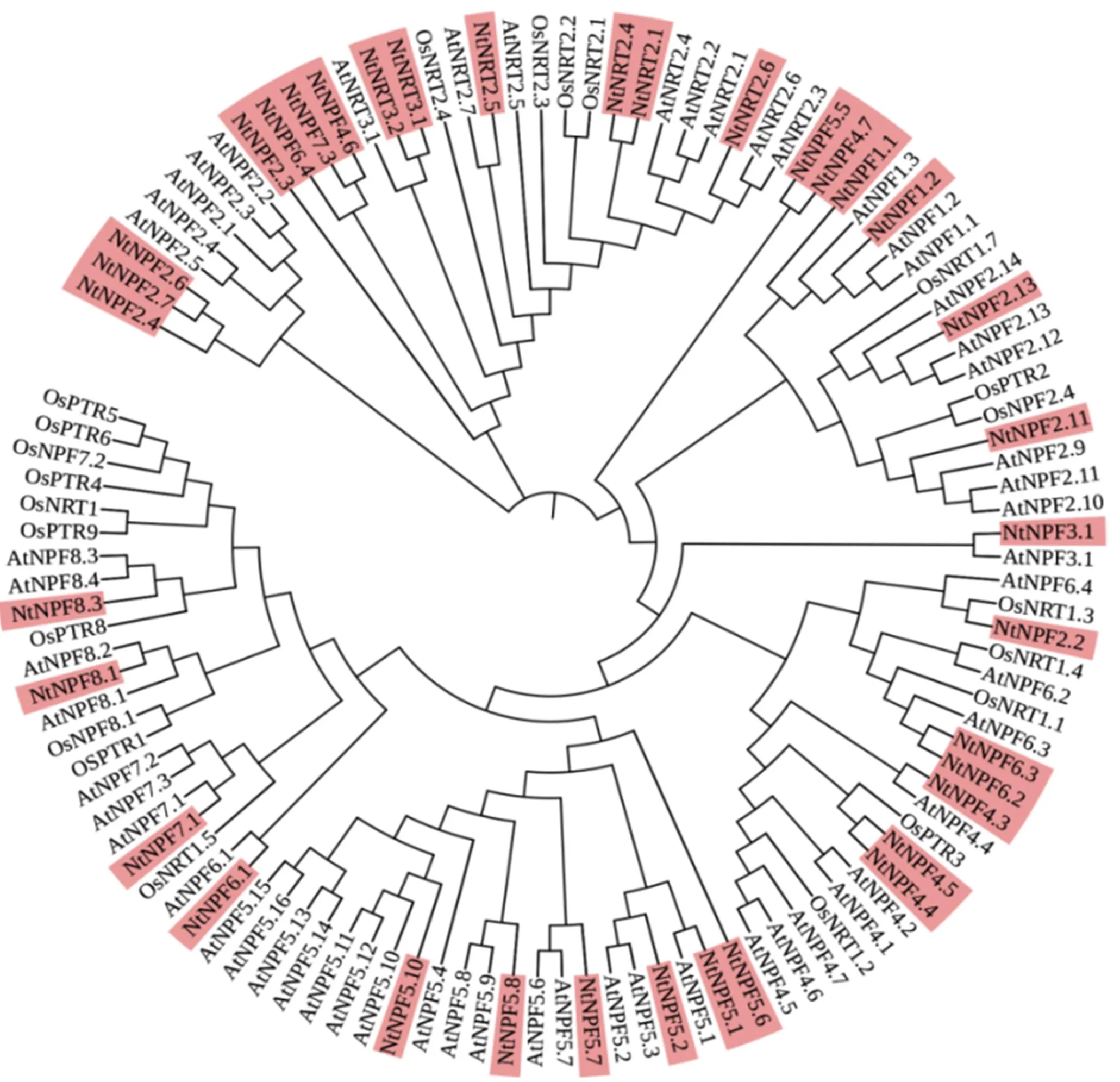
注:红色标记为烟草的36个硝酸转运蛋白。
2.4 过表达TaGS1/TaGS2对烟草根系NRT/NPF家族基因表达的影响
根系转录组数据分析显示,与K326相比,OE-TaGS1和OE-TaGS2根系有28个/家族基因差异表达,其中在二者中同时上调表达有5个,根据表达丰度高低依次为、、、和;仅在OE-TaGS1上调表达有7个,依次为、、、、和;仅在OE-TaGS2上调表达的有4个,依次为、、和;其余12个基因在转/烟草中有不同程度下调或无差异表达(图4A)。利用qRT-PCR对10个差异表达硝酸转运蛋白基因进行检测,并利用上述基因生成回归曲线证实转录组数据可靠(R>0.6,图4D、E)。同时发现在OE-TaGS1转录组下调表达,而qRT-PCR检测其显著上调(图4B、C)。可见,过表达和可能通过调节不同硝酸转运蛋白的表达影响烟草对氮素吸收效率。
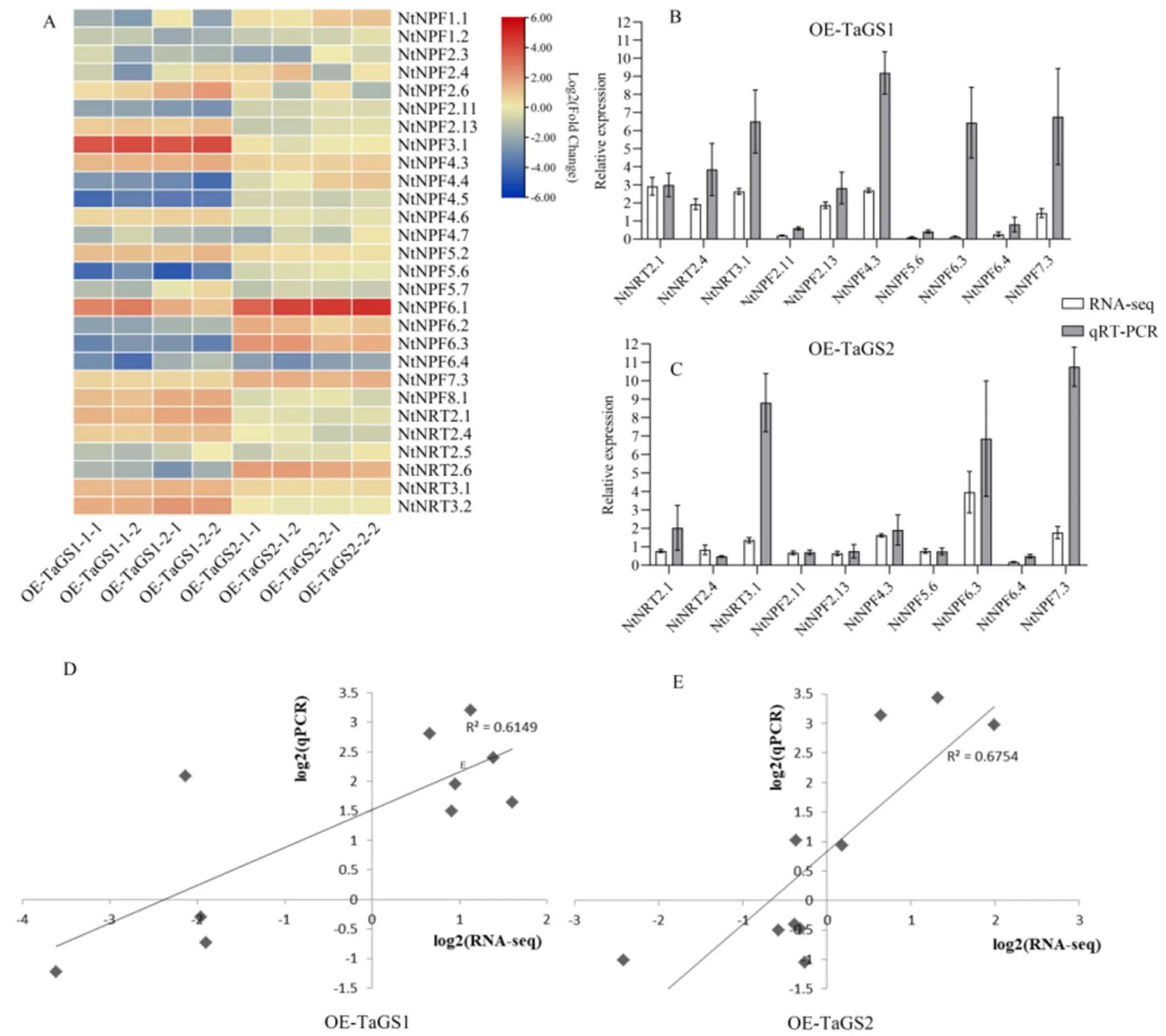
注:(A)基于转录组的差异基因分析;(B、C)OE-TaGS1和OE-TaGS2转录组数据验证;(D、E)回归曲线。
3 讨论
氮素的吸收、运输和利用是影响植物生长发育的最重要因素之一。GS是氮素同化的关键酶,小麦过表达促进地上部和根系发育,显著提高生物量[27]。烟草过表达能够促进NO3-吸收及NH4+同化,显著提高烟草干鲜重[28]。本研究表明,烟草过表达或植株生物量和氮素积累量显著提高,即过表达可以提高烟草植株无机氮同化效率,与他人研究结论一致。氮同化及生物量的增加必然与氮吸收的增加密切相关,但过表达外源基因如何影响烟草氮吸收相关转运蛋白的表达鲜有报道。
植物氮素主要以硝态氮(NO3-)和铵态氮(NH4+)两种无机氮形式吸收,其中又以NO3-为主[29]。硝酸还原酶(NR)和亚硝酸还原酶(NiR)在氮素同化过程将NO3-还原为NH4+,为GS提供催化底物[30]。NR、NiR及GS等氮素同化相关酶在胁迫条件下呈现共表达趋势[31]。因此,过表达促进NH4+同化也必然提升NO3-利用效率。本研究表明,OE-TaGS1根系及OE-TaGS2根系和叶片NO3-含量比K326出现不同程度增加,过表达/烟草总氮含量显著提高,证明过表达促进烟草对NO3-的吸收和同化,为促进烟草生长奠定物质基础。
NRT/NPF家族蛋白是植物体内NO3-主要转运体,不同家族成员负责植物根部对NO3-吸收及组织内部运输[32]。转录组分析发现,过表达/导致多个/家族基因发生表达变化,这可能是转基因烟草中NO3-吸收效率改变的重要原因。NPF6.3(NRT1.1)是植物中第一个被鉴定出的家族基因成员,在NO3-的吸收及转运过程中发挥重要作用,一旦其功能缺失可能诱发生长素(IAA)积累,进而导致植物侧根发育受到抑制[33]。组学检测发现可能仅在OE-TaGS2中上调表达,可靠性更高的qRT-PCR验证可知过表达均引发表达上调,说明对OE-TaGS1和OE-TaGS2中NO3-吸收和积累发挥重要作用。通过调控及基因表达,改变根系对NO3-的吸收效率[34],本研究发现过表达均引发表达上调,且叶片氮积累量高于K326,说明可提高OE-TaGS1和OE-TaGS2根系对氮的吸收转运效率。为低亲和转运体系,在木质部表达,介导硝酸盐经由木质部向地上运输[35],本研究发现过表达均引发显著上调,促进烟草根部对硝态氮吸收,提高烟草对NO3-的转运能力。
GS1主要存在于输导组织细胞质中,GS2主要存在于叶肉细胞的叶绿体中,二者在无机氮同化过程中存在功能差异[36]。这可能导致OE-TaGS1和OE-TaGS2烟草部分/家族基因呈现不同变化趋势。尽管过表达/烟草表型及生理指标相似,但家族基因表达存在差异,推测不同家族基因可能与相同激素作用调控氮吸而收[12],也可能在烟草中存在相对保守的机制,导致/过表达均能提升烟草的氮素吸收和利用效率,但其分子机制仍待深入研究。
4 结论
过表达/基因均能够促进烟草的生长,影响硝酸转运蛋白家族36个成员中28个成员发生表达变化,可能调控、、等表达上调,进而促进硝态氮吸收,为GS同化无机氮提供原料。
[1] Bernard S M, Habash D Z. The importance of cytosolic glutamine synthetase in nitrogen assimilation and recycling[J]. New Phytologist, 2009, 182(3): 608-620.
[2] Bloom A J. The increasing importance of distinguishing among plant nitrogen sources[J]. Current Opinion in Plant Biology, 2015, 25: 10-16.
[3] Thomsen H C, Eriksson D, Møller I S , et al. Cytosolic glutamine synthetase: a target for improvement of crop nitrogen use efficiency?[J]. Trends in Plant Science, 2014, 19(10): 656-663.
[4] 郑昕,史宏志,杨兴有,等. 施氮量与留叶数对万源晒红烟产质量和香气成分的影响[J]. 中国烟草科学,2018, 39(01): 49-56.
ZHENG Xin, SHI Hongzhi, YANG Xingyou, et al. Effects of nitrogen rates and numbers of leaves remained on yield, quality and aroma components of sun-cured red tobacco[J]. Chinese Tobacco Science, 2018, 39(01): 49-56.
[5] Martin A, Lee J, Kichey T, et al. Two cytosolic glutamine synthetase isoforms of maize are specifically involved in the control of grain production[J]. Plant Cell, 2006, 18(11): 3252-3274.
[6] Liliana A O, Michael M, Kohki Y, et al. Autophagy, plant senescence, and nutrient recycling[J]. Journal of Experimental Botany, 2014, 65(14): 3799-3811.
[7] Guan M, Møller I S, Schjoerring J K. Two cytosolic glutamine synthetase isoforms play specific roles for seed germination and seed yield structure in Arabidopsis[J]. Journal of Experimental Botany, 2015, 66(1): 203-212.
[8] Wallsgrove R M, Turner J C, Hall N P, et al. Barley mutants lacking chloroplast glutamine synthetase-biochemical and genetic analysis[J]. Plant Physiology, 1987, 83(1): 155-158.
[9] Oliveira I C, Brears T, Knight T J, et al. Overexpression of cytosolic glutamine synthetase. Relation to nitrogen, light, and photorespiration[J]. Plant Physiology, 2002, 129(3): 1170-1180.
[10] Migge A, Carrayol E, Hirel B, et al. Leaf-specific overexpression of plastidic glutamine synthetase stimulates the growth of transgenic tobacco seedlings[J]. Planta, 2000, 210(2): 252-260.
[11] 冯新维,黄莺,陈东,等. 烤烟氮代谢研究进展[J]. 分子植物育种,2021: 1-26.
FENG Xinwei, HUANG Ying, CHEN Dong, et al. An overview of nitrogen metabolism in flue-cured tobacco[J]. Molecular Plant Breeding, 2021: 1-26.
[12] Wang Y Y, Cheng Y H, Chen K E, et al. Nitrate transport, signaling, and use efficiency[J]. Annual Review of Plant Biology, 2018, 69: 85-122.
[13] Filleur S, Dorbe M F, Cerezo M, et al. AnT-DNA mutant affected ingenes is impaired in nitrate uptake[J]. Federation of European Biochemical Societies Letters, 2001, 489(2): 220-224.

[15] 黄化刚,申燕,王卫峰,等. 烟草硝酸盐转运蛋白基因的克隆及表达分析[J]. 中国烟草学报,2016, 22(01): 84-91.
HUANG Huagang, SHEN Yan, WANG Weifeng et al. Cloning and characterization ofgene fromL[J]. Acta Tabacaria Sinica, 2016, 22(01): 84-91.
[16] Corratgé-Faillie C, Lacombe B. Substrate (un)specificity ofNRT1/PTR FAMILY (NPF) proteins[J]. Journal of Experimental Botany, 2017, 68(12): 3107-3113.
[17] Krapp A, David L C, Chardin C, et al. Nitrate transport and signalling in[J]. Journal of Experimental Botany, 2014, 65(3): 789-798.
[18] Li H, Hu B, Chu C C. Nitrogen use efficiency in crops: lessons from Arabidopsis and rice[J]. Journal of Experimental Botany, 2017, 68(10): 2477-2488.
[19] Huang N C, Liu K H, Lo H J, et al. Cloning and functional characterization of annitrate transporter gene that encodes a constitutive component of low-affinity uptake[J]. The Plant Cell, 1999, 11(8): 1381-1392.
[20] Ho C H, Lin S H, Hu H C, et al.functions as a nitrate sensor in plants[J]. Cell, 2009, 138(6): 1184-1194.
[21] Plett D, Toubia J, Garnett T, et al. Dichotomy in thegene families of dicots and grass species[J]. PLoS One, 5(12): e15289.
[22] Kotur Z, Mackenzie N, Ramesh S, et al. Nitrate transport capacity of thethaliana NRT2 family members and their interactions with[J]. New Phytologist, 2012, 194(3): 724-731.
[23] 韦一昊. 过表达或对烟草生长和氮代谢的影 响[D]. 郑州:河南农业大学,2016.
WEI Yihao. Constitutive overexpression of glutamine synthetase 1 gene or glutamine synthetase 2 gene affects growth and nitrogen metabolism in transgenic tobacco[D]. Henan Agricultural University, 2016.
[24] Gordon S A, Fleck A, Bell J. Optimal conditions for the estimation of ammonium by the berthelot reaction[J]. Annals of Clinical Biochemistry, 1978, 15(5): 270-275.
[25] 谢红伟. 水杨酸比色法测定水中硝酸盐氮的含量[J]. 贵州农业科学,1999, 27(03): 41-42.
XIE Hongwei. Determination of nitrogen content in nitrate by salicylic acid colorimetry in water[J]. Guizhou Agricultural Sciences, 1999, 27(03): 41-42.
[26] 王小纯,王晓航,熊淑萍,等. 不同供氮水平下小麦品种的氮效率差异及其氮代谢特征[J]. 中国农业科学, 2015, 48(13): 2569-2579.
WANG Xiaochun, WANG Xiaohang, XIONG Shuping, et al. Differences in nitrogen efficiency and nitrogen metabolism of wheat varieties under different nitrogen levels[J]. Scientia Agricultura Sinica, 2015, 48(13): 2569-2579.
[27] Hu M, Zhao X, Liu Q, et al. Transgenic expression of plastidic glutamine synthetase increases nitrogen uptake and yield in wheat[J]. Plant Biotechnology Journal, 2018, 16(11): 1858-1867.
[28] Zheng J S, Yu C M, Chen P, et al. Characterization of a glutamine synthetase genefrom ramie (L. Gaud) and biochemical assays of-2-over-expressing transgenic tobacco[J]. Acta Physiol Plant, 2015, 37(1): 1742.
[29] 张杰,黄海棠,杨立均,等. 氮素形态对烟草生长及品质影响的研究进展[J]. 中国农学通报,2018, 34(15): 38-43.
ZHANG Jie, HUANG Haitang, YANG Lijun, et al. Nitrogen forms affecting tobacco growth and quality: research progress[J]. Chinese Agricultural Science Bulletin, 2018, 34(15): 38-43.
[30] Krapp A. Plant nitrogen assimilation and its regulation: a complex puzzle with missing pieces[J]. Current Opinion in Plant Biology, 2015, 25: 115-122.
[31] Seema S, Luis R A, Katarzyna G, et al.andexpression levels reveal NO and ABA mediated drought tolerance inL[J]. Scientific Reports, 2021, 11(1): 7992.
[32] Tegeder M, Masclaux-Daubresse C. Source and sink mechanisms of nitrogen transport and use[J]. The New Phytologist, 2018, 217(1): 35-53.
[33] Krouk G, Lacombe B, Bielach A, et al. Nitrate-regulated auxin transport by NRT1.1 defines a mechanism for nutrient sensing in plants[J]. Developmental Cell, 2010, 18(6): 927-937.
[34] Okamoto M, Kumar A, Li W, et al. High-affinity nitrate transport in roots of Arabidopsis depends on expression of the-like gene[J]. Plant Physiology, 2006, 140(3): 1036-1046.
[35] Lin H S, Kuo H F, Canivenc C, et al. Mutation of the Arabidopsisnitrate transporter causes defective root-to-shoot nitrate transport[J]. The Plant Cell, 2008, 20(9): 2514-2528.
[36] Bernard S M, Møller A L B, Dionisio G, et al. Gene expression, cellular localisation and function of glutamine synthetase isozymes in wheat (L.)[J]. Plant Molecular Biology, 2008, 67(1-2): 89-105.
The effect of/overexpression on nitrogen uptake in tobacco
WANG Xiaoran1, YU Meiqin1, WEI Yihao2, ZHANG Zhiyong2, LI Huiqiang1, WANG Xiaochun1,2*
1 College of Life Sciences, Henan Agricultural University, Zhengzhou 450002, China;2 Collaborative Innovation Center of Henan Grain Crops, Henan Agricultural University, Zhengzhou 450002, China
This study aims to reveal the effects of wheat glutamine synthetase(/) overexpression on nitrogen uptake and assimilation in tobacco (L.) as well as the hidden mechanism.Taking the tobacco cultivar K326 as control, the growth and nitrogen metabolism indicators of overexpressed transgenic lines/(OE-TaGS1/OE-TaGS2) were detected; RNA-Seq and cluster analysis were used to identify nitrate transporter (NtNRT/NPF) family members and analyze the abundance of/genes.The overexpressed/showed stronger roots, larger leaf area, the significant increasing accumulation and assimilation of nitrogen. A total of 36 genes of/were identified from the RNA-Seq, 28 genes among them showed variation on RNA level, which was consistent with qRT-PCR results.The/overexpression may trigger up-regulation of the crucial members of/family in tobacco, such as,and, etc., which promotes nitrogen uptake, assimilation and accumulation and provides sufficient nitrogen for tobacco growth and development.
GS; nitrogen uptake; nitrate transporter; overexpression; tobacco
Corresponding author. Email:xiaochun.w@163.com
不同氮效率小麦品种氮素吸收、同化及转运差异的分子机理(32071956)
王潇然(1983—),博士,副教授,主要研究方向为植物氮代谢,Tel:0371-63555790,Email:xiaoranwang@henau.edu.cn
王小纯(1966—),Tel:0371-63555790,Email:xiaochun.w@163.com
2021-11-08;
2022-02-22
王潇然,于美琴,韦一昊,等. 过表达TaGS1/TaGS2对烟草氮素吸收的影响[J]. 中国烟草学报,2022,28(3).WANG Xiaoran, YU Meiqin, WEI Yihao, et al. The effect of TaGS1/TaGS2 overexpression on nitrogen uptake in tobacco[J]. Acta Tabacaria Sinica, 2022, 28(3). doi:10.16472/j.chinatobacco. 2021.T0202

