β-淀粉样蛋白1-42寡聚体对BV2小胶质细胞炎症反应的影响及机制研究*
刘欣, 王俊力, 孙亦轩, 张忠文, 梅俊华, 陈国华, 邵卫△
β-淀粉样蛋白1-42寡聚体对BV2小胶质细胞炎症反应的影响及机制研究*
刘欣1, 王俊力2, 孙亦轩1, 张忠文2, 梅俊华2, 陈国华1, 邵卫2△
(1湖北中医药大学中医临床学院,湖北 武汉 430065;2武汉市第一医院神经内科,湖北 武汉 430022)
探讨β-淀粉样蛋白1-42寡聚体(amyloid β-protein 1-42 oligomer, oAβ)对BV2小胶质细胞炎症反应的影响及可能的机制。制备oAβ,采用不同浓度(0、0.5、1、5、10、20 μmol/L)的oAβ孵育BV2小胶质细胞24 h后,用倒置相差显微镜观察细胞形态变化;用CCK-8法检测BV2小胶质细胞活力;用ELISA法检测细胞培养上清液中肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白细胞介素6(interleukin-6, IL-6)、IL-4和IL-10的分泌水平。随后将BV2小胶质细胞分成对照组、模型组和拮抗剂组,模型组选取浓度为5 μmol/L的oAβ处理BV2小胶质细胞,拮抗剂组在模型组基础上加10 μmol/L Toll样受体1(Toll-like receptor 1, TLR1)/TLR2拮抗剂CU-CPT22作用于细胞,应用RT-qPCR和Western blot检测3组细胞TLR1、TLR2、髓样分化因子88(myeloid differentiation factor 88, MyD88)的mRNA和蛋白表达,用ELISA检测细胞培养上清液中TNF-α、IL-6、IL-4和IL-10的分泌水平。BV2小胶质细胞的活力随着oAβ浓度的增加而降低,TNF-α和IL-6分泌水平随oAβ浓度的增加而升高,IL-4和IL-10分泌水平随oAβ浓度的增加而降低,且与0 μmol/L oAβ组比较差异均有统计学意义(<0.05)。与对照组相比,模型组TLR1、TLR2和MyD88的mRNA及蛋白表达水平均显著升高(<0.01),TNF-α和IL-6分泌水平显著升高(<0.01),IL-4和IL-10分泌水平显著降低(<0.01);与模型组相比,拮抗剂组TLR1、TLR2及MyD88 mRNA和蛋白表达均显著降低(<0.05),TNF-α和IL-6分泌水平显著降低(<0.01),IL-4和IL-10分泌水平无显著变化(>0.05)。不同浓度的oAβ刺激BV2小胶质细胞后均出现了炎症反应,且oAβ呈浓度依赖性的升高了促炎细胞因子TNF-α和IL-6的表达水平,降低了抗炎细胞因子IL-4和IL-10的表达水平;oAβ可能通过TLR1/2-MyD88信号通路诱导BV2小胶质细胞活化,进而上调其促炎介质的水平。
阿尔茨海默病;β-淀粉样蛋白1-42寡聚体;小胶质细胞;TLR1/2-MyD88信号通路
神经炎症作为中枢神经系统内的炎症反应,曾被认为是阿尔茨海默病(Alzheimer disease, AD)的晚期后果,但现在越来越多的研究表明其是AD病理学的驱动力,它不仅能够加剧β-淀粉样蛋白(amyloid β-protein, Aβ)沉积和神经原纤维缠结的病理改变,与之形成恶性循环,还能直接导致突触功能障碍和神经元的凋亡,是AD神经退行性变的重要因素[1]。而小胶质细胞作为中枢神经系统的常驻免疫细胞,反应性增生且聚集在Aβ斑块周围,其被Aβ激活引起的大量促炎细胞因子的释放则被认为是大脑神经炎症的主要来源[2]。因此抑制Aβ诱导的小胶质细胞过度活化导致的神经炎症将成为改善和治疗AD的重要手段。虽然目前众多研究者已使用脂多糖诱导BV2小胶质细胞激活建立体外神经炎症模型,用于包括AD在内的大多数神经系统退行性疾病研究[3],但对能更好代表AD特征的Aβ体外神经炎症模型的建立及相关机制方面的研究较少。本项工作拟观察不同浓度β-淀粉样蛋白1-42寡聚体(amyloid β-protein 1-42 oligomer, oAβ)对BV2小胶质细胞炎症反应的影响,并进一步从mRNA和蛋白水平分析oAβ诱导BV2小胶质细胞发生神经炎症反应的潜在分子机制,为AD的防治提供实验依据。
材料和方法
1 实验试剂
高糖DMEM培养液、青霉素和链霉素均购于HyClone;胰酶-EDTA购于吉诺生物医药技术有限公司;胎牛血清购于杭州天杭生物科技有限公司;Aβ1-42购于Abcam;Cu-CPT22购于Selleck;CCK-8试剂盒购于Biosharp;肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白细胞介素6(interleukin-6, IL-6)、IL-4和IL-10 ELISA试剂盒,以及EntiLink™ 1st Strand cDNA Synthesis Kit逆转录试剂盒和EnTurbo™ SYBR Green PCR SuperMix PCR试剂盒均购于ELK Biotechnology;BCA蛋白质浓度测定试剂盒和ECL化学发光检测试剂盒均购于ASPEN;兔来源Toll样受体1(Toll-like receptor 1, TLR1)、TLR2和GAPDH单克隆抗体均购于Abcam;兔来源髓样分化因子88(myeloid differentiation factor 88, MyD88)多克隆抗体购于武汉三鹰生物技术有限公司;HRP标记的山羊抗兔IgG Ⅱ抗购于ASPEN。
2 实验方法
2.1oAβ的制备oAβ制备参考文献[4]的实验步骤。将Aβ1-42溶解于六氟异丙醇,室温条件重悬,分装,待六氟异丙醇挥发获得Aβ1-42肽膜,-20 ℃冻存。DMSO溶解肽膜,应用PBS稀释后,37 ℃寡聚化24 h成oAβ,然后4 ℃,13 700×离心10 min去除非水溶性纤维多肽杂质,取上清液转移到新管用于后续实验。
2.2细胞培养及干预将BV2小胶质细胞(Procell)培养于含有10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的高糖DMEM培养液中,放置于37 ℃、5% CO2细胞培养箱中培养,每1~2 d更换1次培养液。取对数生长期的BV2小胶质细胞,随机分为6组,分别用不同浓度(0、0.5、1、5、10和20 μmol/L)的oAβ孵育BV2小胶质细胞24 h后进行后续实验。取对数生长期的BV2小胶质细胞,随机分为3组:对照(control)组(不用任何药物干预)、模型组(oAβ处理组)和拮抗剂组(CU-CPT22+oAβ组),其中oAβ的浓度根据上述研究结果选择,CU-CPT22浓度为10 μmol/L。模型组以适宜浓度的oAβ作用24 h;拮抗剂组先用10 μmol/L TLR1/TLR2拮抗剂CU-CPT22孵育2 h,再加适宜浓度的oAβ继续培养24 h后进行后续实验。
2.3CCK-8法检测细胞活力取对数生长期的BV2小胶质细胞,以每孔1×104个接种到96孔板中,每孔100 μL培养液。待细胞贴壁后,分别加入不同浓度(0、0.5、1、5、10和20 μmol/L)的oAβ,24 h后弃去上清液,PBS清洗3次,向每孔中加入100 μL含10% CCK-8溶液的无血清高糖DMEM,37 ℃孵育2 h后,用多功能酶标仪检测溶液吸光度(450 nm处的值),根据吸光度计算各组相对细胞活力。
2.4ELISA试剂盒检测细胞炎症因子取对数生长期的BV2小胶质细胞,以每孔1×104个接种到96孔板中培养,每孔100 μL培养液。待细胞贴壁后分别加入不同浓度(0、0.5、1、5、10和20 μmol/L)的oAβ孵育24 h后收集细胞培养上清液;将对数生长期的BV2小胶质细胞随机分为对照组、模型组和拮抗剂组,待细胞贴壁后予以相应干预,24 h后收集细胞培养上清液。按照ELISA试剂盒说明书检测每组的TNF-α、IL-6、IL-4和IL-10含量。
2.5RT-qPCR检测细胞TLR1、TLR2和MyD88的mRNA表达取对数生长期的BV2小胶质细胞,以每孔1×105个的密度接种到6孔板中培养。待细胞贴壁后,按对照组、模型组和拮抗剂组予以相应干预,24 h后弃去上清液,PBS清洗3次。按总RNA提取试剂盒说明书提取各孔细胞总RNA,检测浓度后按照逆转录试剂盒说明书合成cDNA,以cDNA为模板根据PCR试剂盒说明书方法检测各组细胞TLR1、TLR2和MyD88 mRNA水平,所用引物序列见表1。
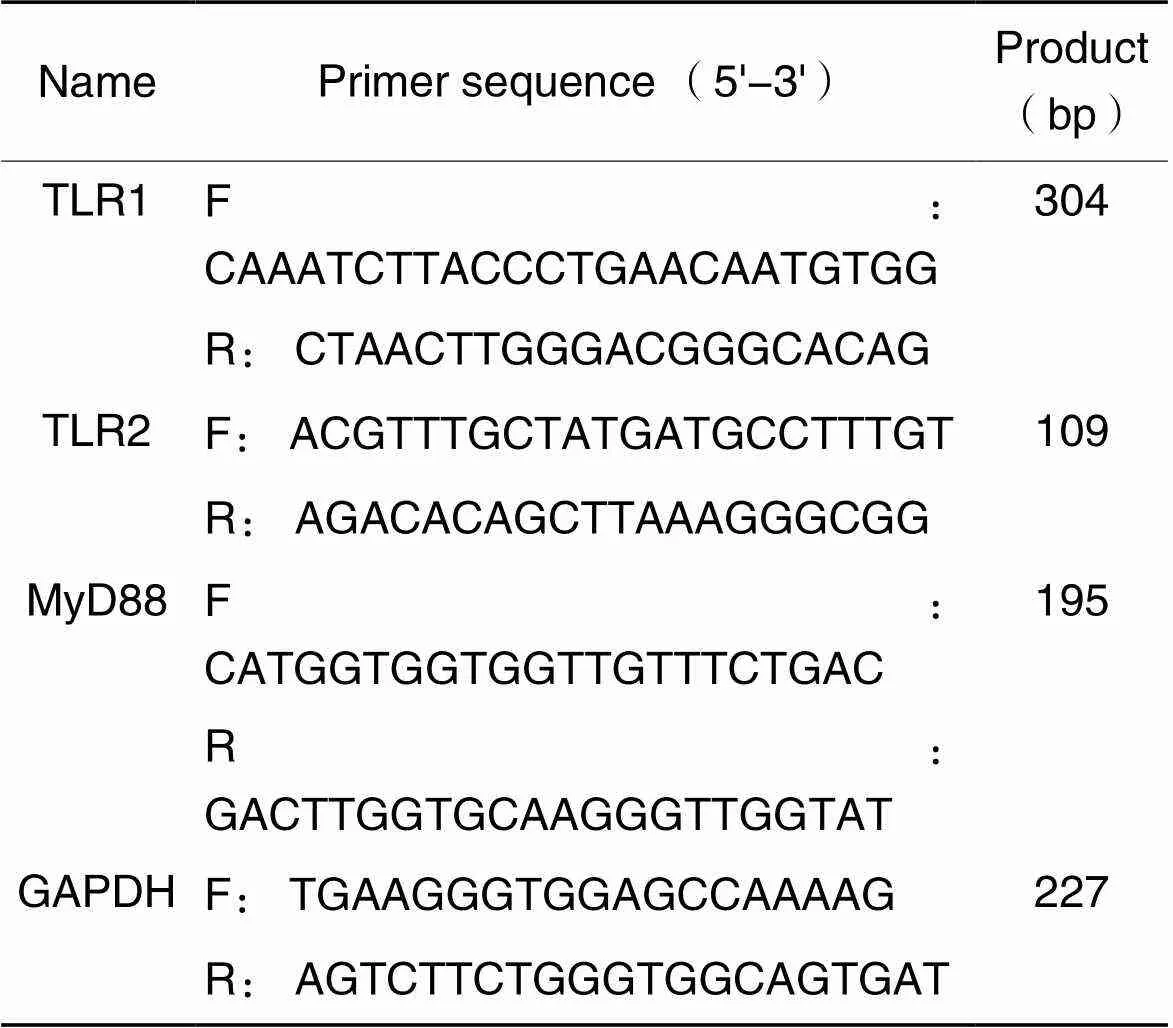
表1 引物序列
F: forward; R: reverse.
2.6Western blot检测细胞TLR1、TLR2和MyD88蛋白的表达取对数生长期的BV2小胶质细胞,以每孔1×105个的密度接种到6孔板中培养。待细胞贴壁后,按对照组、模型组和拮抗剂组予以相应干预,24 h后弃去上清液,PBS清洗3次。每孔加入适量RIPA裂解液,置于冰上裂解30 min,刮下细胞,将细胞与裂解液一起转移到1.5 mL离心管中,置于4 ℃离心机中13 700×离心5 min,收集上清液,使用BCA蛋白质浓度测定试剂盒检测蛋白浓度后加入5×蛋白上样缓冲液,95 ℃水浴5 min,冰上骤冷,然后上样40 μg进行SDS-PAGE分离,湿法转膜,然后用100 mL/L脱脂牛奶室温封闭1 h,TBST洗净牛奶,Ⅰ抗4 ℃孵育过夜。次日弃Ⅰ抗,TBST洗涤3次,每次5 min,然后Ⅱ抗室温孵育30 min,弃Ⅱ抗,TBST洗涤4次,每次5 min,然后用ECL化学发光检测试剂盒显影,凝胶成像系统采集图像,ImageJ软件定量分析图像。
3 统计学处理
采用SPSS 25.0统计软件进行数据分析,GraphPad Prism 8.0软件作图。所有实验数据用均数±标准差(mean±SD)表示。符合正态分布且满足方差齐性的多组间数据比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-检验;符合正态分布但不符合方差齐性则采用Welch近似检验,两两比较采用Games-Howell检验。以<0.05为差异有统计学意义。
结果
1 oAβ对BV2细胞形态的影响
如图1所示,倒置相差显微镜下,对照组细胞呈静息状态,胞体小,呈圆形或椭圆形,突触细长;模型组细胞经oAβ(5 μmol/L)刺激后细胞多数呈激活状态,胞体肥大,呈梭形或杆状,突起减少且回缩变短,形态如类阿米巴样。
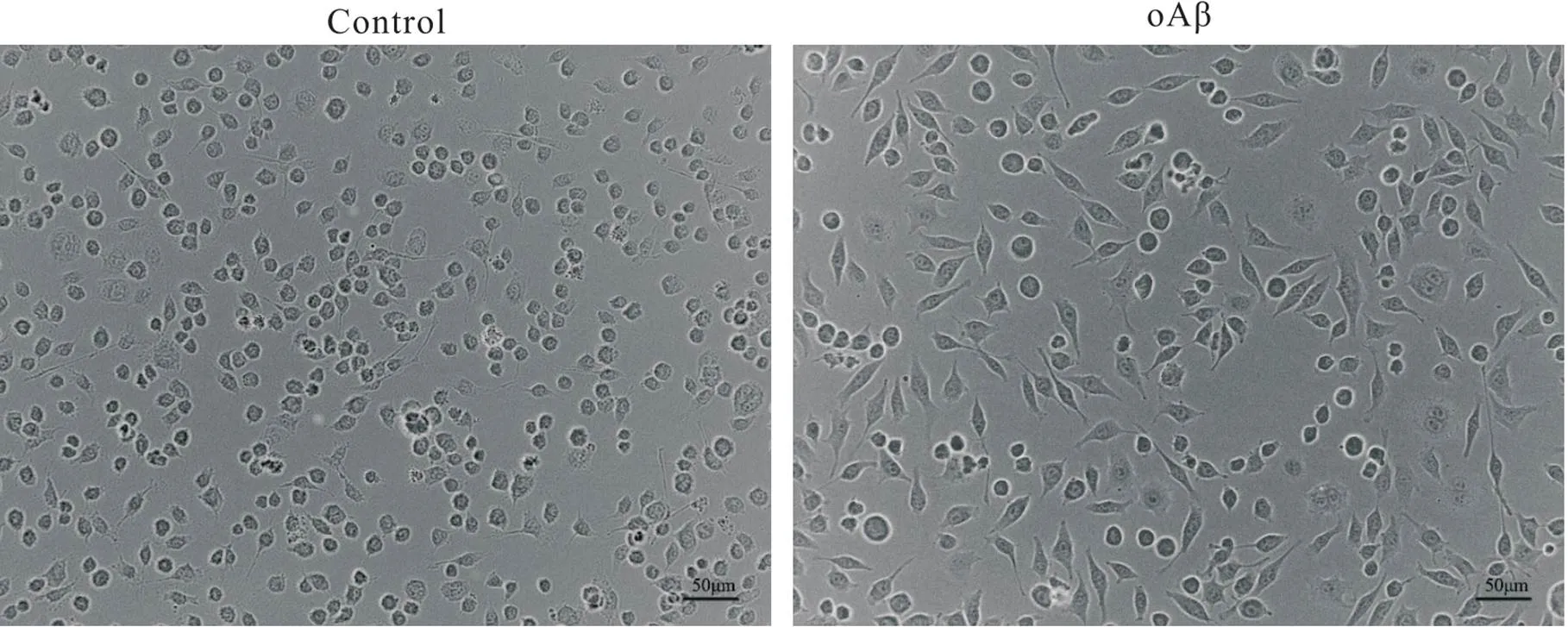
Figure 1. The morphological changes of BV2 cells observed under inverted microscope. The resting BV2 cells were round or oval, and the synapses were long and thin. After 5 μmol/L oAβ stimulation, the activated BV2 cells showed amoeba-like and shortened synapses.
2 oAβ对BV2细胞活力的影响
CCK-8实验结果显示,用不同浓度(0.5、1、5、10和20 μmol/L)的oAβ干预BV2小胶质细胞24 h后,随着oAβ浓度的增加细胞活力逐渐降低,与0 μmol/L oAβ组比较差异均有统计学意义(<0.05),见图2。
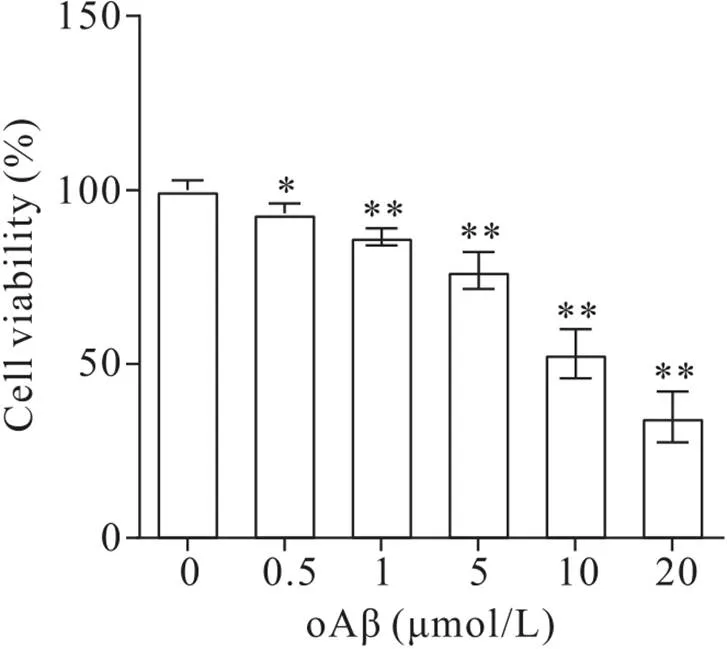
Figure 2. Effect of oAβ on the viability of BV2 cells. Mean±SD. n=5. *P<0.05,**P<0.01 vs 0 μmol/L oAβ group.
3 不同浓度oAβ及CU-CPT22对oAβ诱导的BV2细胞分泌TNF-α、IL-6、IL-4和IL-10的影响
如图3所示,BV2小胶质细胞经不同浓度(0.5、1、5、10和20 μmol/L)的oAβ刺激后,细胞培养上清液中促炎细胞因子TNF-α和IL-6的分泌随着oAβ浓度的增加而升高,而抗炎细胞因子IL-4和IL-10的分泌随着oAβ浓度的增加而降低,且与0 μmol/L oAβ组比较差异均有统计学意义(<0.05或<0.01)。
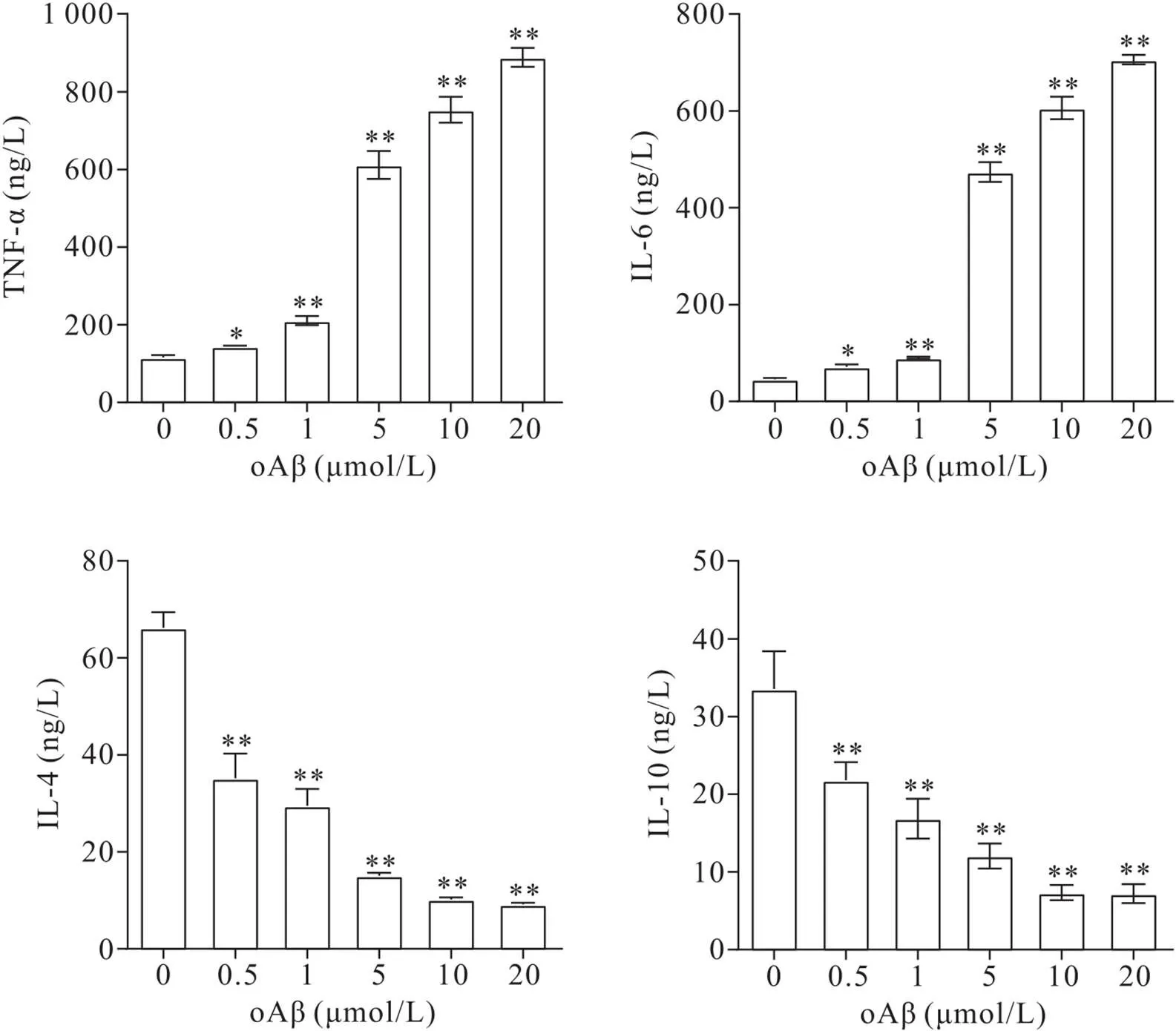
Figure 3. Secretion levels of TNF-α, IL-6, IL-4 and IL-6 in BV2 cells induced by oAβ at different concentrations. Mean±SD. n=3. *P<0.05,**P<0.01 vs 0 μmol/L oAβ group.
根据上述不同浓度oAβ对BV2细胞活力及炎症因子表达的影响结果,选择5 μmol/L为模型组oAβ浓度进行后续实验。如图4、5所示,与对照组相比,模型组TNF-α和IL-6分泌水平显著升高,IL-4和IL-10分泌水平显著降低(<0.01);与模型组相比,拮抗剂组TNF-α和IL-1β分泌水平显著降低(<0.01),IL-4和IL-10分泌水平无显著变化(>0.05)。

Figure 4. Effect of Cu-CPT22 on TNF-α and IL-6 secretion levels in oAβ-induced BV2 cells. Mean±SD. n=3.**P<0.01 vs control group;##P<0.01 vs oAβ group.
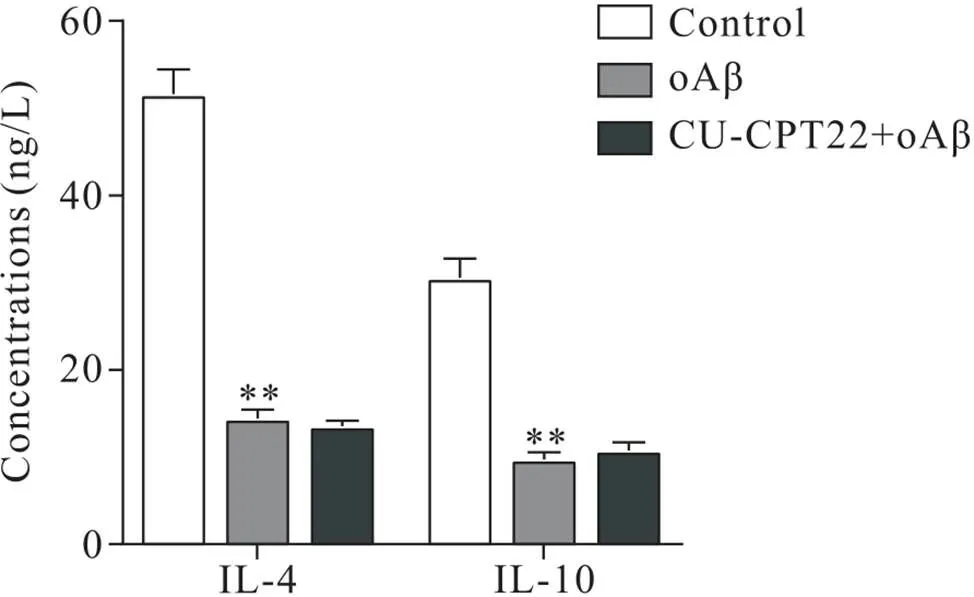
Figure 5. Effect of Cu-CPT22 on IL-4 and IL-10 secretion levels in oAβ-induced BV2 cells. Mean±SD. n=3. **P<0.01 vs control group.
4 CU-CPT22对oAβ诱导的BV2细胞TLR1、TLR2和MyD88 mRNA表达的影响
如图6所示,模型组5 μmol/L oAβ刺激BV2小胶质细胞后TLR1、TLR2和MyD88的mRNA表达较对照组显著升高(<0.01);而加用TLR1/TLR2拮抗剂CU-CPT22预处理后,TLR1、TLR2和MyD88的mRNA表达较模型组显著降低(<0.05)。
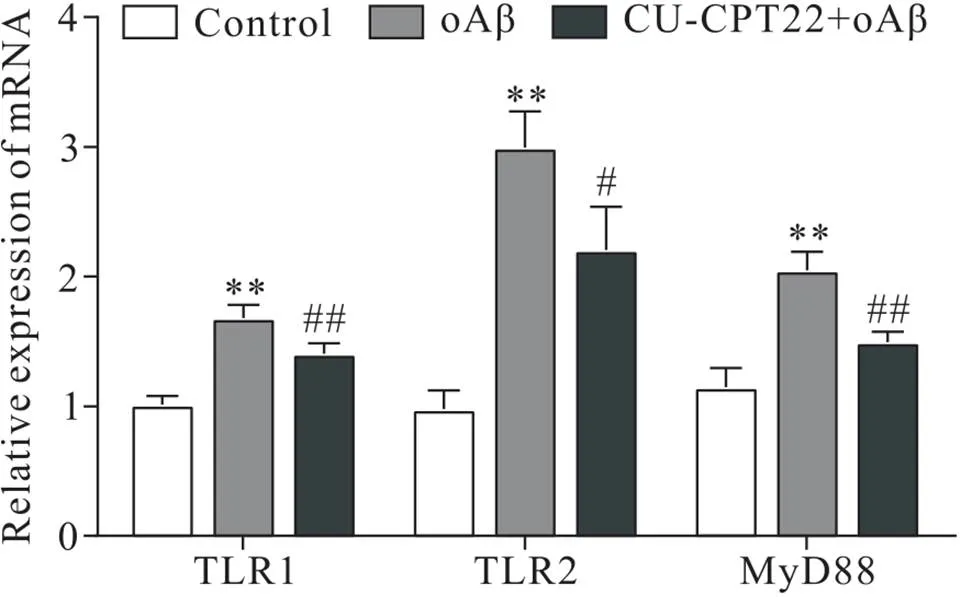
Figure 6. Effects of Cu-CPT22 on mRNA expression of TLR1, TLR2 and MyD88 in oAβ-induced BV2 cells. Mean±SD. n=3. **P<0.01 vs control group;#P<0.05,##P<0.01 vs oAβ group.
5 CU-CPT22对oAβ诱导的BV2细胞TLR1、TLR2和MyD88蛋白表达的影响
如图7所示,模型组5 μmol/L oAβ刺激BV2小胶质细胞后,TLR1、TLR2和MyD88蛋白的表达较对照组显著升高(<0.01);而加用TLR1/TLR2拮抗剂CU-CPT22预处理后,TLR1、TLR2和MyD88蛋白的表达较模型组显著降低(<0.01)。
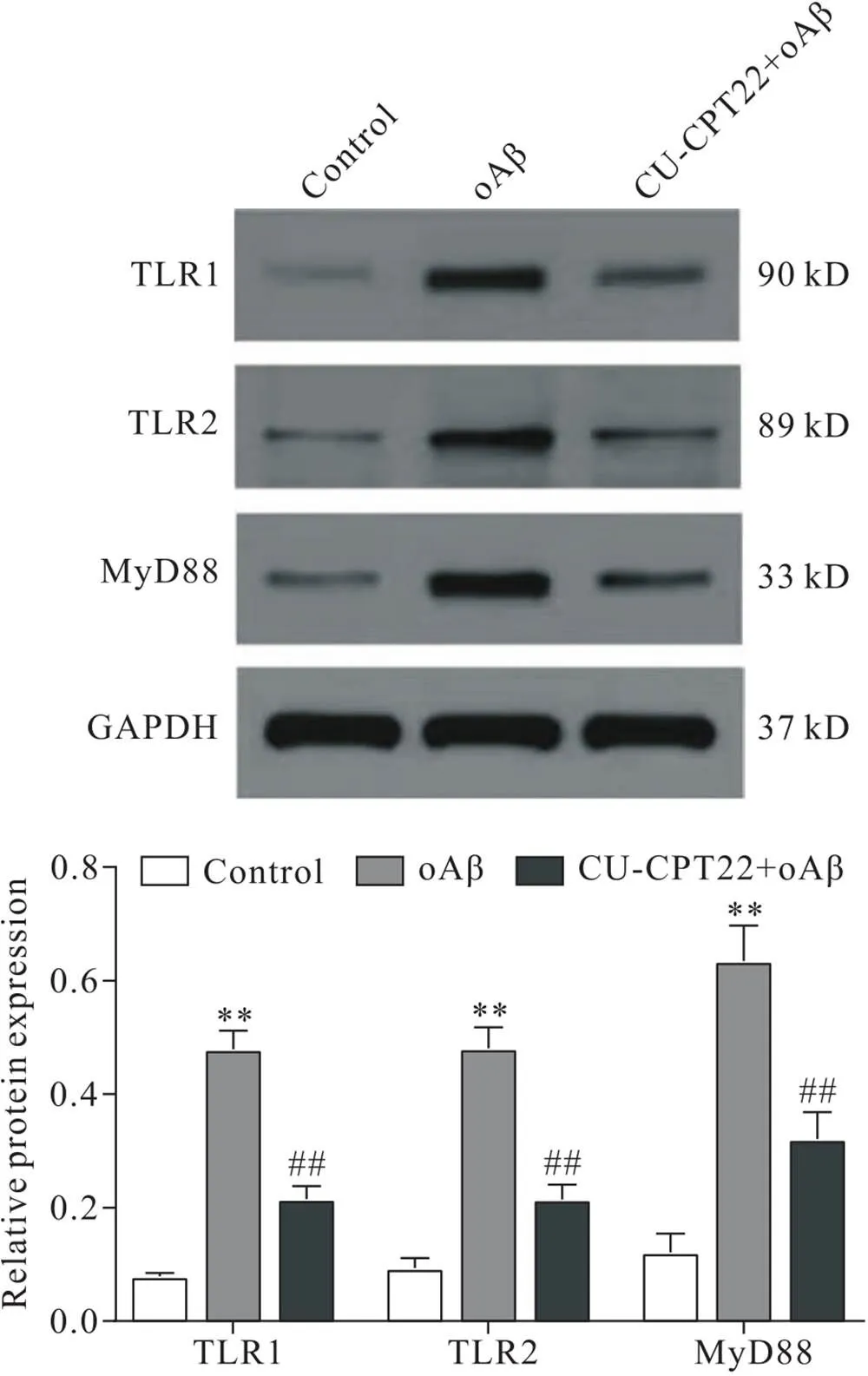
Figure 7. Effects of Cu-CPT22 on protein expression of TLR1, TLR2 and MyD88 in oAβ-induced BV2 cells. Mean±SD. n=3. **P<0.01 vs control group;##P<0.01 vs oAβ group.
讨论
目前研究表明,AD中的神经炎症与小胶质细胞的活化、脑微循环中内皮细胞表达的促炎细胞因子以及穿透血脑屏障的外周炎症均有关,其中小胶质细胞活化被认为是AD神经炎症的主要来源[5]。小胶质细胞作为脑内常驻巨噬细胞,能根据周围环境变化采用不同的功能表型,它通过活化成M1型产生神经毒性促炎介质损伤神经元细胞表现出有害的一面;或者活化成M2型产生抗炎和神经营养因子以及增加淀粉样斑块的清除表现出有益的一面[6]。研究者已在AD脑切片中观察到活化的小胶质细胞围绕着细胞外的Aβ斑块[7]。小鼠实验也证明Aβ斑块、淀粉样肽、原纤维、寡聚体甚至分泌的β-淀粉样前体蛋白的衍生物都可以激活小胶质细胞,导致神经毒性细胞因子的释放[8]。因此本研究选择通过逆转录病毒转染后获得永生化且保留有小胶质细胞形态、表型及各种功能的BV2小胶质细胞系进行研究。而选择可溶性oAβ干预小胶质细胞,是因为与其他形式相比,oAβ被认为对神经细胞毒性最强,与疾病严重程度和认知能力下降水平具有更好的相关性[9]。且众多研究已经证明可溶性oAβ可能通过干扰突触功能,改变钙稳态,增加神经炎症和氧化应激,抑制神经营养因子的形成,并在斑块形成开始前抑制突变小鼠的长时程增强等众多机制影响AD的进展[10]。
本研究结果表明,BV2小胶质细胞促炎细胞因子TNF-α和IL-6的分泌与oAβ浓度呈正相关,而抗炎细胞因子IL-4和IL-10的分泌与oAβ浓度呈负相关,在oAβ为5 μmol/L时上述变化显著,同时oAβ浓度依赖性地降低了BV2小胶质细胞活力,提示随着oAβ浓度的升高,小胶质细胞M1和M2表型比例可能逐渐失衡,分泌促炎因子的M1型比例可能逐渐增大,分泌抗炎因子的M2型比例可能逐渐减小,从而影响到小胶质细胞的活力。当然后期研究中还需要检测更多代表小胶质细胞表型的标志物来明确其极化状态。刘绪华等[11]在相关研究中使用了易于聚集且神经毒性较强的Aβ1-42的活化片段Aβ25-35诱导大鼠原代小胶质细胞,检测到细胞上清液中TNF-α和IL-1β显著升高。狄婷婷等[12]通过对大鼠海马CA1区注射不同浓度的Aβ25-35建立AD动物模型的研究也证实了随着Aβ剂量的增加,促炎症因子TNF-α和IL-1β等释放亦增加。二者涉及体外及体内实验,与本研究有类似的结果,但均未观察抗炎因子的表达情况。
TLR2作为模式识别受体中的一种主要免疫受体,在诱导机体对各种内源性和外源性危险信号的固有免疫应答中发挥了关键作用,能与TLR1形成二聚体,主要通过MyD88依赖通路进行信号转导,增加促炎细胞因子的产生、启动丝裂原活化蛋白激酶级联反应或刺激干扰素调节因子激活[13]。TLR2在AD中存在明显差异性表达,据报道[14],在AD动物模型中,暴露于Aβ导致TLR2 mRNA水平的升高,在AD患者的颞叶皮层和培养的小胶质细胞中也检测到基因上调。Zhang等[15]检测到AD患者外周血单核细胞TLR2表达增加,且AD患者血清中TLR2水平与MMSE评估的大脑功能成负相关,因此认为血清TLR2水平有助于区分AD疾病中痴呆的严重程度或跟踪痴呆的进展,有望成为AD的外周血标志物。此外已有研究表明TLR2主要在小胶质细胞上表达,且与小胶质细胞的活化同步,在AD的发病机制中可能起到有利或有害的双重作用,一方面诱导小胶质细胞吞噬和清除Aβ并产生抗炎因子,以避免神经细胞的损伤,另一方面诱导炎性细胞因子的产生,加重AD相关病理改变[16]。因此特异性靶向TLR2及其下游信号可能成为AD的潜在治疗靶点。
本研究使用RT-qPCR和Western blot检测了oAβ诱导小胶质细胞后TLR1/2-MyD88信号通路相关分子的变化,为了进一步验证该信号通路的作用,我们还使用了特异性靶向TLR1/2的拮抗剂CU-CPT22对细胞进行预处理,结果说明了TLR1/2-MyD88信号通路可能介导了oAβ诱导的小胶质细胞活化及其促炎介质水平的上调,抑制上述通路则可以改善炎症水平。这与Jana等[17]的早期研究结果一致,他们显示无论是用抗转录疗法沉默或用抗TLR2抗体阻断BV2小胶质细胞中的TLR2,还是在敲除了基因的小鼠中分离的小胶质细胞,都能抑制Aβ1-42诱导的促炎分子或小胶质细胞表面的整合素蛋白标志物的表达,且阻断TLR2下游的MyD88也出现同样的结果,随后的体内实验也证明了上述结果,从而充分说明了TLR2信号通路在介导Aβ诱导的小胶质细胞活化及炎症反应中所起的重要作用。然而与本研究的不同之处是他们使用的是Aβ的原纤维形式而非毒性较强的寡聚体形式,另外本研究使用了TLR1/2的二聚体拮抗剂,说明TLR2与TLR1共同作用所介导的炎症改变。此外,研究中使用了TLR1/2拮抗剂后抗炎因子的表达并无显著变化,说明抗炎因子的变化可能与TLR1/2信号通路无关。因此,本课题组后期研究中除了深入探索TLR1/TLR2下游分子机制的同时将进一步探讨抗炎因子变化的机制。
综上所述,oAβ诱导的BV2小胶质细胞活化可浓度依赖性地升高促炎因子但降低抗炎因子的表达,应用TLR1/2抑制剂则可降低oAβ诱导的BV2小胶质细胞TLR1、TLR2和MyD88的mRNA及蛋白表达,并改善促炎介质水平的上调,因此说明了TLR1/2-MyD88信号通路在该过程中发挥重要作用。本研究为靶向TLR1/TLR2信号通路来调控小胶质细胞激活及减少炎症损伤治疗AD提供了实验依据。
[1] Heppner FL, Ransohoff RM, Becher B. Immune attack: the role of inflammation in Alzheimer disease[J]. Nat Rev Neurosci, 2015, 16(6):358-372.
[2] Prinz M, Priller J, Sisodia SS, et al. Heterogeneity of CNS myeloid cells and their roles in neurodegeneration[J]. Nat Neurosci, 2011, 14(10):1227-1235.
[3] An J, Chen B, Kang X, et al. Neuroprotective effects of natural compounds on LPS-induced inflammatory respon-ses in microglia[J]. Am J Transl Res, 2020, 12(6):2353-2378.
[4] Dahlgren KN, Manelli AM, Stine WB, et al. Oligomeric and fibrillar species of amyloid-β peptides differentially affect neuronal viability[J]. J Biol Chem, 2002, 277(35):32046-32053.
[5] Uddin MS, Kabir MT, Al Mamun A, et al. Pharmacological approaches to mitigate neuroinflammation in Alzheimer's disease[J]. Int J Immunopharmaco, 2020, 84:106479.
[6] Colonna M, Butovsky O. Microglia function in the central nervous system during health and neurodegeneration[J]. Annu Rev Immunol, 2017, 35:441-468.
[7] Serrano-Pozo A, Mielke ML, Gómez-Isla T, et al. Reactive glia not only associates with plaques but also parallels tangles in Alzheimer's disease[J]. Am J Pathol, 2011, 179(3):1373-1384.
[8] Yang T, Li S, Xu H, et al. Large soluble oligomers of amyloid β-protein from alzheimer brain are far less neuroactive than the smaller oligomers to which they dissociate[J]. J Neurosci, 2017, 37(1):152-163.
[9] Lue LF, Kuo YM, Roher AE, et al. Soluble amyloid β peptide concentration as a predictor of synaptic change in Alzheimer's disease[J]. Am J Pathol, 1999, 155(3):853-862.
[10] Mucke L, Masliah E, Yu GQ, et al. High-level neuronal expression of Aβ1-42in wild-type human amyloid protein precursor transgenic mice: synaptotoxicity without plaque formation[J]. J Neurosci, 2000, 20(11):4050-4058.
[11] 刘绪华,王孝庆,王中苏,等. 姜黄素减弱Aβ25-35致大鼠原代小胶质细胞的神经炎症反应[J]. 中国病理生理杂志, 2016, 32(9):1635-1641.
Liu XH, Wang XQ, Wang ZS,et al. Curcumin reduces neuroinflammation stimulated by Aβ25-35in primary rat microglial cells[J]. Chin J Pathophysiol, 2016, 32(9):1635-1641.
[12]狄婷婷,张美,王瑞婷,等. Toll样受体-2、核因子-κB在Aβ诱导的阿尔茨海默病中的作用[J]. 中国老年学杂志, 2016, 36(23):5780-5782.
Di TT, Zhang M, Wang RT, et al. The role of Toll-like receptor-2 and nuclear factor-κB in Alzheimer's disease induced by Aβ[J]. Chin J Gerontol, 2016, 36(23):5780-5782.
[13] Ravari A, Mirzaei T, Kennedy D, et al. Chronoinflammaging in Alzheimer; a systematic review on the roles of toll like receptor 2[J]. Life Sci, 2017, 171:16-20.
[14] Caldeira C, Cunha C, Vaz AR, et al. Key aging-associated alterations in primary microglia response to β-amyloid stimulation[J]. Front Aging Neurosci, 2017, 9:277.
[15] Zhang W, Wang LZ, Yu JT, et al. Increased expre-ssions of TLR2 and TLR4 on peripheral blood mononuclear cells from patients with Alzheimer's disease[J]. J Neurol Sci, 2012, 315(1/2):67-71.
[16] Momtazmanesh S, Perry G, Rezaei N. Toll-like receptors in Alzheimer's disease[J]. J Neuroimmunol, 2020, 348:577362.
[17] Jana M, Palencia CA, Pahan K. Fibrillar amyloid-beta peptides activate microglia via TLR2: implications for Alzheimer's disease[J]. J Immunol, 2008, 181(10):7254-7262.
Effects of amyloid β-protein 1-42 oligomer on inflammatory response of BV2 microglia and its mechanism
LIU Xin1, WANG Jun-li2, SUN Yi-xuan1, ZHANG Zhong-wen2, MEI Jun-hua2, CHEN Guo-hua1, SHAO Wei2△
(1,,430065,;2,,430022,)
To investigate the effect of amyloid β-protein 1-42 oligomer (oAβ) on the inflammatory response of BV2 microglia and its possible mechanism.After oAβ preparation, BV2 microglia were incubated with oAβ at different concentrations (0, 0.5, 1, 5, 10 and 20 μmol/L) for 24 h, and the cell morphological changes were observed by inverted phase-contrast microscopy. The cell viability was detected by CCK-8 method. The secretion levels of tumor necrosis factor-α (TNF-α), interleukin (IL)-6, IL-4 and IL-10 in supernatant of cell culture were determined by ELISA. Furthermore, the BV2 microglia were divided into control group, model group and antagonist group. The cells in model group were treated with oAβ at 5 μmol/L, and those in antagonist group were supplemented with 10 μmol/L CU-CPT22, a Toll-like receptor 1 (TLR1)/TLR2 antagonist, on the basis of model group. The mRNA and protein expression levels of TLR1, TLR2 and myeloid differentiation factor 88 (MyD88) were detected by RT-qPCR and Western blot. The secretion levels of TNF-α, IL-6, IL-4 and IL-10 in cell culture supernatants were determined by ELISA.The viability of BV2 microglia decreased, the secretion levels of TNF-α and IL-6 increased, and the secretion levels of IL-4 and IL-10 decreased with the increase in oAβ concentration. Compared with 0 μmol/L oAβ group, there were statistically significant differences (0.05). Compared with control group, the mRNA and protein expression levels of TLR1, TLR2 and MyD88 in model group were significantly increased (<0.01), the secretion levels of TNF-α and IL-6 were significantly increased (<0.01), and the secretion levels of IL-4 and IL-10 were significantly decreased (<0.01). Compared with model group, the mRNA and protein expression levels of TLR1, TLR2 and MyD88 in antagonist group were significantly decreased (0.05), the secretion levels of TNF-α and IL-6 were significantly decreased (<0.01), while the secretion levels of IL-4 and IL-10 were not significantly different (>0.05).The oAβ may induce the activation of BV2 microglia through TLR1/2-MyD88 signaling pathway, and then up-regulate the levels of pro-inflammatory mediators.
Alzheimer disease; Amyloid β-protein 1-42 oligomer; Microglia; TLR1/2-MyD88 signaling pathway
R363; R392; R749.1+6
A
10.3969/j.issn.1000-4718.2022.06.004
1000-4718(2022)06-0986-07
2021-10-12
2022-01-06
国家自然科学基金面上项目(No. 81673914);2020年武汉市应用基础前沿项目(No. 2020020601012302);武汉市卫生健康委青年项目(No. WZ21Q08)
Tel: 15337114645; E-mail: shaowei74@126.com
(责任编辑:余小慧,李淑媛)

