脐带间充质干细胞培养上清液对食管鳞癌细胞球的影响
间充质干细胞(mesenchymal stem cells,MSCs)是一种具有强大分泌功能的多能干细胞,显著的组织修复功能和广泛的免疫调节功能使其研究热度在近年来不断增加。尽管MSCs具有良好的临床应用潜力,但MSCs回输是否会促进肿瘤发生和发展仍有争议,而且有较多报道建立在对肿瘤细胞进行传统二维(2D)培养的基础上,这种培养方法与体内细胞生存环境有明显差异。三维(3D)细胞培养技术被认为可以使细胞在更接近生态位的环境中生长,利于其生理形态和功能的维持,在3D培养条件下进行的实验也能更好地模拟其体内生长过程。本研究建立了食管鳞癌(esophageal squamous cell carcinoma,ESCC)细胞系KYSE450的3D成球培养方法,同时观察了不同浓度脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)培养上清液对其成球的影响,为MSCs在临床的进一步应用垫定理论基础。
1 材料与方法
EliteGro
-Adv(NHR010059,Biomedical EliteCell Corp)、MSCBM培养基(MSC12104,达优)、RMPI-1640培养基(Biological Industries)、Y-27632(hydrochloride,PeproTech)、Matrigel(BD)、胎牛血清(Gibco)、0.25%胰蛋白酶/EDTA(T1320,索莱宝)、高内涵成像系统(Molecular Devices,IXM-c)。
UCMSCs为郑州大学第二附属医院医学研究中心实验室自主分离所得,符合国际公认的MSCs鉴定标准,使用通过了我院伦理委员会批准(伦理批号:2022098)。UCMSCs使用无血清培养基常规培养。
KYSE450来自郑州大学第二附属医院医学研究中心。对冻存细胞进行复苏及培养,选取生长状态良好的细胞胰酶消化计数备用。利用本课题组建立的类器官培养方法进行体外ESCC细胞系KYSE450成球培养。具体方法:KYSE450细胞用Matrigel(冰上操作,4 ℃以下为液态)重悬,预冷枪头将含有细胞的胶体迅速接种在96孔板中,每孔约5 μl。将96孔板在培养箱中放置30 min,待Matrigel固化后加入100 μl含Y27632的类器官培养基(organoid medium,OM)。OM使用市售的DMEM/F12培养基,在其中加入生长因子,包括EGF、R-spondin 1、Noggin等。培养过程中每隔48 h更换培养基,同时使用高内涵成像系统每24 h对96孔板中的肿瘤细胞进行拍照。
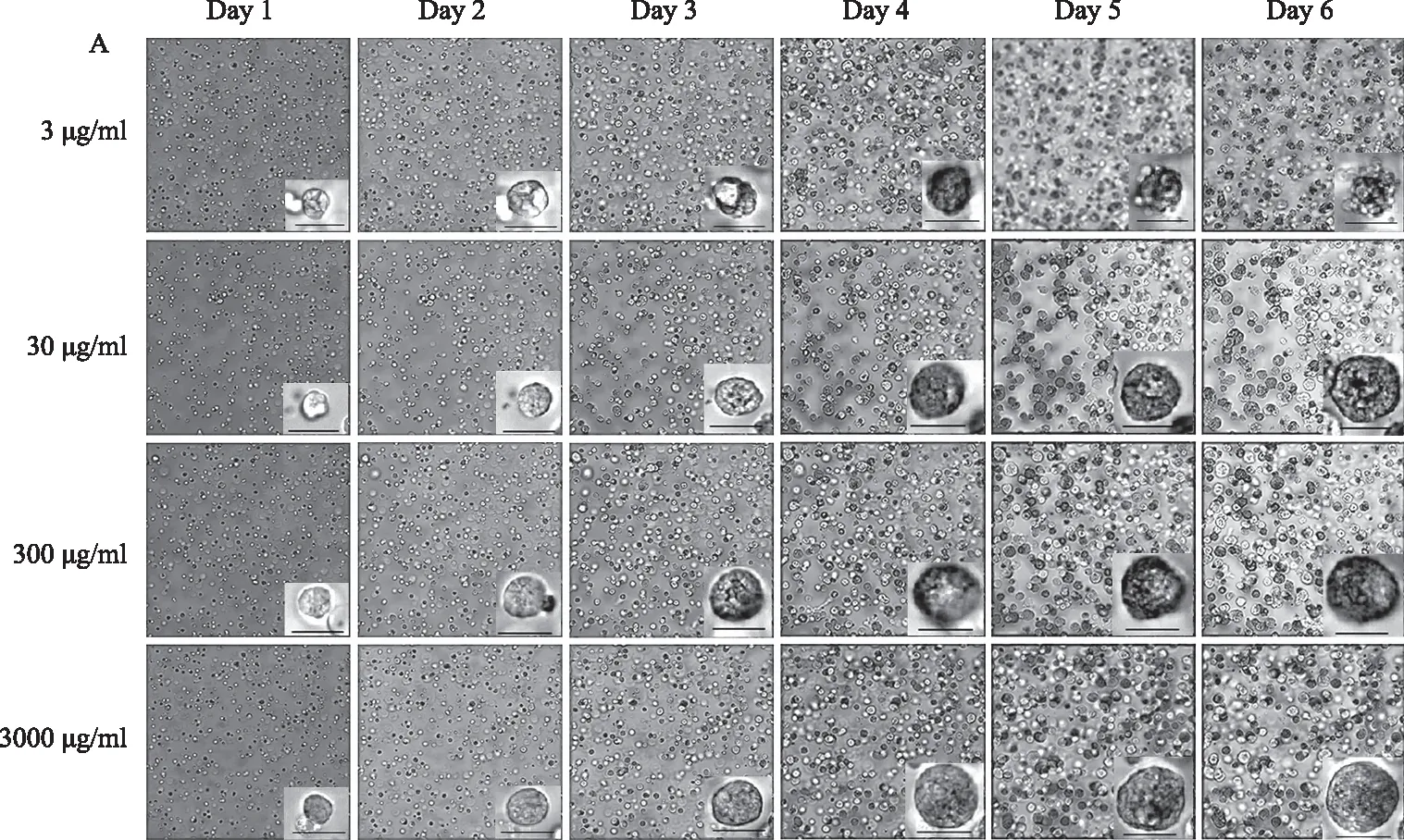
将复苏的原代UCMSCs常规培养至P3并收集培养上清液,用透析袋透析脱盐,上清液和灭菌去离子水的比例1∶100,换水3次,透析24 h,随后将透析后的上清液用冻干机去除水分,获得冻干粉(-20 ℃保存备用)。用PBS配制冻干粉浓缩液,按照不同比例加入OM培养基中,使上清液冻干粉终浓度分别为3 000 μg/ml、300 μg/ml、30 μg/ml、3 μg/ml。KYSE450接种于96孔板当天记为Day 0,单一使用OM培养24 h后加入含不同浓度上清液的OM培养基。用高内涵成像系统观察各浓度组的细胞成球情况并拍照,利用系统自带工具测量肿瘤细胞球直径。
T表示协同集聚对区域经济增长的总效应,当ln innit>1.081时,T>0,说明只有在技术创新能力达到一定值 (1.081)时,协同集聚才会对区域经济增长产生正向影响,如果创新能力低于1.081,协同集聚的区域经济效应为负。通过对ln inn的403个观察值进行排序,发现只有武汉和长沙在2005~2017年内ln inn全都大于1.081,说明这两个城市的协同集聚对区域经济增长的总效应始终为正。而发展相对落后的城市,如上饶、吉安、抚州等城市的ln inn在考察期内从未超过1.081这一门槛,说明这些城市协同集聚对经济增长的总效应一直为负。
2 结果
本研究在前期实验中测得生理状态UCMSCs上清液浓度约3 000 μg/ml,是细胞生长过程中的最大生理浓度,因此,本实验将上清液最大浓度设定为该浓度。随着培养时间的增加,不同浓度组的细胞球直径逐渐增大(见图2A)。Day 1~Day 5不同浓度组的细胞球直径均有增加,Day 6除3 000 μg/ml组外,其余各组细胞球均出现崩解,OM组崩解程度较高(见图2B)。Day 6后对3 000 μg/ml组继续培养,细胞球在培养第12天仍能保持完整形态(见图2C)。
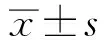
Vector Informatik GmbH公司成立于1988年,总部位于德国斯图加特。Vector是全球领先的分布式系统开发工具、网络节点测试验证工具和嵌入式软件组件供应商,为汽车电子电气系统设计,总线网络的设计、建模、仿真、分析、测试以及ECU的开发、测试、标定和诊断等过程提供一系列强有力的软硬件工具和源代码,支持CAN、LIN、MOST、FlexRay、以太网、SAEJ1939、OSEK/VDX和AUTOSAR等多种总线、协议和标准。
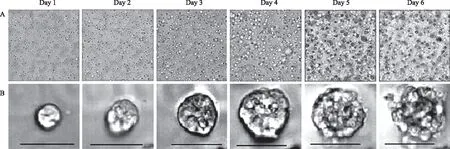
使用高内涵成像系统对固定视野采集图像,结果显示,Day 1有少量距离接近的细胞汇合成球,单个细胞可通过分裂成球。随后可见肿瘤细胞球直径逐渐增大,球体的边缘光滑清晰,折光性强,内部细胞生长紧凑;Day 5及以后大部分球体发生崩解,边缘凹凸不平,球体内部结构松散,少量细胞从球体中脱落(见图 1)。
Day 2和Day 5时3 000 μg/ml组的细胞球直径大于OM组(
=0.014,
=0.031)。Day 6时3 000 μg/ml组直径大于其余各组,并与OM组、30 μg/ml组、3 μg/ml组的差异具有统计学意义(
=0.000、
=0.007、
=0.001);OM组细胞球直径则小于其余各组,且与3 000 μg/ml组、300 μg/ml组、30 μg/ml组差异显著(
=0.000、
=0.000、
=0.008)。
3 讨论
尽管MSCs在组织损伤修复、免疫相关疾病中表现出了明确的疗效,但MSCs与肿瘤之间的相互作用,尤其是MSCs细胞移植治疗对肿瘤患者的影响,仍存在争议。肿瘤分泌细胞因子募集MSCs,而MSCs分泌CXCL12/CXCR4环路相关因子也能促使其自身向肿瘤迁移
。MSCs对肿瘤的作用与该治疗方法的安全性有关,有研究表明,MSCs参与了肿瘤微环境(tumor microenvironments,TMEs)的构成
,并通过旁分泌和分化作用调节肿瘤进程;MSCs还可通过抑制免疫、分化为肿瘤相关基质细胞(tumor-associated stromal cells,TASCs)、促进肿瘤干细胞生长、诱导肿瘤抗凋亡、血管生成及上皮-间质转化(epithelial-to-mesenchymal transition,EMT)等过程来促进肿瘤生长
。大量体内外实验结果显示,多种成体来源的MSCs(脂肪、骨髓、脐带、胎盘等)可以促进肿瘤细胞生长,包括结肠癌
、乳腺癌
、胰腺癌
、前列腺癌
等。但这些结果多建立在2D培养细胞实验的基础上,无法准确地模拟体内作用。肿瘤细胞在2D环境中的生长状态与3D环境相差较明显,在2D培养模式下进行的细胞实验仅是针对单一细胞群,忽视了肿瘤的立体结构和微环境,研究发现,3D培养在一定程度上可以模拟天然组织中细胞与细胞外基质(extracellular matrix,ECM)的相互作用,这在干细胞培养和分化癌生物学,药物和毒性筛选及组织工程中意义重大
。目前,3D模式的肿瘤成球培养及类器官培养越来越多地被应用到了科研中
。
《鲁迅先生石膏面型》《鲁迅先生塑像》这两件作品还有个现象耐人寻味。为逝者塑像是人类一种古老的视觉信仰。但是出于对死者的尊重和遗容的保护,在这种情形中死者画像的观者一般仅局限于家族成员或故交旧友范围内,同时它的传播也限于宗庙墓室、厅堂居室等特定的相对封闭的空间里,由此产生的画像数量相对有限,更不可能大量复制和广泛传播。但是,两件鲁迅雕塑《鲁迅先生石膏面型》《鲁迅先生塑像》分别于当年的11月、12月公开发表在《作家》第2卷第2号、《文季月刊》第2卷第1号上。那么,到底是谁要公开传播鲁迅的遗容呢?
为了探索UCMSCs上清对KYSE450细胞球形成和发展的影响,本研究在对KYSE450进行3D成球培养过程中加入了不同浓度的UCMSCs培养上清液冻干粉。冻干粉可以减少上清中盐浓度对后续实验的影响,只保留上清液中主要的蛋白质成分。此外,冻干粉可以配制高浓度的上清浓缩液,便于观察不同浓度的上清液对肿瘤细胞成球的影响,且排除了OM培养基因体积增加被稀释,从而影响细胞成球的可能。既往研究认为,在成球培养中,由于单个细胞可经过增殖形成细胞球,故球体总数的变化并不显著
,本研究在预实验中也观察到了类似现象。因此,实验中仅对肿瘤细胞球的直径进行了统计。在整个培养过程中,最高浓度组的细胞球直径较其他组更大,部分细胞球在培养第12天仍能保持完整形态。Dhiman等在其研究中对A459进行了微流控3D培养,加入间充质干细胞条件培养基后培养的5 d时间里,A459细胞球的平均直径增加了15.7%,直径和增长速度显著大于单一培养组
。另有研究发现,将肿瘤相关MSCs与A459共培养后,A459形成的细胞球形态最完美且随着培养时间增加而更紧密
。也有研究发现,加入骨髓间充质干细胞后3D肿瘤微球在第1天就表现出了高度紧凑的形态,培养过程中球体致密程度大于无BMSCs组
。这些结果与我们的研究结果一致。由此可见,UCMSCs培养上清液对ESCC细胞系KYSE450的体外成球具有促进作用,尤其是对细胞球大小和球体维持时间上有促进作用。
[1]Quante M, Tu SP, Tomita H, et al. Bone marrow-derived myofibroblasts contribute to the mesenchymal stem cell niche and promote tumor growth [J]. Cancer Cell, 2011, 19(2): 257-272. DOI: 10.1016/j.ccr.2011.01.020.
[2]Menon LG, Picinich S, Koneru R, et al. Differential gene expression associated with migration of mesenchymal stem cells to conditioned medium from tumor cells or bone marrow cells [J]. Stem Cells, 2007, 25(2): 520-528. DOI: 10.1634/stemcells.2006-0257.
[3]Li P, Gong Z, Shultz LD, et al. Mesenchymal stem cells: from regeneration to cancer [J]. Pharmacol Ther, 2019, 200: 42-54. DOI: 10.1016/j.pharmthera.2019.04.005.
[4]Rahmatizadeh F, Gholizadeh-Ghaleh Aziz S, Khodadadi K, et al. Bidirectional and opposite effects of naïve mesenchymal stem cells on tumor growth and progression [J]. Adv Pharm Bull, 2019, 9(4): 539-558. DOI: 10.15171/apb.2019.063.
[5]Wu XB, Liu Y, Wang GH, et al. Mesenchymal stem cells promote colorectal cancer progression through AMPK/mTOR-mediated NF-κB activation [J]. Sci Rep, 2016, 6: 21420. DOI: 10.1038/srep21420.
[6]Kucerova L, Skolekova S, Matuskova M, et al. Altered features and increased chemosensitivity of human breast cancer cells mediated by adipose tissue-derived mesenchymal stromal cells [J]. BMC Cancer, 2013, 13: 535. DOI: 10.1186/1471-2407-13-535.
[7]Cousin B, Ravet E, Poglio S, et al. Adult stromal cells derived from human adipose tissue provoke pancreatic cancer cell death both in vitro and in vivo [J]. PLoS One, 2009, 4: e6278. DOI: 10.1371/journal.pone.0006278.
[8]Cavarretta IT, Altanerova V, Matuskova M, et al. Adipose tissue-derived mesenchymal stem cells expressing prodrug-converting enzyme inhibit human prostate tumor growth [J]. Mol Ther, 2010, 18(1): 223-231. DOI: 10.1038/mt.2009.237.
[9]Edmondson R, Broglie JJ, Adcock AF, et al. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors [J]. Assay Drug Dev Technol, 2014, 12(4): 207-218. DOI: 10.1089/adt.2014.573.
[10]Gao D, Vela I, Sboner A, et al. Organoid cultures derived from patients with advanced prostate cancer [J]. Cell, 2014, 159(1): 176-187. DOI: 10.1016/j.cell.2014.08.016.
[11]Dhiman N, Shagaghi N, Bhave M, et al. Selective cytotoxicity of a novel trp-rich peptide against lung tumor spheroids encapsulated inside a 3D microfluidic device [J]. Adv Biosyst, 2020, 4(4): e1900285. DOI: 10.1002/adbi.201900285.
[12]Dhiman N, Shagaghi N, Bhave M, et al. Indirect co-culture of lung carcinoma cells with hyperthermia-treated mesenchymal stem cells influences tumor spheroid growth in a collagen-based 3-dimensional microfluidic model [J]. Cytotherapy, 2021, 23(1): 25-36. DOI: 10.1016/j.jcyt.2020.07.004.
[13]Yan C, Chang J, Song X, et al. Lung cancer-associated mesenchymal stem cells promote tumor metastasis and tumorigenesis by induction of epithelial-mesenchymal transition and stem-like reprogram [J]. Aging (Albany NY), 2021, 13(7): 9780-9800. DOI: 10.18632/aging.202732.
[14]Ferreira LP, Gaspar VM, Mano JF. Bioinstructive microparticles for self-assembly of mesenchymal stem cell-3D tumor spheroids [J]. Biomaterials, 2018, 185: 155-173. DOI: 10.1016/j.biomaterials.2018.09.007.

