槲皮素对急性脑出血大鼠神经功能恢复的作用及对PKC/ERK信号通路的影响
李建波,耿炜,周涛,张钧,朱立艳,李晓蕾,张倩,刘吉祥,李晓鹏
急性脑出血是一种常见急危重症,属于非外伤性的脑实质出血,具有较高致残率、病死率[1]。急性脑出血主要病理过程为脑实质内血液快速蓄积,致颅内压增高、脑组织损伤,病死患者多出现在发病后两天内,50%~70%存活者可遗留不同程度神经功能损伤[2]。因此,探寻急性脑出血有效治疗方法,以控制病情,减轻神经功能损伤,改善预后,具有重要意义。传统医学认为,血瘀贯穿急性脑出血发生发展始终,且为脑出血后各种病理生理变化重要机制之一,需自活血化瘀方向加强辩证施治[3]。槲皮素是一种天然黄酮类化合物,广泛分布于自然界各类植物花、叶中[4]。既往研究显示,槲皮素可活血化瘀,具有抗氧化、抗炎、改善血液循环等作用,可减轻神经损伤[5]。目前,就槲皮素对急性脑出血神经功能恢复影响及具体作用机制报道仍不多。本研究开展动物实验,重点分析槲皮素对急性脑出血大鼠神经功能恢复的作用,并探讨其作用机制。现报告如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 50只SPF级SD大鼠(雄性,8周龄),体质量(300±10)g,购自北京富豪实验动物养殖中心[许可证号:SCXK(京)2019-0015]。购入后保持环境通风,温度(22±2)℃,湿度55%~60%,适应性喂养7 d。本实验符合“3 R”标准,经邯郸市第一医院动物伦理委员会批准。
1.1.2 药物、试剂和仪器 槲皮素(纯度≥98%,四川省维克奇生物科技有限公司),磷酸化蛋白激酶C(protein kinase C,PKC)激动剂佛波醇酯(上海康成生物工程有限公司)。Ⅶ型胶原酶(美国Sigma公司),白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒(北京东亚生物技术研究所),原位末端脱氧核苷酸转移酶标记(terminal deoxynucleoitidy transferase mediated nick end labeling,TUNEL)试剂盒(上海泽叶生物有限公司),苏木精-伊红(hematoxylin-eosin staining,HE)试剂盒(美国Genmed公司),兔抗大鼠PKC、磷酸化PKC(phosphorylate-PKC,p-PKC)、胞外信号调节蛋白激酶1/2(extracellular-regulated kinase1/2,p-ERK1/2)、磷酸化ERK1/2(phosphorylate-ERK1/2,p-ERK1/2)一抗及山羊抗兔IgG二抗(武汉博士德生物工程有限公司)。DG5031酶联免疫酶标仪(华东电子医疗公司),LV150光学显微镜(日本Nikon株式会社),GelDoc凝胶成像系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 建模及分组 随机取10只大鼠作为A组,剩余大鼠参照文献方法进行建模[5],术前禁食12 h,禁水6 h。大鼠腹腔注射2%戊巴比妥钠(50 mg/kg)进行麻醉,俯卧位固定于立体定位仪。颅骨暴露,穿刺点为前囟后0.2 mm、向左3 mm处。以牙科钻垂直钻穿露骨,经钻孔点缓慢注入2.5 μL Ⅶ型胶原酶,留针5 min,推针,缝合。大鼠麻醉清醒后,采用神经功能缺陷评分(neurological severity scores,NSS)评估神经功能损伤情况[6]:可正常活动,神经功能无异常,计0分;瘫痪侧前肢无法充分伸展,计1分;活动时向瘫痪侧旋转,计2分;活动时向瘫痪侧倾倒,计3分;不能自发行走,意识丧失,计4分。得分1~3分为建模成功。40只大鼠建模成功34只,成功率为85.0%。34只大鼠随机分为B组、C组、D组、E组,分别纳入8只、8只、9只、9只。A组术中注入与Ⅶ型胶原酶等量的生理盐水,其余操作同上,作为对照。
1.2.2 给药方法 建模成功后1 h后,参照文献用量[7],E组腹腔注射含75 mg/kg槲皮素的生理盐水1 mL,D组腹腔注射含75 mg/kg槲皮素+10 μL/kg PKC激动剂佛波醇酯混合液的生理盐水1 mL,B组腹腔注射含10 μL/kg PKC激动剂佛波醇酯的生理盐水1 mL,A组、C组以1 mL生理盐水腹腔注射,1次/d,连续给药4周。
1.2.3 组织取材 各组治疗完成后24 h,以NSS评分评估神经功能损伤,判断神经功能恢复情况。处死大鼠,各组分别随机取4只脑组织,分为4份。其中2份置于4%多聚甲醛固定,2份置于液氮保存。各组剩余大鼠中随机取4只,剥取完整脑组织,放置在干净滤纸上,去除脑组织表面渗液、血迹,称重,以此为湿重。随后将脑组织置于60 ℃烘箱烘烤,共48 h,称重,以此为干重。以干湿法检测脑组织湿重/干重(wet/dry weight ratio,W/D)值。
1.2.4 ELISA法检测IL-6、TNF-α水平 取1份液氮保存的脑组织,生理盐水冲洗,用组织捣碎机研磨制成10%组织匀浆,10 000 r/min在4 ℃条件下离心15 min,取上清。按照ELISA试剂盒说明书准备样品、抗体包被、封闭、加样、加入酶标抗体、显色,终止反应后观察酶标仪450 nm处吸光值,绘制标准曲线,计算样本中IL-6、TNF-α水平。
1.2.5 免疫荧光TUNEL/Neun双染法检测神经细胞凋亡检测 取1份4%多聚甲醛固定脑组织,石蜡包埋,切片,厚度4 μm,脱蜡至水,PBS洗涤,蛋白酶K 37 ℃消化15 min,PBS洗涤,滴加TDT+DIG-UTP混合液孵育2 h,PBS洗涤,加入封闭液37 ℃封闭30 min,加入Neun抗体4 ℃过夜,PBS洗涤,加入荧光二抗37 ℃孵育30 min。荧光显微镜下观察神经元凋亡情况。凋亡率=TUNEL阳性细胞数/Neun阳性细胞数×100%。
1.2.6 HE染色观察脑组织病理形态学检测 取1份4%多聚甲醛固定脑组织,常规脱水、透明、包埋、切片(厚度4 μm)、烤片,二甲苯脱蜡、水洗,苏木精染色5 min,1%盐酸酒精分化,伊红染色3 min。再次脱水、透明,中性树胶封片,光镜下观察。
1.2.7 Western blot检测蛋白相对表达量 取1份液氮保存脑组织,加入RIPA裂解液冰上裂解,10 000 r/min 4 ℃条件下离心10 min,取上清液。BCA法蛋白定量,100 ℃水浴使蛋白变性。SDS-PAGE凝胶电泳,转至PVDF膜,用含有5%脱脂奶粉的封闭液封闭1 h。加1∶1 000稀释的PKC、p-PKC、ERK1/2、p-ERK1/2、β-actin一抗,4 ℃孵育过夜,TBST洗膜,加1∶2 500稀释的二抗,室温孵育2 h。TBST洗膜。ECL显影,Image J软件分析蛋白条带,计算目的蛋白相对表达水平。
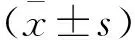
2 结 果
2.1 神经功能 A组NSS评分为0,B组、C组、D组和E组NSS评分分别为(2.78±0.14)分、(2.39±0.12)分、(2.01±0.13)分、(1.46±0.12)分,与B组比较,C组、D组、E组NSS评分降低(P<0.05);与C组比较,D组、E组NSS评分降低(P<0.05);与D组比较,E组NSS评分降低(P<0.05)。
2.2 W/D值 A组、B组、C组、D组和E组W/D值分别为(3.21±0.15)、(5.62±0.21)、(4.91±0.21)、(4.64±0.15)、(4.22±0.14),各组W/D值比较,差异有统计学意义(P<0.05)。与A组比较,B组、C组、D组、E组W/D值升高(P<0.05);与B组比较,C组、D组、E组W/D值降低(P<0.05);与C组比较,D组、E组W/D值降低(P<0.05);与D组比较,E组W/D值降低(P<0.05)。
2.3 IL-6、TNF-α水平 各组IL-6、TNF-α水平比较,差异有统计学意义(P<0.05)。与A组比较,B组、C组、D组、E组IL-6、TNF-α水平升高(P<0.05);与B组比较,C组、D组、E组IL-6、TNF-α水平降低(P<0.05);与C组比较,D组、E组IL-6、TNF-α水平降低(P<0.05);与D组比较,E组IL-6、TNF-α水平降低(P<0.05)。见图1。

与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05;与D组比较,dP<0.05
2.4 神经细胞凋亡 A组、B组、C组、D组、E组细胞凋亡率分别为(8.52±2.21)%、(72.15±2.98)%、(60.65±2.92)%、(35.15±2.78)%、(15.74±2.42)%。各组神经细胞凋亡率比较,差异有统计学意义(P<0.05)。与A组比较,B组、C组、D组、E组神经细胞凋亡率升高(P<0.05);与B组比较,C组、D组、E组神经细胞凋亡率降低(P<0.05);与C组比较,D组、E组神经细胞凋亡率降低(P<0.05);与D组比较,E组神经细胞凋亡率降低(P<0.05)。见图2。

图2 各组脑组织神经细胞凋亡(TUNEL/Neun荧光双染,×400)
2.5 脑组织病理形态学 HE染色显示,A组脑组织神经细胞数目较多,形态结构清晰,排列规整。B组、C组神经细胞结构紊乱,神经元数目减少,细胞核碎裂,其中B组异常变化更为显著。与B组、C组比较,D组、E组神经细胞结构、神经元数目、细胞核等形态异常有所改善,其中E组改善更显著。见图3。
图3 各组脑组织病理形态学(HE染色,×400)
2.6 PKC、p-PKC、ERK1/2、p-ERK1/2蛋白相对表达量 各组p-PKC、p-ERK1/2蛋白相对表达量比较,差异有统计学意义(P<0.05);各组PKC、ERK1/2蛋白相对表达量比较,差异无统计学意义(P>0.05)。与A组比较,B组、C组、D组、E组p-PKC、p-ERK1/2蛋白相对表达量升高(P<0.05);与B组比较,C组、D组、E组p-PKC、p-ERK1/2蛋白相对表达量降低(P<0.05);与C组比较,D组、E组p-PKC、p-ERK1/2蛋白相对表达量降低(P<0.05);与D组比较,E组p-PKC、p-ERK1/2蛋白相对表达量降低(P<0.05)。见图4、图5。
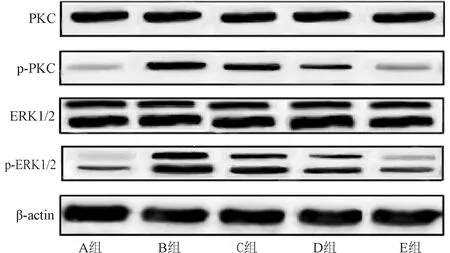
图4 各组蛋白表达免疫印迹检测
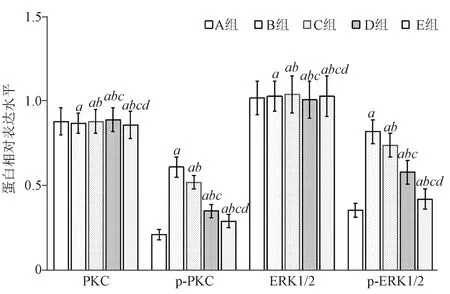
与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05;与D组比较,dP<0.05
3 讨 论
脑出血是一种常见脑卒中类型,急性期病死率较高,达30%~40%[8]。急性脑出血发病后,脑实质内可出现血肿形成,血肿压迫引发继发性神经功能损伤,影响预后[9]。西医治疗急性脑出血多以对症处理为主,如控制脑水肿、降颅压、预防脑疝形成等,但部分患者预后仍不理想[10]。近年来,中医在急性脑出血中的应用表现出独特优势,特别是中医辨证论治原则的实施,为急性脑出血治疗提供了新的突破口。中医认为,急性脑出血属于“中风”范畴,病因病机包括积损正衰、劳倦内伤、情志不畅、肝郁化火,致脑络之血破入脑室,淤血阻络,瘀血贯穿本病发生发展之始终,治疗当以活血化瘀为主[11]。槲皮素是一种天然抗氧化剂,可活血化瘀、流通血脉,促进血液循环,且具有抗病毒、抗炎、抗氧化、抗血栓等较多生物活性。目前,临床就槲皮素对急性脑出血大鼠神经功能恢复影响及具体作用机制尚无明确定论,而就此进行深入分析,利于为急性脑出血早期治疗提供新方向。
槲皮素具有多种药理活性,分子量为302.24,可穿透血脑屏障发挥作用,任思冲等[12]研究显示,槲皮素可有效透过血脑屏障,抑制人胶质母细胞瘤U251细胞增殖。最新研究表明,加载槲皮素的纳米颗粒较游离化合物对血脑屏障的穿透性更强[13]。这些研究为槲皮素应用于脑部疾病的治疗奠定了理论基础。此外,动物实验表明,槲皮素能减少全脑缺血/再灌注损伤大鼠海马组织细胞凋亡,减轻脑组织损伤[14];槲皮素还可减少衰老小鼠脑内炎性因子生成,改善学习记忆功能障碍[15],均证实槲皮素的脑保护作用。本研究发现,槲皮素应用后大鼠NSS评分及IL-6、TNF-α水平降低,W/D值、神经细胞凋亡下降,脑组织病理形态学异常改变明显改善,这提示槲皮素在急性脑出血大鼠中的应用具有一定价值,可减轻炎性反应,缓解脑水肿,抑制神经细胞凋亡,促进神经功能恢复。徐兰娟等[16]也发现,实验性大鼠脑出血早期治疗中应用槲皮素能抑制炎性反应,减少细胞凋亡,促进神经功能恢复,与本研究共同证实槲皮素在改善脑出血神经功能损伤中的作用。
PKC属于丝/苏氨酸蛋白激酶,激活后可导致一系列靶蛋白的丝氨酸残基和(或)苏氨酸残基出现磷酸化,给功能蛋白活性造成影响,调控机体代谢、细胞增殖、细胞分化等生理、生化反应[17]。另外,PKC可经由对ERK1/2转录活性进行调节,减轻氧化应激反应,减少细胞凋亡[18-19]。Li等报道[20],ERK1/2活性增强,可激活多种信号传导机制,调节脑卒中大鼠神经元凋亡。傅思铭等[21]还提出,抑制PKC/ERK信号通路,可减轻脑出血小鼠氧化应激反应,减少神经元凋亡,改善神经功能损伤。这些研究均提示,PKC/ERK信号通路可能在急性脑出血发生发展及病情控制中发挥一定作用。本研究结果显示,槲皮素治疗后大鼠p-PKC、p-ERK1/2蛋白相对表达量降低,且经应用PKC激动剂进一步验证,这提示槲皮素可抑制PKC/ERK信号通路,推测这可能是槲皮素发挥促进急性脑出血大鼠神经功能恢复的重要作用机制之一。
综上所述,槲皮素可减轻急性脑出血大鼠炎性反应,抑制神经细胞凋亡,缓解脑组织损伤,促进神经功能恢复,作用机制可能与调节PKC/ERK信号通路有关。本研究不足之处在于仅研究了槲皮素通过PKC/ERK信号通路的作用,未研究其他途径,今后仍需进一步深入分析。
利益冲突:所有作者均声明不存在利益冲突。

