基于团聚原理的纳米金比色法测定甲巯咪唑
庄登科,毛丽惠,李保峰,黄子源,刘博园,顾顺郁,李 嘉
(信阳学院理工学院,河南 信阳 464000)
甲巯咪唑(Thiamazole,2-mercapto-1-methylimidazole,MMI)为咪唑类抗甲状腺药物[1],在临床上用于治疗各种类型的甲状腺功能亢进症,长期或过量使用,会影响人体血液系统和消化系统,导致骨骼、关节不适[2-3]。所以,建立一种准确、灵敏、快速测定甲巯咪唑含量的方法对指导临床用药有着极为重要的作用。目前,测定甲疏咪唑的方法主要有化学发光法[4]、紫外可见分光光度法[5]、高效液相色谱法[6]、光度法[7]、电化学法[8]、荧光猝灭法[9]等。其中,化学发光法稳定性、重现性不好;高效液相色谱法所需仪器价格昂贵;电化学法操作不便;荧光猝灭法的机理复杂,且干扰因素多。紫外可见分光光度法因具有仪器简单、操作方便、灵敏度高、分析速度快等特点而备受关注。
纳米金的粒径在1~100 nm之间,具有强大的表面等离子体共振(SPR)效应,较高的电子密度、介电性能、催化性能及良好的稳定性,能与多种生物大分子结合而不影响其生物活性,此外,纳米金还具有易于修饰和功能化等特点[10],广泛应用于化学、生物、医药、食品等领域[11]。纳米金制备简单,常采用柠檬酸钠还原法,通过控制还原剂柠檬酸钠的用量可以得到不同粒径的纳米金。
纳米金比色法是基于纳米金粒子的表面等离子体共振效应,被测物质与纳米金粒子发生相互作用,诱导纳米金粒子团聚,从而可以通过肉眼观察体系颜色变化或紫外可见分光光度法实现定性定量检测,具有消光系数高、灵敏度高、不需要昂贵复杂仪器等特点。当前,纳米金比色法已广泛应用于核酸、适体蛋白、酶、金属离子等物质的检测[12]。郭昱辰等[13]采用铋试剂-Ⅱ修饰的纳米金溶液检测汞离子,汞离子与铋试剂-Ⅱ选择性配位,使纳米金粒子团聚,汞离子浓度与吸光度呈一定的线性关系,线性范围为5×10-5~1 mg·L-1,回收率为93%~107%,RSD值为1.98%~3.52%,该方法具有较高的精密度和稳定性。王慎等[14]采用纳米金比色法测定头孢噻肟钠,检出限为0.006 μg·mL-1,加标回收率为97.5%~105.0%,RSD值为1.0%~2.3%,该方法的选择性、准确度和重复性能够满足实际需要。曲黎等[15]采用纳米金比色法成功测定了多西环素和土霉素,多西环素和土霉素分子中的氨基官能团诱导纳米金粒子团聚,导致纳米金吸收光谱发生红移和展宽,溶液颜色由酒红色变成蓝色,测定多西环素和土霉素的线性范围分别为0.06~0.66 mg·L-1和0.59~8.85 mg·L-1,检出限分别为0.008 6 mg·L-1、0.083 8 mg·L-1,符合药品质量管理的规定。邢海波等[16]采用基于团聚原理的纳米金比色法检测牛奶中的三聚氰胺,通过紫外可见分光光度计可检测的检出限为34 nmol·L-1,远低于美国FDA和欧盟规定的牛奶中三聚氰胺的最大残留标准2.5 mg·L-1(20 000 nmol·L-1),加标回收率为90%~120%,该方法可满足精确检测牛奶中三聚氰胺残留的要求。么亚男等[17]建立了纳米金比色法测定啶虫脒,利用啶虫脒诱导纳米金粒子团聚变色,使其在520 nm 处吸收峰强度减弱,同时在700 nm 附近产生新的吸收峰,检出限为1.27 μmol·L-1。戴卫江等[18]成功将纳米金比色法应用于家蚕微孢子虫的检测,基于团聚原理,采用纳米金探针检测到的家蚕微孢子虫总蛋白量最低为10 ng,该方法对家蚕微粒子病的防治具有重要意义。田锐等[19]成功将纳米金比色法用于阿米卡星的测定,利用阿米卡星诱导纳米金粒子团聚,使其在520 nm处吸收峰强度减弱,同时在640 nm附近产生新的吸收峰,线性范围为2.0×10-7~5.0×10-6mol·L-1,检出限为0.6×10-8mol·L-1,回收率为100.0%~105.0%。
作者基于团聚原理建立纳米金比色法测定甲巯咪唑,对纳米金与甲巯咪唑的反应机理进行初步探讨,并对检测条件进行优化。
1 实验
1.1 试剂与仪器
甲巯咪唑标准品,上海阿拉丁生化科技股份有限公司;甲巯咪唑片,Merck KGaA公司;氯金酸、柠檬酸钠、磷酸、硼酸、醋酸、氢氧化钠;实验用水为去离子水。
TU-1901型紫外可见分光光度计,FEI-Tecnai-F20型透射电子显微镜,PHS-3E型 pH计,FA2004型电子分析天平,DF-101S型集热式恒温加热磁力搅拌器。
1.2 纳米金的制备
采用柠檬酸钠还原法制备纳米金[20]。取2.0 mL 1%氯金酸溶液,加热煮沸,迅速加入5.6 mL 1%柠檬酸钠溶液,边加热边用磁力迅速搅拌;待溶液持续沸腾至颜色不再发生变化时,停止加热,继续搅拌直至溶液温度降为室温;转移至棕色容量瓶中,置于冰箱中,4 ℃保存,备用。
1.3 纳米金比色法测定甲巯咪唑
Britton-Robinson缓冲溶液的配制:用浓度均为0.04 mol·L-1的磷酸、硼酸和醋酸配成100 mL混合溶液,加入一定体积的0.2 mol·L-1NaOH溶液,并用酸度计调节溶液pH值分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0。
准确移取1 mL 0.01 mol·L-1Britton-Robinson缓冲溶液、1 mL纳米金溶液,加入1 mL不同浓度甲巯咪唑溶液,混合均匀,室温反应5 min。拍摄记录溶液的颜色变化,扫描溶液的紫外可见吸收光谱。
2 结果与讨论
2.1 检测机理分析
纳米金粒子的共振吸收能带位于可见光区,分散状态的纳米金在520 nm处有一个很明显的特征吸收峰,加入甲巯咪唑后,团聚状态的纳米金粒子在520 nm处的吸收峰强度减弱,且在660 nm处产生一个新的吸收峰(图1),两处吸光度比值(A660/A520)与甲巯咪唑浓度呈正比。加入甲巯咪唑后,溶液颜色由酒红色变为蓝紫色。其可能的反应机理为:甲巯咪唑是一种常见的有机小分子,含有1个巯基(-SH)和2个氮原子,其中饱和氮原子为吡咯氮,不饱和氮原子为吡啶氮,甲巯咪唑加入纳米金溶液后,具有一对sp2孤对电子的吡啶氮可以通过弱表面结合将柠檬酸根离子置换,与纳米金发生强烈的配位作用,甲巯咪唑中的-SH可以与纳米金形成Au-S键,从而使纳米金粒子发生团聚,此时胶体溶液颜色呈蓝紫色纳米金与甲巯咪唑反应前后的透射电镜照片如图2所示。
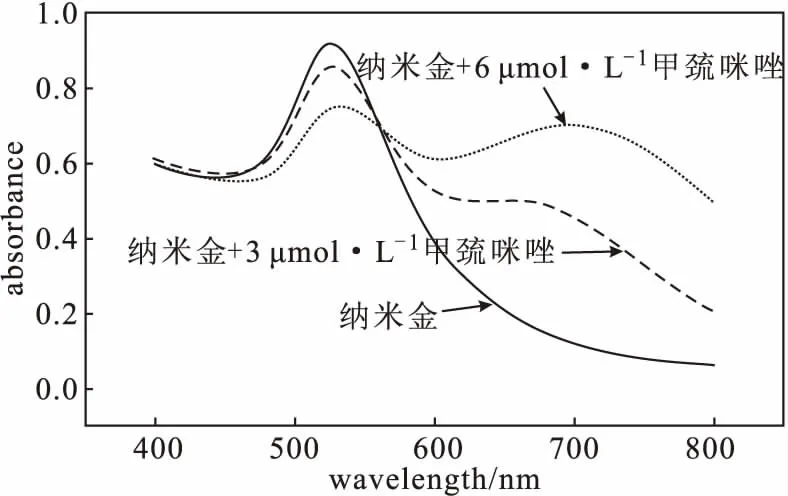
图1 纳米金与不同浓度甲巯咪唑反应前后的紫外可见吸收光谱Fig.1 UV-Vis absorption spectra of gold nanoparticles before and after reaction with different concentrations of methimazole
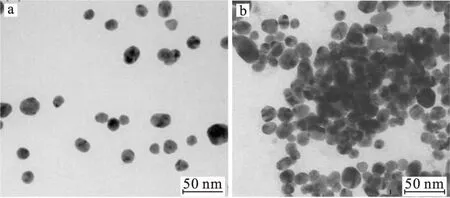
图2 纳米金与甲巯咪唑反应前(a)后(b)的透射电镜照片Fig.2 TEM images of gold nanoparticles before(a) and after(b) reaction with methimazole
[21]
由图2可以看出,纳米金粒子呈球形,有很好的分散性(图2a);甲巯咪唑加入纳米金溶液后,使纳米金粒子产生了明显的团聚(图2b)。
2.2 检测条件的优化
2.2.1 反应时间的选择
将浓度分别为2 μmol·L-1和6 μmol·L-1的甲巯咪唑溶液与纳米金溶液反应不同时间,考察反应时间对A660/A520的影响,结果如图3所示。
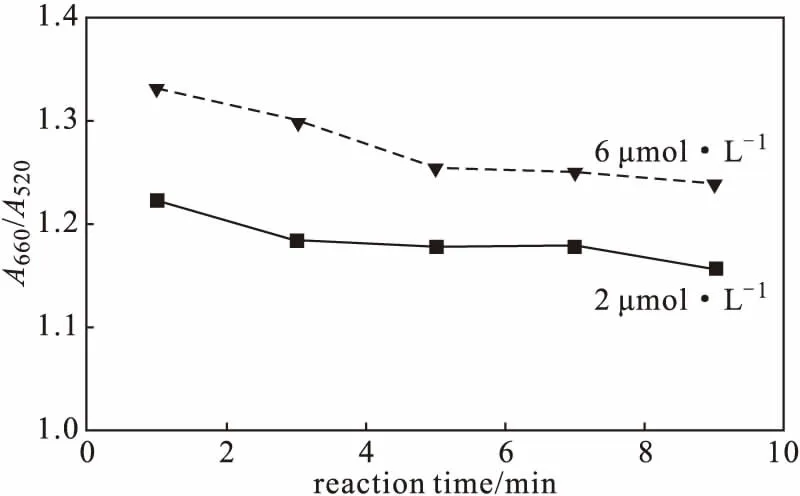
图3 反应时间对A660/A520的影响Fig.3 Effect of reaction time on A660/A520
由图3可知,随着反应时间的延长,A660/A520逐渐降低,体系反应不完全;当反应时间超过5 min后,继续延长反应时间,A660/A520变化不明显。因此,选择反应时间为5 min。
2.2.2 缓冲溶液pH值的选择
反应体系pH值会影响纳米金粒子和甲巯咪唑在溶液中的存在形态及二者之间的相互作用。配制pH值为3.0~9.0的0.01 mol·L-1Britton-Robinson缓冲溶液,考察缓冲溶液pH值对A660/A520的影响,结果如图4所示。
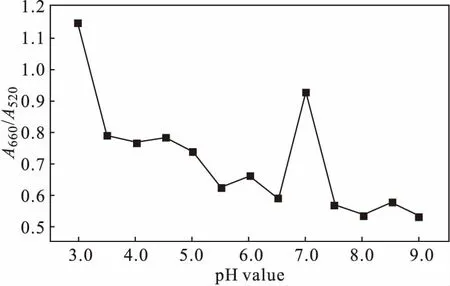
图4 缓冲溶液pH值对A660/A520的影响Fig.4 Effect of pH value of buffer solution on A660/A520
由图4可知,缓冲溶液pH值为3.0时,A660/A520最高;缓冲溶液pH值在3.5~7.0时,A660/A520在一定范围内波动,在pH值为7.0时达到最高;缓冲溶液pH值>7.0后,A660/A520降低。这可能是由于,在酸性条件下甲巯咪唑的巯基可以质子化,增强其与带负电荷的纳米金粒子的相互作用;而在碱性条件下,甲巯咪唑的巯基会失去质子带负电荷,减弱其与纳米金粒子的相互作用[22-23]。因此,选择pH值为3.0的0.01 mol·L-1Britton-Robinson缓冲溶液作为反应介质。
2.3 标准曲线及检出限
在Britton-Robinson缓冲溶液pH值为3.0、反应时间为5 min的最佳条件下,在甲巯咪唑浓度为0.2~10 μmol·L-1时,采用纳米金比色法测定甲巯咪唑浓度与A660/A520的关系,结果如图5所示。
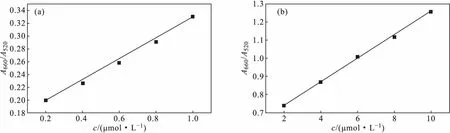
图5 甲巯咪唑的标准曲线Fig.5 Standard curve of methimazole
由图5可知,甲巯咪唑浓度在0.2~1.0 μmol·L-1范围内时,线性回归方程为:A660/A520=0.162c+0.1642,R2=0.9959(图5a);在2~10 μmol·L-1范围内时,线性回归方程为:A660/A520=0.0642c+0.6145,R2=0.9991(图5b)。
对4 μmol·L-1的甲巯咪唑溶液平行测定11次,RSD值为4.7%,检出限为0.06 μmol·L-1。
2.4 干扰物质的影响
当甲巯咪唑浓度为4 μmol·L-1时,考察125 倍量的Al3+、Ba2+、Co2+、Cr3+、Cu2+、Fe2+、Mg2+、Mn2+、Zn2+、葡萄糖、蔗糖对A660/A520的影响,结果如图6所示。
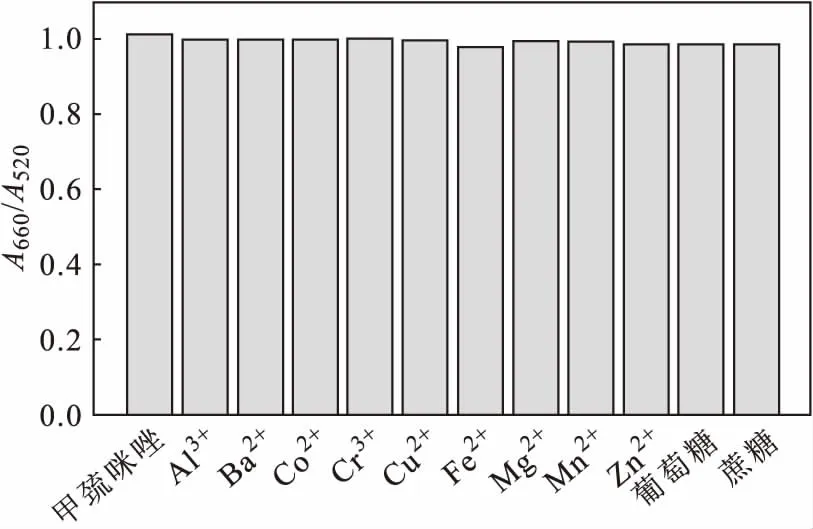
图6 潜在干扰物质对A660/A520的影响Fig.6 Effect of potentially interfering substances on A660/A520
由图6可知,反应体系A660/A520无明显变化。表明潜在的干扰物质对测定结果无影响,该方法选择性好。
2.5 样品测定
将甲巯咪唑药片研细混匀后,加入去离子水溶解,转至 50 mL棕色容量瓶中定容,静置;逐步稀释至浓度为5 μmol·L-1,在最佳条件下进行测定。测得每片药片甲巯咪唑的含量为9.26 mg,与药品生产企业标示含量基本一致。
为了进一步验证该方法的准确性,向健康人的尿样中加入浓度为4 μmol·L-1的甲巯咪唑标准溶液进行加标回收率实验,测得甲巯咪唑浓度为4.12 μmol·L-1,加标回收率为115%,RSD值为2.2%(n=6)。表明,该方法可用于甲巯咪唑药片中甲巯咪唑含量的测定。
3 结论
采用柠檬酸钠还原法制备纳米金,基于团聚原理建立了纳米金比色法测定甲巯咪唑。结果表明,室温下,在Britton-Robinson缓冲溶液pH值为3.0、反应时间为5 min的最佳条件下,测定甲巯咪唑的线性范围为0.2~1.0 μmol·L-1、2~10 μmol·L-1,检出限为0.06 μmol·L-1;对健康人的尿样进行分析,加标回收率为115%。该方法简单、快速,可用于甲巯咪唑含量的测定。

