外源钙对干旱胁迫下甜菜幼苗生长的影响
梅书洋,何敏敏,耿贵,於丽华,王宇光
(1.黑龙江大学现代农业与生态环境学院,哈尔滨 150080;2.黑龙江大学生命科学学院,哈尔滨 150080)
0 引言
甜菜(Beta vulgarisL.)是藜科甜菜属,二年生草本植物,具有喜温、抗旱、耐盐碱等特点,广泛种植于我国内蒙古、黑龙江、新疆等干旱、半干旱地区[1-2]。在中国北部纬度较高地区,甜菜作为制糖的主要经济作物,其产量在国际上一直稳居前10位[3],在未来有很大的发展潜力。
近年来,干旱灾害已经成为我国耕地所面临的主要问题。根据气象部门统计,在各类气象灾害中,因干旱灾害而遭受影响的耕地面积多达50%,所造成的负面影响程度远超过洪涝灾害影响[4]。甜菜在生产过程中经常遭受干旱灾害,其产量大幅度降低。数据表明,2018/2019榨季内蒙产区受春季高温干旱影响,甜菜糖产量从预期的85 万t 减产到76 万t[5]。由此可以看出抵御干旱胁迫,提高甜菜产量对我国甜菜制糖产业的发展具有十分重要的意义。
已有研究表明,施加一定浓度的外源钙可以有效缓解植物在干旱胁迫下所受到的损害,从而增加植物的抗逆性[6]。钙是细胞信号转导过程中不可缺少的第二信使,在细胞质内通过传递干旱信号并参与信号的响应和表达,从而减轻干旱胁迫对植物细胞膜的损害,提高植物的抗旱性[7-8]。胡建忠等[9]发现,干旱胁迫下,施加CaCl2溶液的沙棘叶干重和叶面积高于不施加CaCl2溶液。安钰等[10]发现,在干旱胁迫下施用CaCl2溶液可提高甘草叶片叶绿素含量、净光合速率、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性,并降低丙二醛(MDA)含量,从而增强甘草对干旱的适应能力。李小玲等[7]发现,以叶面喷施方式施加外源钙对黄芩抵御干旱胁迫的伤害更有利,其中以10 mmol/L CaCl2溶液处理的效果最好。
综上所述,添加CaCl2溶液可有效缓解干旱胁迫对植物的损害。目前,我国对于提高甜菜抗旱能力的研究更多在甜菜抗旱育种方面,对喷施外源物质提高甜菜抗旱能力的研究较少。因此,本研究通过在干旱胁迫下喷施不同浓度CaCl2溶液,探究其对甜菜生理特性的影响及最适宜的CaCl2施加浓度,为提高甜菜抗干旱胁迫能力提供科学依据。
1 材料与方法
1.1 试验材料
本试验甜菜品种为‘KWS1176’。土壤采自黑龙江大学呼兰校区试验田。栽培管为高度57 cm、直径4.5 cm的PVC-U 管。
1.2 试验设计
本试验通过叶面喷施CaCl2溶液,设置5 个处理:CK(土壤含水量为黑龙江大学呼兰校区试验田田间持水量的85%)、D-0 mmol/L[干旱+叶面喷施0 mmol/L CaCl2溶液(清水)]、D-5 mmol/L(干旱+叶面喷施5 mmol/L CaCl2溶液)、D-10 mmol/L(干旱+叶面喷施10 mmol/L CaCl2溶液)、D-20 mmol/L(干旱+叶面喷施20 mmol/L CaCl2溶液)。每个处理设置4个重复,每个重复是由5根同样高度的PVC-U 管组成。
培养条件:将吸满水的PVC-U管放入光照培养室中进行发芽(每天光照时间为7:00—20:00,昼夜温度分别为28 ℃和25 ℃)。待甜菜幼苗长至第二对真叶时,土壤相对含水量为黑龙江大学呼兰校区试验田田间持水量的65%,开始进行干旱处理(采用称重法进行控水处理,即每隔一天称量一次土壤水分自然消耗量,然后浇水补充至设定标准),同时向叶面喷施不同浓度的CaCl2溶液,1 d一次,连续处理14 d。在幼苗处理14 d后对甜菜叶片进行收获,处理保存样品并测定相关指标。
1.3 生理生化指标的测定
采用抽滤法测定叶片相对电导率[11];采用硫代巴比妥酸法测定MDA[12];使用CI-340 手持式光合作用测量系统测定气孔导度(Gs)、蒸腾速率(Tr)、胞间二氧化碳浓度(Ci)和净光合速率(Pn)[13];采用茚三酮比色法[8]测定游离脯氨酸;采用氮蓝四唑(NBT)光还原法测定SOD 活性[14];POD 活性的测定采用愈创木酚显色法[15];CAT活性的测定采用紫外吸收法[14];抗坏血酸过氧化物酶(APX)活性的测定采用乙二胺四乙酸法[11]。
1.4 数据分析
通过Microsoft Office Excel 2019 进行数据整理和制图,并用SPSS20.0 软件对试验数据进行统计和差异性分析,分析方法使用单因素方差分析(显著性水平为0.05)。
2 结果与分析
2.1 外源钙对干旱胁迫下甜菜生长的影响
图1 为不同浓度外源钙在干旱胁迫下对甜菜生长表型的影响。由图可知,干旱胁迫(0 mmol/L)严重影响甜菜幼苗生长,喷施CaCl2溶液能够缓解干旱胁迫对甜菜生长造成的抑制作用。与0 mmol/L相比,随着喷施CaCl2溶液浓度的增加,甜菜幼苗株高呈先上升后下降的趋势,在喷施CaCl2溶液浓度为10 mmol/L时长势最好。图2 为不同浓度外源钙在干旱胁迫下对甜菜株高的影响。喷施不同浓度CaCl2溶液,甜菜幼苗株高分别为11.92、12.90、16.83 和15.97 cm。与CK 相比,干旱胁迫下,不同浓度CaCl2溶液处理组株高分别下降50.51%、46.43%、30.10%和33.67%。因此,喷施10 mmol/L CaCl2溶液能最有效地缓解干旱胁迫对甜菜幼苗生长造成的抑制作用,与0 mmol/L相比提高41.24%。

图1 外源钙在干旱胁迫下对甜菜生长表型的影响Fig.1 Effects of exogenous calcium on growth phenotype of sugar beet under drought stress
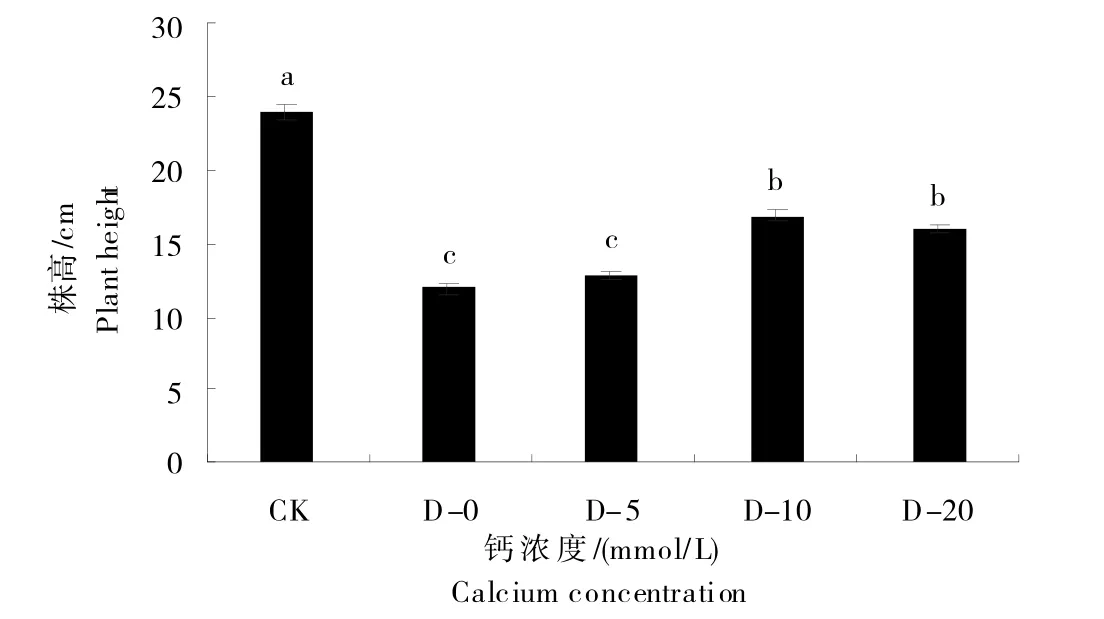
图2 外源钙在干旱胁迫下对甜菜株高的影响Fig.2 Effects of exogenous calcium on plant height of sugar beet under drought stress
2.2 外源钙对干旱胁迫下甜菜光合特性的影响
图3 为不同浓度外源钙对干旱胁迫下甜菜光合指标(Pn、Tr、Gs和Ci)的影响。由图可知,与CK 相比,干旱胁迫下甜菜Pn、Tr、Gs和Ci 显著降低(P<0.05)。随着喷施CaCl2溶液浓度的增加,Pn、Tr和Gs光合参数呈先上升后下降的趋势,在喷施的CaCl2溶液浓度为10 mmol/L 时达到最大值,与0 mmol/L 相比,分别提高70.62%、112.50%、67.00%;当喷施CaCl2溶液为10 mmol/L 时,甜菜Ci 达到最大值,与0 mmol/L 相比减少32.77%。通过对甜菜光合参数的结果分析,干旱胁迫抑制了甜菜自身光合作用的能力,而施加外源钙可有效缓解其抑制作用,其中喷施10 mmol/L CaCl2溶液效果最佳。
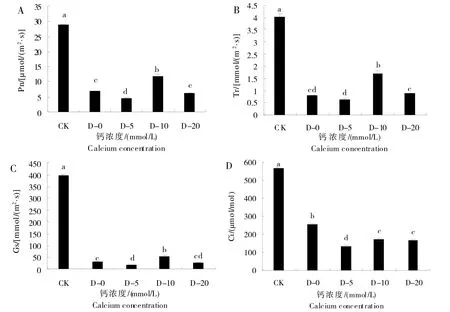
图3 外源钙在干旱胁迫下对甜菜Pn(A)、Tr(B)、Gs(C)、Ci(D)的影响Fig.3 Effects of exogenous calcium on Pn(A),Tr(B),Gs(C)and Ci(D)of sugar beet under drought stress
2.3 外源钙对干旱胁迫下甜菜抗氧化酶活性的影响
植物体内多种抗氧化酶相互配合,可保护细胞膜系统免受活性氧的伤害。由图4 可知,干旱胁迫(0 mmol/L)与对照CK 相比,CAT活性有显著差异;随着喷施CaCl2溶液浓度的增加,POD和APX活性呈先上升后下降的趋势,而SOD活性与之相反,CAT活性呈下降趋势。
SOD 能消除植物体内强烈毒性的超氧阴离子自由基。从图4A 可看出,喷施5、10、20 mmol/L CaCl2溶液时甜菜SOD 活性较0 mmol/L 分别提高58.01%、27.94%、39.86%,因此喷施5 mmol/L CaCl2溶液能够更好地提高甜菜叶片SOD活性。POD是植物体内消除过氧化物、降低活性氧伤害的一种关键酶。从图4B可看出,喷施5、10、20 mmol/L CaCl2溶液时甜菜的POD 活性较0 mmol/L 分别提高13.20%、50.24%、32.53%,说明在干旱胁迫下喷施10 mmol/L CaCl2溶液能有效缓解干旱胁迫对甜菜造成的损伤。CAT 是消除植物组织中高浓度H2O2的主要酶。从图4C 可看出,喷施5 mmol/L CaCl2溶液时甜菜的CAT活性达到最大值,较0 mmol/L提高82.66%;喷施20 mmol/L CaCl2溶液时甜菜的CAT 活性达到最小值,较0 mmol/L 降低10.86%。APX 作为清除H2O2和催化AsA 氧化的关键酶。从图4D 可看出,喷施10 mmol/L CaCl2溶液时甜菜的APX 活性达到最大值,较0 mmol/L提高255.13%;喷施5 mmol/L和20 mmol/L CaCl2溶液时甜菜APX活性较0 mmol/L分别提高162.99%和179.91%。综上所述,干旱胁迫降低抗氧化酶活性,而喷施CaCl2溶液能够有效提高其活性,缓解干旱胁迫对甜菜生长造成的损伤。

图4 外源钙在干旱胁迫下对甜菜幼苗SOD(A)、POD(B)、CAT(C)和APX(D)抗氧化酶活性的影响Fig.4 Effects of exogenous calcium on SOD(A),POD(B),CAT(C)and APX(D)of antioxidant enzyme activities in sugar beet seedlings under drought stress
2.4 外源钙对干旱胁迫下甜菜脂膜透性的影响
植物器官在衰老或逆境条件下遭受伤害时往往产生脂膜过氧化,MDA 作为脂膜过氧化的最终产物,其含量的高低直接反映植物脂膜受伤害程度。如图5A 所示,与CK 相比,干旱胁迫增加了甜菜叶片细胞内MDA 含量,而喷施不同浓度的CaCl2溶液后,甜菜叶片细胞内MDA 含量较0 mmol/L 下降。喷施不同浓度CaCl2溶液较0 mmol/L 分别下降7.15%、12.76%和6.79%。因此,在干旱胁迫下喷施CaCl2溶液会降低甜菜叶片细胞内MDA 含量,以喷施10 mmol/L CaCl2溶液效果最佳。细胞膜透性是作物受到胁迫后细胞膜损伤程度的重要生理指标之一,可通过叶片相对电导率来衡量细胞膜损伤程度。相对电导率越高说明细胞膜透性强、受损程度严重,反之则说明细胞膜完整性好。如图5B所示,干旱胁迫增加了甜菜叶片的相对电导率,而喷施不同浓度CaCl2溶液与0 mmol/L相比相对电导率分别降低15.47%、27.93%和20.35%,因此,在干旱胁迫下喷施10 mmol/L CaCl2溶液可有效防止甜菜叶片细胞膜受损。综上所述,喷施CaCl2溶液可有效缓解干旱胁迫对甜菜细胞膜的损害。
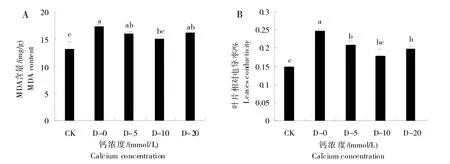
图5 外源钙在干旱胁迫下对甜菜MDA含量(A)和甜菜叶片膜透性(B)的影响Fig.5 Effect of exogenous calcium on MDA content(A)and membrane permeability(B)of sugarbeet leaves under drought stress
2.5 外源钙对干旱胁迫下甜菜脯氨酸含量的影响
干旱胁迫下,甜菜叶片中脯氨酸含量随着喷施CaCl2溶液浓度的增加呈先上升后下降趋势(图6)。与CK 相比,干旱胁迫下甜菜叶片脯氨酸含量提高,与CK 之间差异显著。在干旱胁迫下,与0 mmol/L 相比,喷施不同浓度CaCl2溶液的甜菜叶片脯氨酸含量分别增加了48.72%、75.15%和63.61%,在喷施10 mmol/L Ca-Cl2溶液时,甜菜叶片中脯氨酸的含量达到最大值。因此,喷施不同浓度的CaCl2溶液可以促进甜菜叶片脯氨酸含量的积累,提高其渗透调节能力,其中10 mmol/L CaCl2溶液效果最好。

图6 不同浓度外源钙在干旱胁迫下对甜菜脯氨酸含量的影响Fig.6 Effects of different concentrations of exogenous calcium on proline content of sugar beet under drought stress
3 讨论
光合作用是植物生长发育的基础,而干旱胁迫可以通过影响Pn、Tr、Gs 和Ci 等光合特性来影响植物的生长发育。Ca2+在植物光合作用的调节中起到重要的作用,XUE等[16]的研究发现,在干旱胁迫下施加Ca2+可以显著提高光合作用相关的参数,如Pn、Tr、Gs和Ci 等。本研究发现,在干旱胁迫下,随着叶面喷施CaCl2溶液浓度的增加,甜菜幼苗叶片Pn、Tr 和Gs 光合参数均呈先上升后下降的趋势,与0 mmol/L 相比,10 mmol/L达到最大值,该结果与前人研究结果相似[16]。干旱胁迫下,叶面喷施CaCl2溶液可提高甜菜叶片光合特性,促进甜菜光合作用,其中10 mmol/L时效果最佳。
植物膜脂过氧化酶促防御系统中,SOD、POD、CAT 和APX 是重要的保护酶。米银法等[17]的试验发现,当植物遭受干旱胁迫时,施加一定浓度外源钙可提高植物体内抗氧化酶活性,增强清除自由基的能力。本试验中,在干旱胁迫下,与0 mmol/L相比,随着喷施CaCl2溶液浓度的增加,SOD、POD、CAT和APX 活性总体呈现上升趋势,说明外源钙可提高干旱胁迫下甜菜抗氧化能力。同时,SOD 和CAT 的活性在喷施5 mmol/L CaCl2溶液时达最大值;POD和APX的活性在喷施10 mmol/L CaCl2溶液时达最大值。
MDA 是植物细胞膜脂过氧化最主要产物之一,其含量越多,代表植物受伤害的程度越高[18]。本试验中,在干旱胁迫下,喷施不同浓度CaCl2溶液,甜菜叶片细胞内MDA 含量呈先下降后上升的趋势,且都低于0 mmol/L。这说明干旱胁迫下,外源钙可通过产生溶质(如脯氨酸),提高细胞膜的稳定性,从而减少MDA 的产生[19]。当植物在生长过程中受到干旱胁迫,植物细胞膜透性增大,细胞内电解质外渗,导致植物细胞浸提液的电导率增大[20]。本试验中,与CK 相比,甜菜叶片受干旱胁迫时电导率增大。在干旱胁迫下,与0 mmol/L 相比,喷施不同浓度CaCl2溶液后,甜菜叶片电导率呈先下降后上升的趋势,在10 mmol/L 最低,这与外源Ca2+和H2O2对油菜幼苗干旱胁迫的缓解作用[20]研究结果相似。脯氨酸是植物体内重要的渗透调节物质。本试验中,干旱胁迫导致脯氨酸含量增加,叶面喷施CaCl2溶液进一步促进脯氨酸的积累,提高其渗透调节能力,增强了甜菜的耐旱性。
4 结论
本试验结果显示,在干旱胁迫下,叶面喷施CaCl2溶液可提高甜菜叶片的Pn、Tr 和Gs,降低Ci,从而提高甜菜光合作用,其中喷施10 mmol/L CaCl2溶液效果最佳;SOD 和CAT 活性在喷施5 mmol/L CaCl2溶液时达最大值,POD 和APX 的活性在喷施10 mmol/LCaCl2溶液时达最大值;喷施10 mmol/L CaCl2溶液时MDA 含量和相对电导率达最小值,脯氨酸含量达最大值。综上所述,喷施10 mmol/L CaCl2溶液能最大程度地缓解干旱胁迫对甜菜幼苗生长造成的损伤,促进甜菜幼苗生长。

