山豆根药材UPLC-UV指纹图谱及3种成分含量测定研究
南俊伶,王超众,闫广利*,吴芳芳,宋志军,王硕,周小雷,缪剑华,王喜军,*(.黑龙江中医药大学,国家中医药管理局中医方证代谢组学研究中心,教育部经典名方有效性评价及产业化开发工程研究中心,哈尔滨 50040;.广西壮族自治区药用植物园,西南濒危药材资源开发国家工程实验室,南宁 53003)
山豆根为豆科植物越南槐Sophora tonkinensisGagnep.的干燥根和根茎,又名广豆根,主要分布于广西、贵州等地[1],具有清热解毒、消肿利咽的功效[2]。现代药理学研究表明,山豆根具有抗肿瘤[3]、抗病毒[4]、镇痛、抗炎[5]、抗肝损伤[6]、抗氧化[7]以及增强免疫[8]等药理作用。山豆根中主要含有生物碱类、黄酮类、三萜类成分[9],《中国药典》规定山豆根中含苦参碱和氧化苦参碱的总量不得少于0.70%[2],除药典规定外,也有研究对山豆根中的金雀花碱、槐果碱、槐醇、芒柄花素、越南槐醇以及高丽槐素等成分的含量进行检测[10-12],然而仍没有对山豆根各类成分进行整体分析的质量控制方法。本课题利用超高效液相色谱-紫外光谱法对山豆根药材进行指纹图谱分析,并同时测定三叶豆紫檀苷、高丽槐素、山豆根素等3个非生物碱活性成分的含量,为山豆根药材的整体质量控制提供有效方法。
1 材料
超高效液相色谱仪(ACQUITY UPLC,美国Waters公司);光电二极管阵列检测器(ACQUITY PDA,美国Waters公司);电子分析天平(AE-240,瑞士梅特勒公司);数控超声波清洗器(KQ-300DA 型,中国昆山市超声仪器有限公司);国家药典委员会中药色谱指纹图谱相似度评价系统2012年版。
乙腈(色谱纯,美国Fisher公司);磷酸(色谱纯,中国科密欧化学试剂公司公司);甲醇(分析纯,天津市富宇精细化工有限公司);水为超纯水。
高丽槐素(批号:RFS-M03002005008)、氧化苦参碱(批号:Y-013-181216)、三叶豆紫檀苷(批号:RFS-S06111812027)(对照品,纯度均>98%,成都瑞芬思生物科技有限公司);山豆根素对照品(批号:21S059-A2,纯度>95.8%,上海甄准生物科技有限公司)。16批山豆根药材产地如表1所示,经鉴定为豆科植物越南槐Sophora tonkinensisGagnep.的干燥根和根茎。
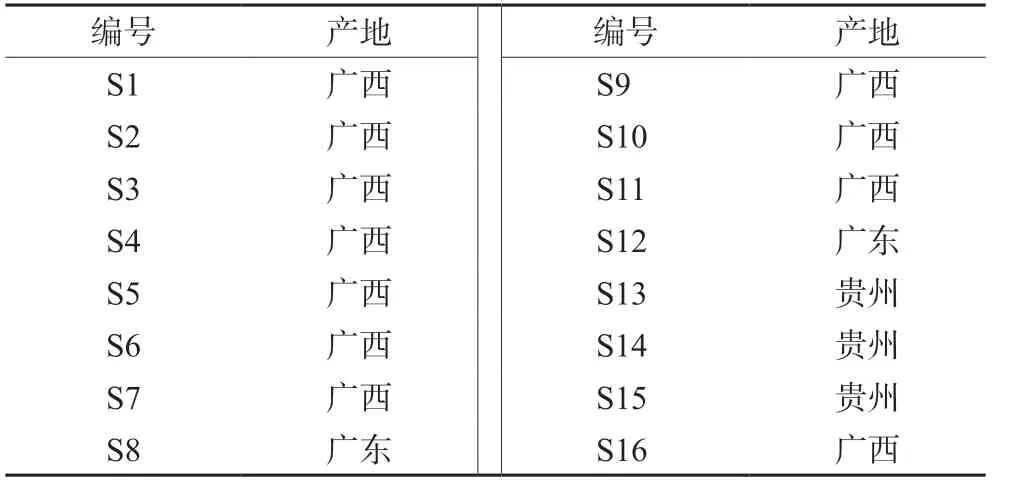
表1 山豆根药材产地 Tab 1 Origin of 15 batches of Sophora Tonkinensis
2 指纹图谱分析方法与结果
2.1 色谱条件
色谱柱:Waters Acquity UPLC HSS T3柱(2.1 mm×100 mm,1.8 μm);流动相:乙腈为流动相A,0.1%磷酸溶液为流动相B,梯度洗脱程序如表2;检测波长203 nm;流速0.3 mL·min-1;柱温25℃,进样量1 μL。

表2 梯度洗脱程序 Tab 2 Elution gradient
2.2 溶液的制备
2.2.1 对照品溶液的制备 分别取三叶豆紫檀苷、高丽槐素、山豆根素、氧化苦参碱的对照品适量,精密称定,配制成质量浓度分别为0.9810、0.9810、0.9580、0.9820 mg·mL-1的对照品溶液,摇匀,即得。
2.2.2 供试品溶液的制备 取山豆根药材细粉约0.5 g,精密称定,置具塞锥形瓶中,精密加入80%乙醇50 mL,称定重量,超声处理30 min,再称定重量,用80%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.3 方法学考察
2.3.1 精密度试验 取山豆根药材细粉0.5 g,精密称定,制备供试品溶液,连续进样6针,采集色谱图。以7号峰高丽槐素为参照峰,计算10个色谱峰的相对峰面积RSD在0.720%~3.4%,相对保留时间RSD在0.010%~0.11%,表明仪器的精密度较好。
2.3.2 稳定性试验 取山豆根药材细粉,制备供试品溶液,分别于制备后0、2、4、6、8、12、18、24 h注入液相色谱仪进行分析,以7号峰高丽槐素为参照峰,计算10个色谱峰的相对峰面积RSD为0.80%~4.2%,相对保留时间RSD为0.010%~0.42%,表明供试品溶液在24 h内稳定。
2.3.3 重复性试验 取同一批山豆根药材细粉,称取0.5 g,精密称定,共6份,平行制备供试品溶液,进样测定。以7号峰高丽槐素为参照峰,计算10个色谱峰的相对峰面积RSD为0.89%~4.0%,相对保留时间RSD为0.010%~0.19%。表明供试品溶液制备方法的重复性较好。
2.4 山豆根指纹图谱的建立
2.4.1 指纹图谱采集与相似度评价 取16批山豆根药材样品,按照“2.2.2”项下方法制备供试品溶液,按照“2.1”项下条件建立指纹图谱并进行比较,共确定10个共有峰。山豆根指纹图谱中峰7被鉴定为高丽槐素,是山豆根的主要活性成分,在该指纹图谱中峰面积适中,峰位居中,分离度良好,保留时间和峰面积稳定,因此选择峰7作为参照峰。对10个共有峰进行统一积分后,将所得图谱以cdf格式导入国家药典委员会研制的“中药色谱指纹图谱相似度评价系统(2012版)”软件进行处理,生成对照指纹图谱。运用多点校正方法对16批样品的共有峰进行匹配,得到指纹图谱的叠加图,计算16批山豆根的指纹图谱与对照指纹图谱的相似性,结果见图1和表3。各批次相似度结果在0.926~0.989,表明以该指纹图谱能够有效表征山豆根药材的整体化学特征,暂定样品指纹图谱与对照指纹图谱比较,相似度不小于0.9,用于山豆根药材的整体质量控制。

图1 16批山豆根药材的UPLC指纹图谱和对照指纹图谱(R)Fig 1 UPLC fingerprint and control fingerprint(R)of 16 batches of Sophora Tonkinensis

表3 16批山豆根药材UPLC指纹图谱相似度评价结果 Tab 3 UPLC fingerprint similarity evaluation of 16 batches of Sophora Tonkinensis
2.4.2 共有峰相对保留时间和相对峰面积 计算16批山豆根指纹图谱中各共有峰的相对保留时间和相对峰面积的RSD值。结果共有峰的相对保留时间的RSD值在0.01%~1.4%,相对峰面积的RSD值较大,说明各批次间成分含量存在较大差异。
2.4.3 指纹图谱共有峰指认 取氧化苦参碱、三叶豆紫檀苷、山豆根素、高丽槐素对照品溶液以及山豆根药材供试品溶液,按“2.1”项下色谱条件进样分析,采集色谱图如图2所示。通过比较保留时间和紫外光谱图,鉴定峰2为氧化苦参碱,峰5为三叶豆紫檀苷,峰7为高丽槐素,峰9为山豆根素。

图2 山豆根UPLC-UV指纹图谱Fig 2 UPLC-UV characteristic spectrum of Sophora Tonkinensis
3 含量测定分析方法与结果
3.1 对照品溶液的制备
分别取三叶豆紫檀苷、高丽槐素、山豆根素对照品适量,精密称定,配制成三叶豆紫檀苷、高丽槐素、山豆根素的质量浓度分别为9.810、14.71、47.90 μg·mL-1的混合对照品溶液,摇匀,备用。
3.2 方法学考察
3.2.1 系统适用性考察 取对照品溶液及供试品溶液进样检测,记录色谱图(见图3)。各化合物峰均能达到良好的分离,分离度均>1.5,理论塔板数均不低于100 000。
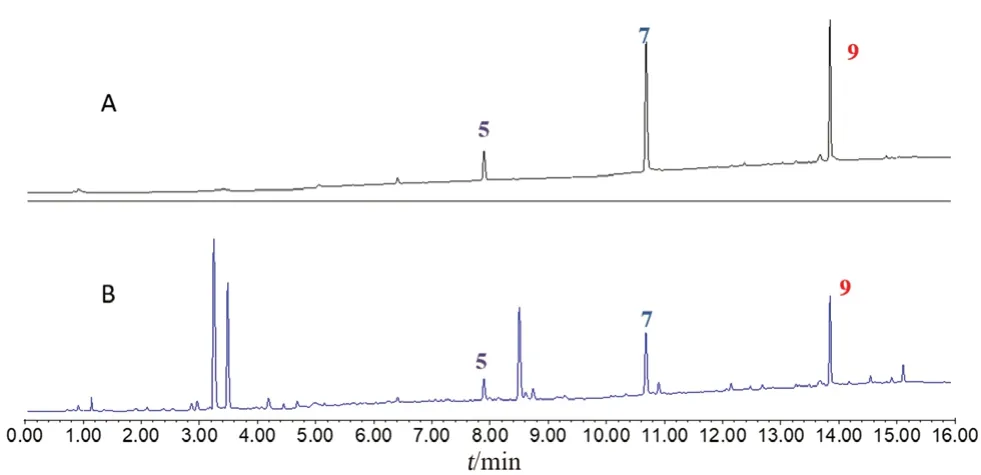
图3 山豆根UPLC-UV色谱图Fig 3 UPLC-UV chromatogram of Sophora Tonkinensis
3.2.2 线性关系考察 取对照品储备液适量,配制成含三叶豆紫檀苷49.05 μg·mL-1、高丽槐素73.57 μg·mL-1、山豆根素239.5 μg·mL-1的混合对照品溶液,用甲醇稀释,得到系列浓度的混合对照品溶液,按“2.1”项下条件测定色谱图,记录峰面积。以质量浓度为横坐标(x),峰面积为纵坐标(y)进行线性回归分析,得回归方程、相关系数及线性范围,见表4。

表4 线性关系考察结果 Tab 4 Linear relationship
3.2.3 精密度试验 取“3.1”项下对照品溶液,连续进样6次,计算三叶豆紫檀苷、高丽槐素、山豆根素峰面积的RSD值分别为0.84%、0.52%、0.39%,表明仪器精密度良好。
3.2.4 重复性试验 取同一批山豆根药材样品,称取0.5 g,精密称定,共6份,按“2.2.2”项下方法平行制备供试品溶液,进样测定。随行测定对照品溶液计算含量,测得三叶豆紫檀苷、高丽槐素、山豆根素含量的RSD值分别为2.5%、1.4%、1.9%,表明该方法重复性良好。
3.2.5 稳定性试验 取同一批供试品溶液,分别于制备后0、2、4、6、8、12、18、24 h进样测定,计算三叶豆紫檀苷、高丽槐素、山豆根素峰面积的RSD值分别为4.1%、1.5%、1.3%,表明供试品溶液在24 h内稳定性良好。
3.2.6 加样回收试验 称取山豆根样品共6份,每份约0.25 g,精密称定,分别按已知成分含量的100%加入三叶豆紫檀苷、高丽槐素、山豆根素的对照品,按“2.2.2”项下方法平行制备供试品溶液,进样测定,计算三叶豆紫檀苷、高丽槐素、山豆根素的平均回收率分别为95.31%、96.14%、98.94%,RSD值分别为4.4%、1.4%、1.8%,表明该方法准确度良好。
3.3 山豆根药材含量测定
取16批山豆根药材样品,按“2.2.2”项下方法制备供试品溶液,进样测定,计算各成分含量,结果见表5。
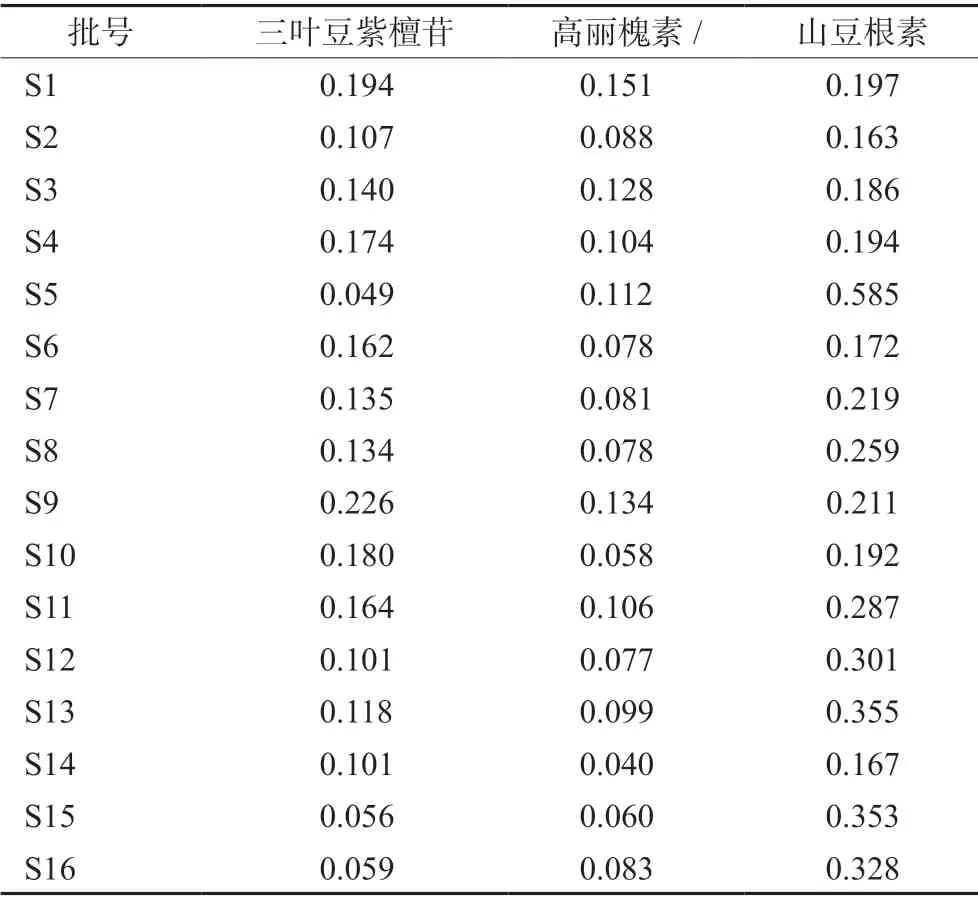
表5 16批山豆根药材的含量(%) Tab 5 Content of 16 batches of Sophora Tonkinensis (%)
4 讨论
4.1 提取条件的优化
本研究在供试品溶液的制备方面提取溶剂考察了水、甲醇(25%、50%、80%、100%)以及乙醇(25%、50%、80%、100%),提取方式考察了超声提取(30、60、90 min),回流提取(30、60、90 min)。研究发现利用加热回流方法提取山豆根药材时,峰6随着加热时间延长,其峰面积逐渐减小,而峰5随着加热时间延长,峰面积逐渐增加,两者总峰面积基本不变,表明峰6加热提取过程不稳定,因此,为真实表征山豆根药材化学成分,采用超声提取的方法。比较发现,使用80%乙醇超声提取30 min能够获得更全面的色谱峰和更高的峰强度,因此,选择80%乙醇超声提取30 min。
4.2 色谱条件的优化
采用PDA检测器在200~400 nm波长内进行扫描,提取不同波长下的色谱图,发现在203 nm波长下色谱峰较多,峰强度均匀适中,且待测物均具有最大吸收。对色谱柱Acquity UPLC BEH C18柱和Waters Acquity UPLC HSS T3柱,流动相甲醇-水、乙腈-水、乙腈-磷酸水(0.05%、0.1%、0.2%),柱温23、25、27℃,流速0.24、0.3、0.36 mL·min-1进行考察,最终选择本文的色谱条件。
4.3 用于山豆根药材整体质量控制的分析
山豆根含有生物碱、黄酮、三萜、有机酸等多种活性次生代谢产物,然而目前《中国药典》仅对其所含有的苦参碱和氧化苦参碱进行控制,存在专属性差和药效关联性差的不足。苦参碱和氧化苦参碱具有抗炎镇痛[13]、抑菌[14]、抗肿瘤[15-16]等广泛的药理作用,因此传统认为苦参碱和氧化苦参碱为山豆根的主要有效成分,并规定其在山豆根中含量总和不低于0.70%。近年来,山豆根非生物碱类成分受到关注,研究发现山豆根氯仿部位具有显著的抗鼻咽癌作用,成分分析表明该部位主要含有三叶豆紫檀苷、高丽槐素、染料木素等非生物碱类成分[17]。因此,有必要对山豆根生物碱、黄酮等成分进行全面分析,建立整体化学成分表征方法,有效控制山豆根药材质量。本研究利用超高效液相色谱法,通过优化提取方法和色谱条件,建立了涵盖氧化苦参碱、高丽槐素、三叶豆紫檀苷、山豆根素等10个共有成分峰的指纹图谱测定方法,测定了来自广西、广东、贵州三大产地的16批山豆根药材,表明各产地山豆根相似度较高,有效表征了山豆根药材的整体物质基础,可以整体化学组成上控制山豆根药材的质量。
《中国药典》规定了山豆根药材中苦参碱和氧化苦参碱的含量,为进一步控制黄酮类成分的含量,本研究在指纹图谱测定基础上,选择含量较高的高丽槐素、三叶豆紫檀苷、山豆根素作为质控成分建立含量测定方法。苏雯清等[18]研究发现高丽槐素可显著抑制鼻咽癌细胞CNE-1的增殖、克隆与迁移,并且可促进细胞凋亡。Zhang等[19]研究发现三叶豆紫檀苷可以通过抑制m-TOR/PI3K/AKT信号通路,诱导胃癌细胞自噬和线粒体介导的凋亡。Kajimoto等[20]发现山豆根素可以诱导人白血病U937细胞凋亡。高丽槐素、三叶豆紫檀苷、山豆根素都有明确的抗肿瘤活性,可能是山豆根抗肿瘤作用的主要有效成分。因此,本研究同时测定指纹图谱和高丽槐素、三叶豆紫檀苷、山豆根素的含量,与《中国药典》含量测定项相结合,为山豆根药材的整体质量提供了有效的评价方法。黄乐等[11]对7个产地的山豆根成分含量进行测定,发现高丽槐素含量在0.05%~0.11%,何常明等[21]对17个批次的山豆根中的黄酮类成分进行含量测定,发现三叶豆紫檀苷的含量在0.05%~0.20%,含量波动范围与本研究结果基本一致,本研究首次测定了山豆根药材中山豆根素的含量,以往文献未见报道。16批山豆根中3种成分的含量有较大差异,可能与不同产地以及采收日期等因素有关。
本试验利用UPLC-UV法建立了山豆根药材的指纹图谱,并测定了高丽槐素、山豆根素以及三叶豆紫檀苷的含量,为山豆根整体质量评价提供了新方法,为山豆根的质量控制提供了参考。

