黄芩汤对溃疡性结肠炎湿热证小鼠肠道菌群的影响
莫晓玮 唐凯锐 王静


〔摘要〕 目的 探討黄芩汤对溃疡性湿热证小鼠肠道菌群的影响。方法 将C57BL/6雄性小鼠随机分为空白对照(NC)组、模型(DSS)组、黄芩汤(HQD)组,每组7只。除NC组正常饲养外,其余2组均给予高脂高糖饮食,同时暴露在温度32 ℃、湿度90%环境中,每天持续16 h,连续15 d后,自由饮用2.5%葡聚糖硫酸钠水7 d。HQD组给予黄芩汤(9.1 mg/kg),NC组、DSS组均给予同体积蒸馏水灌胃7 d,期间观察小鼠一般情况,评价其疾病活动指数(disease activity index, DAI)。处死小鼠后,取中段结肠评价小鼠病理改变,取盲肠内容物进行16S rDNA高通量测序。结果 与NC组比较,DSS组小鼠DAI评分显著增高,结肠黏膜结构受损,肠道菌群多样性降低,变形菌(Proteobacteria)、拟杆菌属(Bacteroides)、大肠埃希菌-志贺菌属(Escherichia-Shigella)、副拟杆菌属(Parabacteroides)、瘤胃球菌属(Ruminococcus torques)相对丰度显著提高,厚壁菌门(Firmicutes)、布劳特氏菌属(Blautia)、毛螺菌属(Lachnospiraceae NK4A136 group)相对丰度显著下降;经黄芩汤治疗后,能显著减轻模型小鼠的疾病活动,修复其结肠的病理损伤,逆转肠道菌群的紊乱。结论 黄芩汤可能通过提高菌群多样性及调节溃疡性结肠炎湿热证小鼠菌群丰度,提升肠黏膜的完整性以发挥生物屏障功能,从而发挥治疗作用。
〔关键词〕 溃疡性结肠炎;湿热证;黄芩汤;肠道菌群;菌群多样性;菌群相对丰度
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.06.008
Effect of Huangqin Decoction on intestinal flora in mice with damp-heat
syndrome of ulcerative colitis
MO Xiaowei, TANG Kairui, WANG Jing*
(College of Traditional Chinese Medicine, Jinan University, Guangzhou, Guangdong 510632, China)
〔Abstract〕 Objective To explore the effect of Huangqin Decoction on the intestinal flora of mice with damp-heat syndrome of ulcerative colitis. Methods C57BL/6 male mice were randomly divided into blank control (NC) group, model (DSS) group and Huangqin Decoction (HQD) group, with seven mice in each group. Except for the normal feeding in the NC group, the other two groups were given a high-fat and high-sugar diet, and were exposed to a temperature of 32 °C and a humidity of 90% for 16 h a day. After 15 consecutive days, they were given free access to 2.5% dextran sulfate sodium water for 7 d. The HQD group was given Huangqin Decoction (9.1 mg/kg), NC group and the DSS group were given the same volume of distilled water for 7 d. During the period, the general condition of the mice was observed and their disease activity index (DAI) was evaluated. After the mice were sacrificed, the middle colon was taken to evaluate the pathological changes of the mice, and the content of the cecum was taken for 16S rDNA high-throughput sequencing. Results Compared with the NC group, the DAI score of the mice in DSS group was significantly increased, the colonic mucosal structure was damaged, and the diversity of intestinal flora was decreased, the relative abundances of Proteobacteria, Bacteroides, Escherichia-Shigella, Parabacteroides, and Ruminococcus torques were significantly increased, and the relative abundances of Firmicutes, Blautia, and Lachnospiraceae NK4A136 group were significantly decreased. The treatment of Huangqin Decoction can significantly reduce the disease activity of mice after modeling, repair the pathological damage of its colon and reverse the disturbance of intestinal flora. Conclusion Huangqin Decoction may play a therapeutic role by increasing the diversity of the flora and regulating the abundance of the flora in mice with damp-heat syndrome of ulcerative colitis, and improving the integrity of the intestinal mucosa to exert the function of biological barrier.7E0DD87B-56B0-4708-AA1B-C0DF1EB86194
〔Keywords〕 ulcerative colitis; damp-heat syndrome; Huangqin Decoction; intestinal flora; flora diversity; relative abundance of flora
溃疡性结肠炎(ulcerative colitis, UC)是慢性非特异性的肠道炎症性疾病,主要表现为反复发作的腹痛、腹泻伴黏液脓血便、里急后重等,且伴有其他非特异性全身症状。该病发病机制尚不明确,但越来越多的证据表明,肠道微生态失调可能会触发人体免疫系统,导致UC高炎症反应的发生[1]。中医学认为,在UC活动期,湿热证患者较为常见[2]。黄芩汤(Huang Qin Decoction, HQD)是《伤寒论》治疗湿热型下痢的良方,目前临床上多用来治疗UC湿热证型[3]。本研究拟从病证结合的角度建立UC湿热证小鼠模型,通过检测肠道菌群,探讨HQD治疗UC湿热证可能存在的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及高脂高糖饲料 C57BL/6雄性小鼠,购自北京华阜康生物科技股份有限公司,合格证号:SCXK(京)2019-0008,SPF级,6~8周,体质量(22±2) g。室温20~24 ℃,湿度为65%~70%,自由进食饮水。高脂高糖饲料购自广东省实验动物中心,主要包含20%蔗糖、15%猪油、1.2%胆固醇、0.2%胆酸钠、10%酪蛋白、0.6%磷酸氢钙、0.4%石粉、0.4%预混料、52.2%基础饲料,总能量4.4 kcal/g。
1.1.2 药品及试剂 葡聚糖硫酸钠(dextran sulfate sodium, DSS)购自MP Biomedicals公司,货号:160110,使用前用蒸馏水配制成2.5%浓度。HQD颗粒,购自华润三九医药股份有限公司,按照黄芩汤临床用量(黄芩9 g、白芍6 g、甘草6 g、大枣12枚,1枚大枣重约4 g)的比例,用蒸馏水配制。按照小鼠与人体表面积折算等效剂量,小鼠的用药剂量为9.1 g/kg。
无水乙醇(货号:100092683)、二甲苯(货号:10023418)、中性树胶(货号:10004160)均购自国药集团化学试剂有限公司;HE染液套装(Servicebio,货号:G1003)。
1.1.3 主要仪器 MGC-300H型人工气候培养箱(上海一恒科学仪器有限公司);nova-seq6000型测序仪(美国Illumina公司);Donatello型脱水机(DIAPATH);JB-P5型包埋机(武汉俊杰电子有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);JB-L5型冻台(武汉俊杰电子有限公司);KD-P型组织摊片机(浙江省金华市科迪仪器设备有限公司);Giotto型染色机(DIAPATH)、Nikon Eclipse E100型正置光学显微镜、NIKON DS-U3型成像系统均购自日本尼康公司。
1.2 研究方法
1.2.1 造模与给药方法 SPF级C57BL/6雄性小鼠,随机分为空白对照(NC)组、模型(DSS)组、黄芩汤(HQD)组,每组7只。适应性喂养1周后,NC组以普通饲料喂养,自由饮用纯净水。参照预实验及文献方法采用多因素法(饮食加环境配合灌服DSS水)建立UC湿热证小鼠模型[4]。(1)湿热证造模:每日给予小鼠足量高脂高糖饲料;同时,暴露在温度32 ℃、湿度90%的环境下,每天持续16 h,共造模15 d。(2)UC造模:给予小鼠2.5%DSS水(隔1天更换新鲜DSS水)自由饮用7 d。更换蒸馏水和正常饲料喂养,休息1 d后用药:NC组、DSS组予以同体积蒸馏水灌胃作对照,HQD组予以黄芩汤(9.1 g/kg)灌胃,每天1次,连续灌服7 d。
1.2.2 一般情况观察 造模前后,观察小鼠体质量、饮食和饮水量、毛发光泽度、精神状态、活动度、大便性状等。
1.2.3 疾病活动指数(disease activity index, DAI)
分别于灌胃前第1天、灌胃后第4天和第7天时观察小鼠大便、体质量、活动等,进行DAI评分。DAI=(体质量下降分数+大便性状分数+便血分数)。体质量下降包括5級(0分:体质量没有下降或上升;1分:1%<下降≤5%;2分:5%<下降≤10%;3分:10%<下降≤20%;4分:下降>20%);大便性状包括3级(0分:正常;1分:稀便;2分:腹泻);便血包括3级(0分:阴性;2分:潜血阳性;4分:严重出血)。
1.2.4 组织病理学 于冰上剪取中段结肠约0.5 cm,用冰生理盐水清洗后迅速固定于4%甲醛中;石蜡切片脱蜡至无水;苏木素染色3~5 min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗;85%、95%梯度乙醇脱水各5 min,伊红染色5 min;无水乙醇、二甲苯脱水后,中性树胶封片;显微镜镜检,图像采集分析。
1.2.5 肠道菌群的检测 按照16S rDNA测序要求,样本处理过程如下:(1)每组5只小鼠,处死小鼠后,剖腹,快速取盲肠内容物(1~2 g)置于冻存管,液氮速冻后,放入-80 ℃冰箱保存。(2)从样本中提取基因组DNA后,用带有序列条形码barcode的特异引物扩增16S rDNA的V3+V4区。引物序列为:341F:CCTACGGGNGGCWGCAG;806R:GGACTACHVGGGTA
TCTAAT。将纯化后的扩增产物连接测序接头,构建测序文库,Illumina平台PE250上机测序。测序后得到原始序列数据raw Reads,使用Usearch软件对其进行整理,获得分类操作单元(operational taxonomic units, OTUs)丰度和OTU代表序列。7E0DD87B-56B0-4708-AA1B-C0DF1EB86194
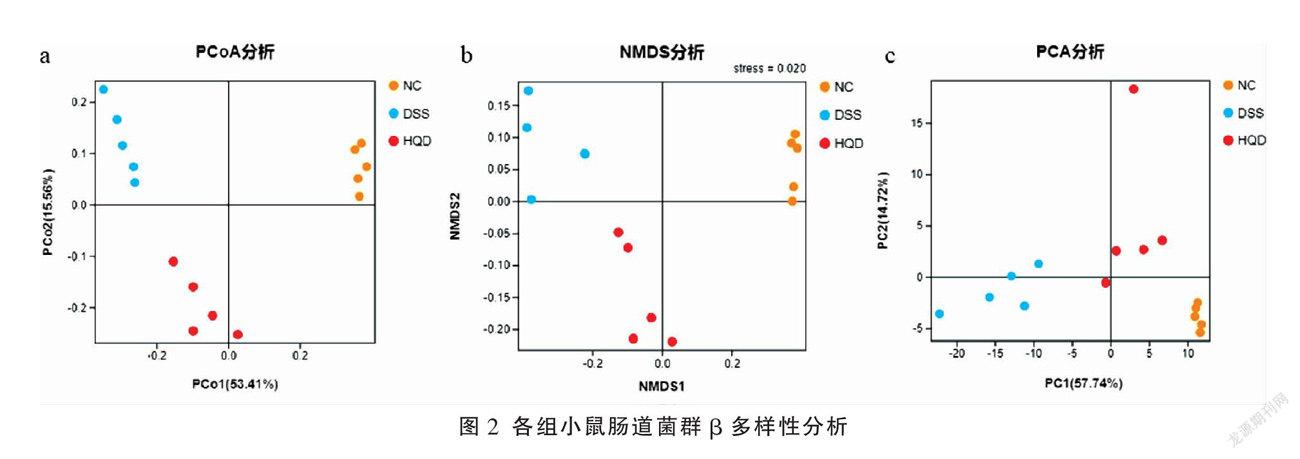
基于OTU序列和丰度数据,开展肠道菌群多样性分析和物种组成分析。前者主要包括α多样性分析和β多样性分析。从Chao、Shannon和Simpson 3个指数进行α多样性分析。Chao代表预测样品中所含有的OTU个数,提示样本的物种丰富程度。Shannon和Simpson综合体现样本中物种的丰富度和均匀度,Shannon和Simpson值越大,代表样本中的物种分布越均匀,多样性越高。从主坐标分析(principal co-ordinate analysis, PCoA)、非度量多维尺度分析(non-metric multi-dimensional scaling, NMDS)和主成分分析(principal component analysis,PCA)开展β多样性分析。PCoA主要评估各坐标轴对菌群结构总体差异的解释度,菌群结构相似度较高的样本会聚集在一起。NMDS使用stress值评估实验模型的准确性,stress值越小,表示模型越可靠。PCA基于OTU列表的物种丰度信息进行展开,提示样品组成越相似,反映在PCA图中的距离越近,而且不同环境间的样品往往可能表现出各自聚集的分布情况。物种组成分析主要进行门、属水平的检测,通过相对丰度对不同组别的小鼠肠道菌群的种类变化进行评价。整个测序及数据分析过程均由广州基迪奥生物科技有限公司完成。
1.3 统计学方法
所有实验数据以“x±s”表示。数据符合正态分布且方差齐时采用单因素方差分析(Dunnett),否则用秩和检验,P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义,采用GraphPad Prism 9软件进行统计分析。
2 结果
2.1 一般情况观察
NC组小鼠精神状态良好、饮食佳、毛色光亮、活动敏捷、小便清长、大便成形。DSS组小鼠湿热证造模时,反应稍迟钝、倦怠嗜睡、饮食量变化较小、毛发疏松无光泽、阴囊明显松弛下垂、小便黄、大便稍黏腻;UC造模时,DSS组小鼠喜扎堆蜷缩,行动迟缓,活动量明显减少,饮食饮水量明显减少,毛发疏松无光泽,小便黄,大便逐渐稀烂并伴有日渐加重的脓液及潜血。HQD组小鼠用药后,行动日渐灵活,饮食、饮水量逐渐增加,毛发恢复光泽,大便潜血消失并日渐成形。
2.2 各组小鼠不同时间点DAI评分比较
在造模结束未开始灌胃前1天,与NC组比较,DSS组和HQD组DAI评分明显增高(P<0.01);与DSS组比较,HQD组DAI评分差异无统计学意义(P>0.05)。在灌胃第4天,DSS组DAI评分较NC组明显增高(P<0.01);HQD组DAI评分较DSS组明显降低(P<0.01)。在灌胃第7天,DSS组DAI评分较NC組明显增高(P<0.01);HQD组DAI评分较DSS组明显降低(P<0.01)。详见表1。
2.3 各组小鼠结肠组织病理变化
与NC组比较,DSS组小鼠结肠黏膜损伤明显,腺体减少或消失,大量炎性细胞浸润,甚至出现异型增生。与DSS组比较,HQD组结肠黏膜隐窝结构明显,可见大量杯状细胞,结肠黏膜损伤较轻,黏膜下层少量炎性细胞浸润。详见图1。
2.4 各组小鼠肠道菌群的变化
2.4.1 多样性分析 α多样性分析:与NC组比较(表2),DSS组Shannon和Simpson指数均显著降低(P<0.01);Chao指数差异无统计学意义,但有下降趋势,提示UC湿热证小鼠肠道菌群丰富度和均匀度降低。与DSS组比较,HQD组Chao指数差异无统计学意义,但有上升趋势;Shannon和Simpson指数均显著提高(P<0.01),提示经HQD治疗后,UC湿热证小鼠肠道菌群的多样性显著升高。
β多样性分析:PCoA图中,PCo1+PCo2(图2a)的百分比达到68.97%,超过50%,提示分组关系较好。NMDS分析图中,stress值为0.02(图2b),提示模型可靠度较高。PCA分析图中,NC组、DSS组和HQD组分布于不同的区域(图2c),说明各组小鼠肠道菌群结构存在差异,DSS组小鼠在造模环境影响下,肠道菌群出现异常;经HQD干预后,HQD组小鼠肠道菌群更趋向于NC组小鼠肠道菌群。
2.4.2 物种组成分析 在门水平(表3),与NC组比较,DSS组变形菌门(Proteobacteria)相对丰度显著升高(P<0.01),厚壁菌门(Firmicutes)显著降低(P<0.01)。与DSS组比较,HQD组Firmicutes相对丰度显著升高(P<0.01),拟杆菌门(Bacteroidetes)、Proteobacteria显著降低(P<0.01)。在属水平(见表4),与NC组比较,DSS组拟杆菌属(Bacteroides)(P<0.01)、大肠埃希氏菌-志贺菌属(Escherichia-Shigella)(P<0.01)、副拟杆菌属(Parabacteroides)(P<0.01)、瘤胃球菌属(Rumino?
coccus torques)(P<0.01)相对丰度显著提高,布劳特氏菌属(Blautia)(P<0.05)、毛螺菌属(Lachnospiraceae NK4A136 group)(P<0.01)显著下降。与DSS组比较,HQD组能显著提升Blautia(P<0.01)的相对丰度,显著降低Bacteroides(P<0.01)、Ruminococcus torques(P<0.05)、Escherichia-Shigella(P<0.05)的相对丰度。7E0DD87B-56B0-4708-AA1B-C0DF1EB86194
3 讨论
UC属于中医学“肠澼”“休息痢”等范畴。禀赋虚弱、饮食不节、外感湿热等原因综合作用,造成脾失健运,湿热壅滞肠间,与气血相搏,气滞血瘀,导致UC湿热证发生[5]。现代研究发现,具有遗传易感背景的个体,在受到环境因素(饮食、气候、感染等)的影响下,肠道菌群结构异常,肠黏膜屏障功能失调,免疫调节功能紊乱,释放大量细胞因子和炎症介质,最终导致肠黏膜急慢性炎症和组织损伤[6]。同时,DSS模型是UC造模中最常用的方法,且该急性结肠炎模型与人类UC发病相似,是研究UC发病机制和评价药物疗效较为理想的模型[7]。因此,本实验基于中医学病因和西医病理复合因素,采用高脂高糖饮食加人工气候箱模拟体内外湿热环境,复合DSS诱导小鼠急性结肠炎,进行C57BL/6小鼠UC湿热证造模。针对湿热证评价,本研究主要从小鼠一般行为状态结合DAI指数等进行观察,发现DSS组小鼠懒动、精神变差、反应迟缓、进食饮水量减少、体质量减轻、尿黄、尿少、稀便甚至水样便等。从DAI指数和结肠病理学表现进行评估UC,病理可见肠黏膜充血、水肿,肠黏膜大量炎症细胞浸润,腺体减少或消失。综上表明,UC湿热证小鼠模型造模成功。
正常情况下,人体胃肠道大约有100万亿菌群居住,大部分是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)[8]。健康的肠道菌群处于平衡状态,高脂高糖饮食和湿热环境都会诱发小鼠肠道菌群异常。连续7 d摄入10%葡萄糖的小鼠,肠道乳酸杆菌(Lactobacillaceae)相对丰度降低,阿克曼氏菌(Akkermansiaceae)相对丰度升高,再使用DSS诱导小鼠结肠炎时,比正常饮食的小鼠更容易出现腹泻、直肠出血[9],因为Akkermansiaceae释放的酶降解肠道黏液,损伤黏液屏障,使肠道渗透性增加;高脂饮食组小鼠肠道菌群以Lachnospiraceae和Muribaculaceae为主[10];长时间湿热环境会破坏小鼠肠道生态平衡,Bacteroides、Parabacteroides、Mucispirillum相对丰度降低[11]。本研究发现:(1)UC湿热证小鼠肠道菌群多样性降低,物种丰富度和均匀度明显下降,提示肠道抵御环境变化的能力减弱。经黄芩汤治疗后,肠道菌群多样性提升,且结构与NC组较为相似。(2)UC湿热证小鼠肠道菌群组成改变。在门水平,主要体现在Proteobacteria相对丰度显著升高,Firmicutes显著降低,这与UC湿热证患者肠道菌群异常的趋势相同[12];在属水平,UC湿热证小鼠Bacteroides、大肠埃希氏菌-志贺氏菌属(Escherichia-Shigella)、Parabacteroides、Ruminococcus torques相对丰度显著提高,Blautia、Lachnospiraceae NK4A136 group显著下降;且黄芩汤能够显著纠正逆转以上趋势。
JIA、LUCKE等[13-14]研究认为,DSS诱导的溃疡性结肠炎Balb/c小鼠拟杆菌科(Bacteroidaceae)丰度明显提升且与结肠炎症状呈现正相关,UC患者的炎症或非炎症肠黏膜活检都显示拟杆菌门(Bacteroidetes)富集[14],提示炎症性肠病的发生可能与拟杆菌属(Bacteroides)密切相关。肠道患者大肠埃希氏菌-志贺氏菌属(Escherichia-Shigella)丰度提高[15],主要通过把细菌毒性蛋白转运到宿主细胞质来破坏肠道上皮细胞和引起免疫细胞功能失调,促使炎症性疾病发生[16]。柯一帆等[17]研究认为副拟杆菌属(Parabacteroides)的富集与UC湿热证发病相关性较强,推测脾虚湿热证组的UC患者肠型属于副拟杆菌型。Ruminococcus torques通过降低肠道屏障完整性引起炎症性肠病的发生,与炎症因子分泌量呈正相关[18]。布劳特菌属(Blautia)、毛螺菌属(Lachnospiraceae NK4A136 group)都属于厚壁菌门毛螺菌科,上调肠道调控T细胞核产生短链脂肪酸。短链脂肪酸是细菌发酵的主要终产物,为结肠上皮细胞的生成提供主要原料,维持肠道黏膜的完整性,避免炎症发生[19-20]。因此推断,黄芩汤可能通过减少破坏肠道黏膜完整性的菌属、增加保护肠道黏膜完整性的菌属来治疗UC湿热证。
综上所述,本研究从病证结合角度采用多因素复合法建立UC湿热证小鼠模型,并检测其肠道菌群变化,推测黄芩汤可能通过纠正UC湿热证小鼠肠道菌群的异常,提升肠黏膜的完整性以发挥生物屏障功能,从而减轻肠道炎症。黄芩汤影响UC湿热证小鼠肠道异常菌群的具体机制,有待进一步探索验证。
参考文献
[1] NASCIMENTO R P D, MACHADO A P D F, GALVEZ J, et al. Ulcerative colitis: Gut microbiota, immunopathogenesis and application of natural products in animal models[J]. Life Sciences, 2020, 258: 118129.
[2] 李 毅,樊新榮,刘 力,等.基于因子分析与聚类分析对溃疡性结肠炎中医证候规律的研究[J].中国中西医结合杂志,2017,37(10):1191-1195.
[3] 顾秀云,宋 振,宋秀梅.黄芩汤加减联合针刺治疗湿热蕴结证溃疡性结肠炎效果及对应激指标的影响[J].黑龙江医学,2021,45(19):2044-2046.
[4] 傅书山,朱 磊,王 琼,等.清肠化湿方对溃疡性结肠炎湿热证小鼠NLRP6蛋白及相关炎症因子表达的影响[J].中国中西医结合杂志,2020,40(5):582-588.7E0DD87B-56B0-4708-AA1B-C0DF1EB86194
[5] 王新月,劉 果,盛益华.溃疡性结肠炎流行病学特点与中医病因病机探讨[J].中国中医基础医学杂志,2011,17(5):481-482.
[6] MINER-WILLIAMS W M, MOUGHAN P J. Intestinal barrier dysfunction: Implications for chronic inflammatory conditions of the bowel[J]. Nutrition Research Reviews, 2016, 29(1): 40-59.
[7] 李富凤,王汝俊,潘华新,等.DSS诱导小鼠溃疡性结肠炎模型的动态评估[J].世界华人消化杂志,2015,23(11):1721-1727.
[8] YANG A L. A clinical primer of the role of gut microbiome in health and disease[J]. Tropical Gastroenterology, 2015, 36(1): 1-13.
[9] KHAN S, WALIULLAH S, GODFREY V, et al. Dietary simple sugars alter microbial ecology in the gut and promote colitis in mice[J]. Science Translational Medicine, 2020, 12(567): eaay6218.
[10] LIU Y, YANG K N, JIA Y Q, et al. Gut microbiome alterations in high-fat-diet-fed mice are associated with antibiotic tolerance[J]. Nature Microbiology, 2021, 6(7): 874-884.
[11] DENG L, XU H C, LIU P, et al. Prolonged exposure to high humidity and high temperature environment can aggravate influenza virus infection through intestinal flora and Nod/RIP2/NF-κB signaling pathway[J]. Veterinary Microbiology, 2020, 251: 108896.
[12] 李 舒.溃疡性结肠炎虚实证候分型与肠道菌群结构的差异性研究[D].咸阳:陕西中医药大学,2016: 23-28.
[13] JIA J H, ZHANG P P, ZHANG C X, et al. Sulfated polysaccharides from Pacific abalone attenuated DSS-induced acute and chronic ulcerative colitis in mice via regulating intestinal micro-ecology and the NF-κB pathway[J]. Food & Function, 2021, 12(22): 11351-11365.
[14] LUCKE K, MIEHLKE S, JACOBS E, et al. Prevalence of Bacteroides and Prevotella spp. in ulcerative colitis[J]. Journal of Medical Microbiology, 2006, 55(Pt 5): 617-624.
[15] XU J, CHEN N, WU Z, et al. 5-aminosalicylic acid alters the gut bacterial microbiota in patients with ulcerative colitis[J]. Frontiers in Microbiology, 2018, 9: 1274.
[16] GAD FRANKEL, ELIORA Z. RON. Escherichia Coli, a Versatile Pathogen[M]. Switzerland: Springer, 2018:1-26.
[17] 柯一帆,马芳笑,钟继红,等.19例不同中医证型溃疡性结肠炎患者肠道菌群的差异性[J].中医杂志,2019,60(22):1935-1941.
[18] HU R Z, HE Z Y, LIU M, et al. Dietary protocatechuic acid ameliorates inflammation and up-regulates intestinal tight junction proteins by modulating gut microbiota in LPS-challenged piglets[J]. Journal of Animal Science and Biotechnology, 2020, 11: 92.
[19] LIU X M, MAO B Y, GU J Y, et al. Blautia-a new functional genus with potential probiotic properties?[J]. Gut Microbes, 2021, 13(1): 1-21.
[20] ZHOU Q, MA L, ZHAO W Y, et al. Flaxseed oil alleviates dextran sulphate sodium-induced ulcerative colitis in rats[J]. Journal of Functional Foods, 2020, 64: 103602.7E0DD87B-56B0-4708-AA1B-C0DF1EB86194

