干旱胁迫与复水对北柴胡生长和根部次生代谢物含量的影响
刘乔斐
(安康学院现代农业与生物科技学院,安康 725000)
随着全球气候干暖化的持续加剧,水分已经成为世界干旱半干旱地区植物生长发育的首要限制因子,干旱胁迫后植物的恢复能力是评价其抗旱性强弱的重要指标[1]。
中药材生产以“优质、高产、稳定、可控”为发展方向,提高中药材栽培技术是保障中药材提质增效的根本任务[2]。 药用植物中的药效成分大多是其次生代谢物,当植株受到干旱、水淹、热害、冷害等环境胁迫后,细胞出现生理脱水或缺氧,渗透平衡被打破,引起膜脂过氧化、活性氧代谢失调、抗氧化酶活性改变,诱导体内的抗氧化防御反应,影响次生代谢产物的合成,进而影响药用植物的生长发育和药材质量[3-4]。 黄璐琦等[5]研究发现,水分胁迫能促进次生代谢产物的合成,有利于道地药材的形成。 次生代谢产物的积累是道地药材研究的热点之一,也是中药材生产的目的之一[6]。 柴胡(Bupleurum chinense DC.)为伞形科柴胡属多年生草本植物,主要以干燥的根入药。 柴胡味苦、辛,性微寒,具退热解表、升举阳气、疏肝解郁之功效,多用于治疗感冒发热、头痛目眩、月经不调、子宫下垂等[7]。 由于长期无节制采挖,野生柴胡资源濒临枯竭,已无法满足市场需求。 目前,柴胡药材主要来源于人工栽培,但因对柴胡生长习性了解不多,人工栽培调控措施不够完善,以致药材的质量和规格难以保证。 因此,加强柴胡栽培生产薄弱环节的理论研究,对实现柴胡质量稳定可控具有重要的促进作用。 本试验通过研究干旱胁迫与复水对北柴胡生长及多糖、皂苷和黄酮3 种主要药用成分积累的影响,旨在为柴胡规范化栽培提供理论依据和技术指导。
1 材料与方法
1.1 试验设计
试验材料为2 年生北柴胡,在陕西省宝鸡市陈仓区拓石镇孟家塬村陕西博仁药业柴胡基地开展盆栽试验。 选用上口径25 cm、高20 cm 的塑料花盆,每盆装土2.5 kg。 供试土壤为沙壤土,速效氮含量11.49 mg∕kg,速效磷含量3.34 mg∕kg,速效钾含量10.0 mg∕kg,土壤含水量为7.56%。 于2019 年4 月5日将2 年生柴胡移栽入塑料盆中,每盆3 株,共120 盆。 移栽后正常浇水,缓苗10 d 后进行干旱胁迫处理。 采用称重法进行水分控制,控水期间每天18:00 定时称盆质量,以盆质量的减少量为柴胡的当日耗水量,并加水补充至设定土壤含水量。 对照盆为裸土。 为保持盆内水分恒定,在每个塑料盆下面垫一张塑料纸。
试验设置4 个处理,每处理3 次重复,每组10 盆。 各处理分别是:(1)不胁迫处理组(CK):每日控水至土壤饱和含水量的75%;(2)一次干旱胁迫与复水周期(Ⅰ):每日控水至土壤饱和含水量的35%,持续干旱胁迫3 d 后恢复供水,使田间持水量达到土壤饱和含水量的75%,继续培养2 d;(3)两次干旱胁迫与复水周期(Ⅱ):每日控水至土壤饱和含水量的35%,持续干旱胁迫3 d 后恢复供水,使田间持水量达到土壤饱和含水量的75%,继续培养2 d,重复2 个周期;(4)三次干旱胁迫与复水周期(Ⅲ):每日控水至土壤饱和含水量的35%,持续干旱胁迫3 d 后恢复供水,使田间持水量达到土壤饱和含水量的75%,继续培养2 d,重复3 个周期。 分别于复水前和复水后1 d、2 d 各采样一次。
1.2 主要仪器与试剂
Waters 高效液相系统配有:Waters1525 二元泵,Waters2996 二极管阵列检测器,Waters sun-fire C18色谱柱(4.6 mm×250 mm,5 μm),Empower2 色谱分析软件;KQ3200DB 型数控超声波清洗器(昆山市超声仪器有限公司);3K15 型台式高速冷冻离心机(SIGMA);紫外可见分光光度计(PerkinElmer Lambda 35)。柴胡皂苷对照品均购于中国食品药品检定研究院(柴胡皂苷a 批号110777-201309,柴胡皂苷d 批号110778-201409),乙腈为色谱纯(美国Tedia 公司),氨水、甲醇等为分析纯。
1.3 测试项目与方法
1.3.1 柴胡生长指标的测定
各组随机选取3 株长势一致的植株,用直尺和游标卡尺分别测量柴胡的株高、根长和根直径,之后放入105 ℃烘箱杀青30 min 后80 ℃烘干至恒重,称量地上、地下干重,计算柴胡的生物量和根冠比[8]。
1.3.2 柴胡根中皂苷含量的测定
参考张宇等[9]的方法,取干燥至恒重的柴胡根研磨成粉末,准确称取0.2 g 于10 mL 离心管中,加含5%浓氨水的甲醇溶液8 mL,超声提取30 min,过滤,并用10 mL 甲醇分2 次洗涤离心管和残渣,7 000 r∕min离心10 min,取上清,洗液和滤液合并回收至干容量瓶。 残渣用适量甲醇溶解,并转移至5 mL容量瓶中,定容至刻度线处。 上样前用0.45 μm 滤膜过滤,作为样品溶液。 HPLC 条件参照2005 年版《中国药典》[10]。
1.3.3 黄酮类化合物的测定
称取烘干柴胡根样品2.0 g,置于50 mL 容量瓶中,加入甲醇35 mL 浸泡2 h 后超声提取30 min,加甲醇至刻度,放置24 h 即得总黄酮提取液。 根据王小青等[11]的方法,利用黄酮类化合物与吕盐反应生成红色络合物,以芦丁为对照品,紫外分光光度计测定总黄酮含量。 准确吸取提取液2.0 mL 置于25 mL 容量瓶,定容。 在510 nm 处测吸光值,代入公式Y=10.153X-0.007 3(R2=0.989 9),计算总黄酮含量。
1.3.4 多糖含量的测定
参考张立等[12]的方法,以无水葡萄糖为对照品绘制标准曲线,紫外分光光度计法测定可溶性糖和粗多糖的含量,总多糖含量为可溶性糖和粗多糖含量之和。
取柴胡粉碎样品1.0 g,置于250 mL 锥形瓶中,加入82%乙醇45 mL,超声提取30 min,过滤,重复2次,将滤液合并置于100 mL 容量瓶中,用82%甲醇定容。 取0.6 mL 滤液于试管中,加入0.4 mL 水、5 mL蒽酮硫酸溶液,于620 nm 处测定吸光度,代入Y=0.143 6X+0.033 6(R2=0.999 1),计算可溶性糖含量。
将250 mL 锥形瓶置于水浴锅,蒸干可溶性糖,剩下的滤渣中加入2% HCL 45 mL,沸水浴1 h,放置至室温后再过滤至100 mL 容量瓶中,重复提取一次。 合并滤液至100 mL 容量瓶中,用2% HCL 定容。 取0.6 mL于试管中,加入0.4 mL 水、5 mL 蒽酮硫酸溶液,于620 nm 处测定吸光度。 代入Y =0.143 6X +0.033 6(R2=0.999 1),计算粗多糖含量。
1.4 数据处理
利用SPSS 22.0 软件进行单因素方差分析,采用LSD 和Duncan 多重比较法进行显著差异性检验,采用SigmaPlot 12.0 软件作图。
2 结果与分析
2.1 不同干旱胁迫与复水周期对北柴胡生长指标的影响
由图1 可知,干旱胁迫后柴胡的根长和根直径均增加,株高降低。 复水前,处理Ⅰ、Ⅱ和Ⅲ的根长和根直径分别较CK 增加13.52%和21.58%、29.47%和21.58%、32.19%和38.0%,株高降低10.09%、21.16%和25.11%。
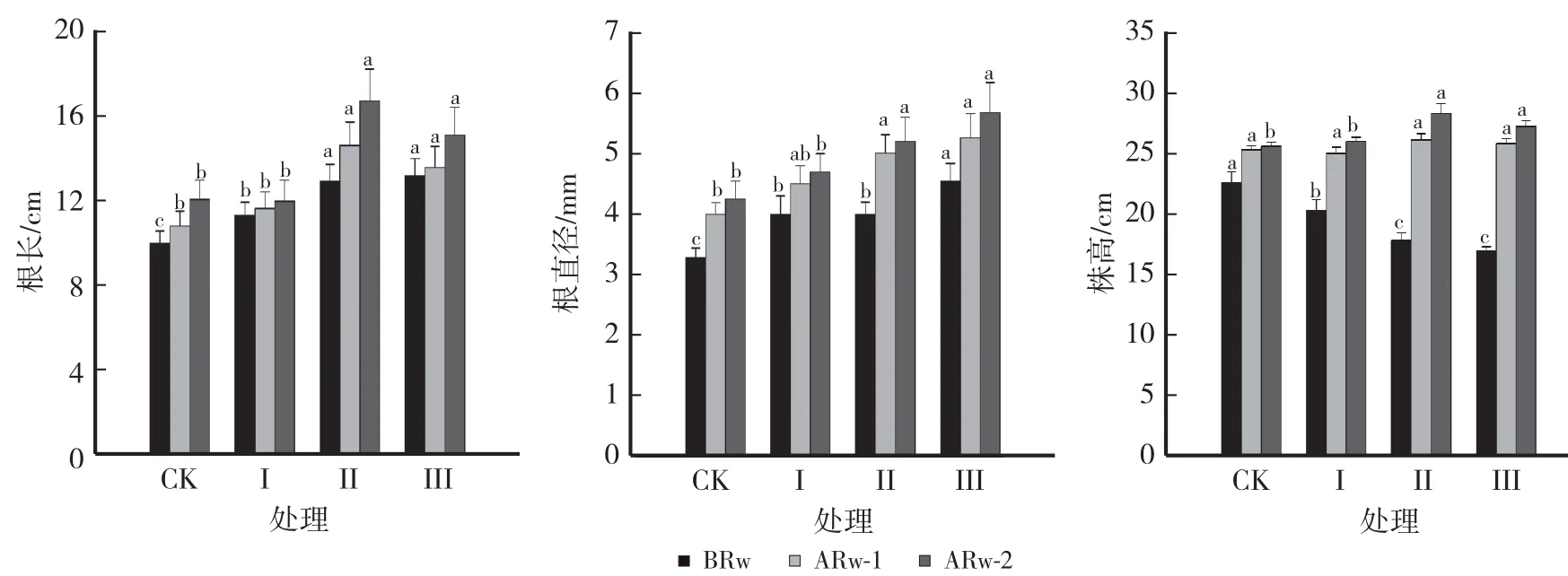
图1 不同处理对北柴胡根长、根直径和株高的影响Fig.1 Effects of different treatments on the root length,root diameter and plant height of B.chinense
复水后1 d,处理Ⅱ、Ⅲ的根长较CK 增加35.32%和25.54%,较复水前增加13.17%和2.82%。 各处理的根直径分别较CK 增加12.5%、25.3%和15.9%。 处理Ⅱ的株高较CK 增加3.21%,处理Ⅰ、Ⅲ的株高与CK 差异不显著;处理Ⅰ、Ⅱ、Ⅲ的株高分别较复水前增加23.23%、46.79%和52.70%。 复水后2 d,与CK 相比,处理Ⅱ、Ⅲ的根长分别增加38.56%和25.21%,根直径分别增加22.35%和33.41%,株高分别增加10.75%和6.47%,处理Ⅰ的根长、根直径和株高与CK 差异均不显著。 综上,复水后柴胡的根长和株高表现出一定的补偿效应,其中处理Ⅱ的增幅效应较明显。
由图2 可知,干旱胁迫后柴胡的根干重不断降低,根冠比先减小后增大。 复水前,处理Ⅰ、Ⅱ和Ⅲ的根干重分别较CK 降低14.04%、31.58%和42.11%,根冠比降低46.74%、34.82%和16.48%。 复水后1 d,处理Ⅰ、Ⅱ、Ⅲ的根干重分别较复水前增加4.08%、17.95%和78.79%;处理Ⅰ、Ⅱ和Ⅲ的根冠比分别较复水前增加1.0%、6.88%和3.44%。 复水后2 d,处理Ⅰ、Ⅱ、Ⅲ的根干重分别较CK 增加17.54%、64.91%和117.54%,表现出明显的补偿效应,处理Ⅲ的增幅效应较明显。 处理Ⅰ的根冠比仍显著低于CK,处理Ⅱ的根冠比恢复到CK 水平,处理Ⅲ的根冠比较CK 增加65.94%,表现出一定的补偿效应。
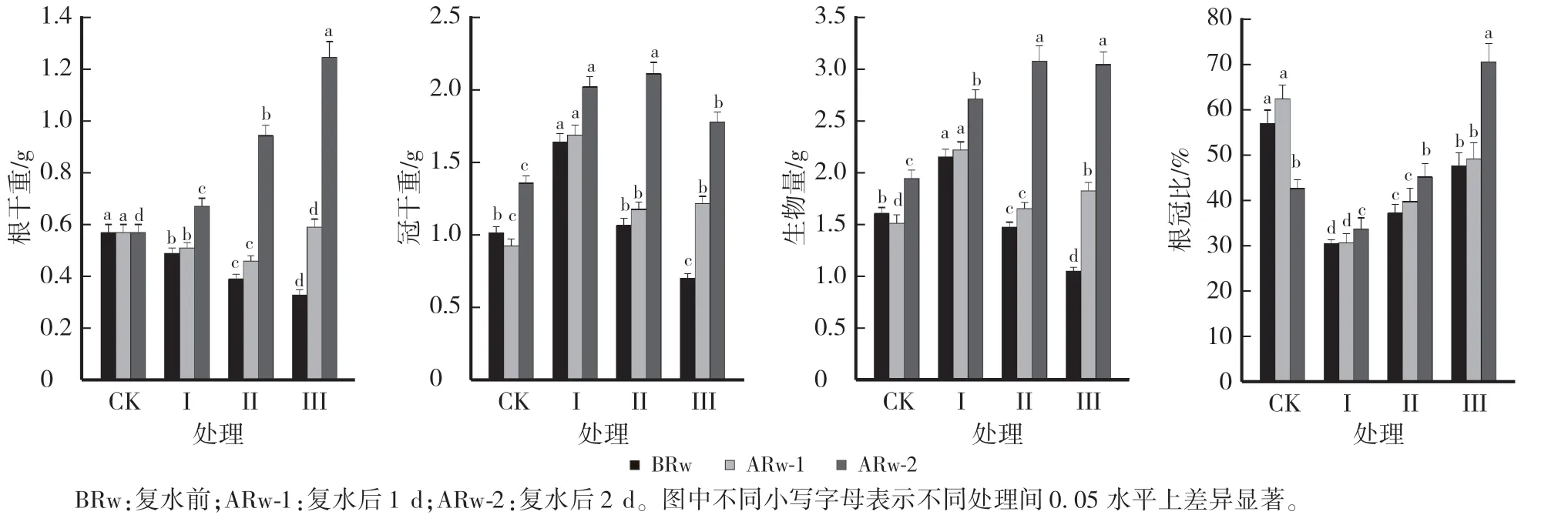
图2 不同处理对北柴胡根干重、冠干重、生物量和根冠比的影响Fig.2 Effects of different treatments on the root dry weight,shoot dry weight,biomass and root shoot ratio of B.chinense
随着干旱胁迫周期的增加,柴胡的冠干重和生物量均表现出先增加后降低的趋势。 复水前,与CK 相比,处理Ⅰ的冠干重和生物量分别增加61.39%和34.18%,处理Ⅲ的冠干重和生物量分别降低30.69%和34.81%,处理Ⅱ的冠干重与CK 差异不显著,生物量显著降低。 复水后1 d,处理Ⅰ、Ⅱ和Ⅲ的冠干重和生物量分别较CK 增加82.61%和46.98%、27.17%和9.40%、31.52%和20.81%,较复水前增加3.07%和3.30%、10.38%和12.41%、72.86%和74.76%。 复水后2 d,冠干重和生物量持续增加。 处理Ⅰ、Ⅱ和Ⅲ的冠干重和生物量分别较CK 增加48.89%和39.58%、55.56%和58.33%、31.11%和56.77%,较复水前增加23.31%和26.42%、98.11%和109.66%、152.86%和192.23%,表现出明显的补偿效应,处理Ⅲ的增幅效应较明显。
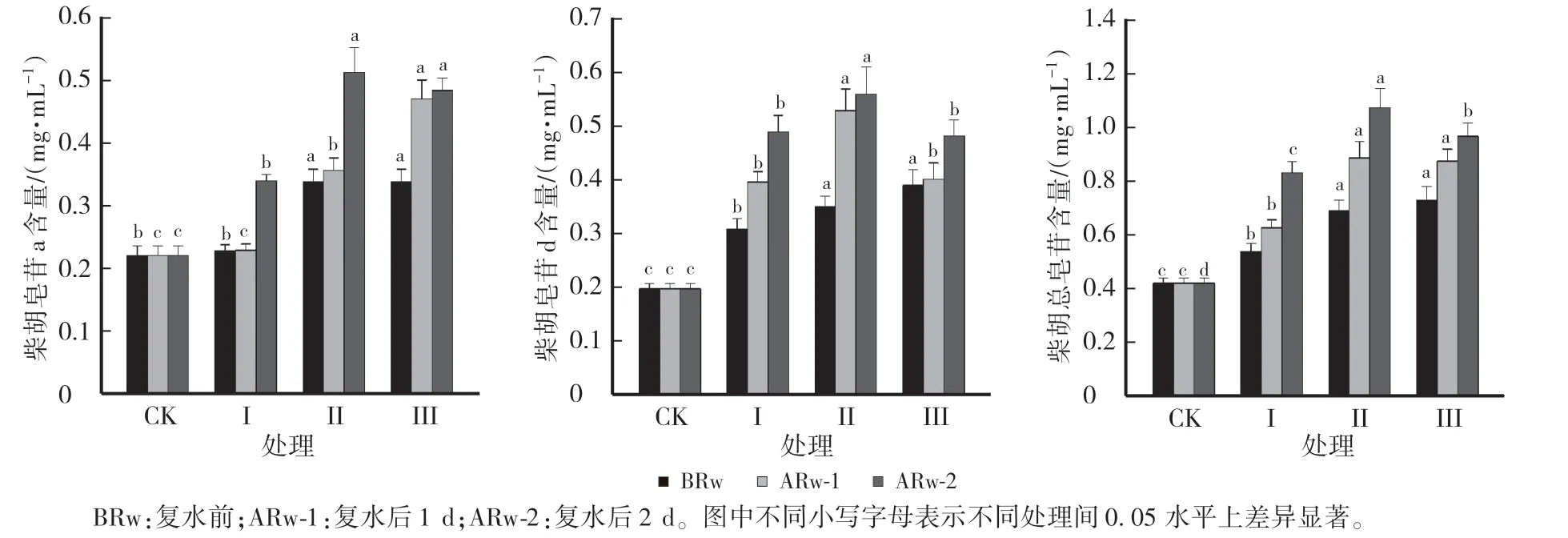
图3 不同处理对北柴胡根中柴胡皂苷a、d 和总皂苷含量的影响Fig.3 Effects of different treatments on the content of saikosaponin a,d and total saikosaponin in the root of B.chinense
2.2 不同干旱胁迫与复水周期对柴胡根中皂苷含量的影响
由图3 可知,干旱胁迫后柴胡根中的柴胡皂苷a、d 和总皂苷含量均增加。 复水前,与CK 相比,处理Ⅱ、Ⅲ的柴胡皂苷a 的含量均显著增加,处理Ⅰ与其差异不显著;处理Ⅰ、Ⅱ、Ⅲ的柴胡皂苷d 和总皂苷的含量分别增加55.78%和28.10%、76.88%和64.29%、96.48%和73.57%,柴胡总皂苷的含量随着干旱周期的增加不断增加。 复水后1 d,与CK 相比,处理Ⅱ、Ⅲ的柴胡皂苷a 含量增加61.09%和112.67%,较复水前增加5.33%和39.05%,处理Ⅰ与CK 差异不显著;处理Ⅰ、Ⅱ、Ⅲ的柴胡皂苷d 和总皂苷含量分别增加99.50%和49.05%、 166.33%和110.95%、 102.51%和107.86%。 复水后2 d,柴胡皂苷a、皂苷d 和总皂苷含量持续增加。 处理Ⅰ、Ⅱ、Ⅲ的柴胡皂苷a、皂苷d 和总皂苷含量分别较CK 增加53.85%、146.73%和97.86%,131.67%、181.91%和155.48%,118.55%、142.71%和130.0%,表现出明显的补偿效应,处理Ⅱ的增幅效应较明显。
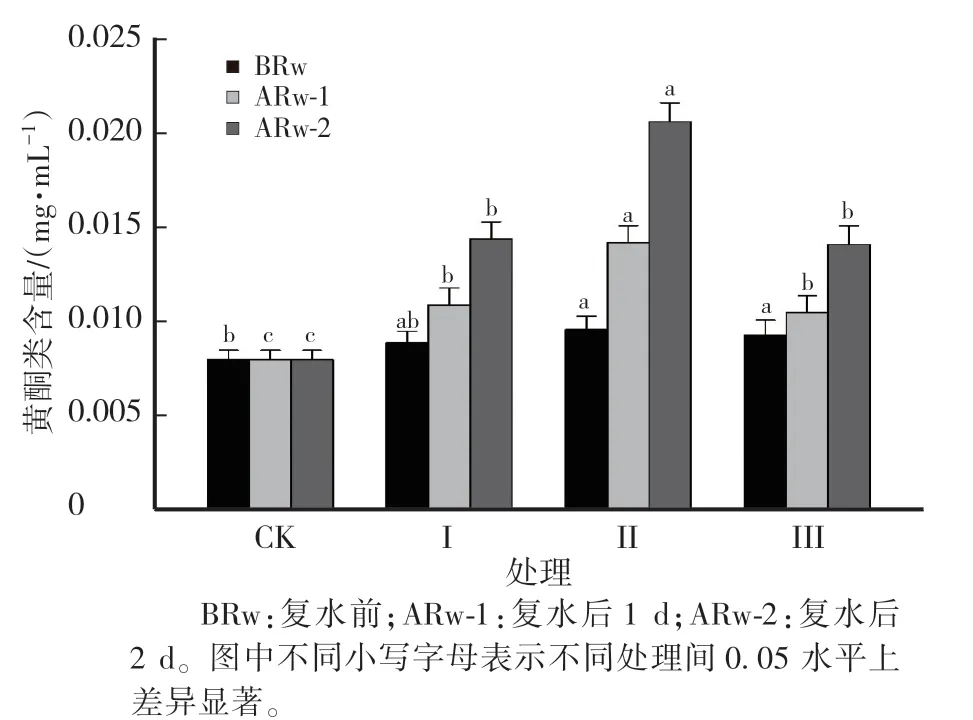
图4 不同处理对北柴胡中黄酮类含量的影响Fig.4 Effects of different treatments on the content of flavonoid in the root of B.chinense
2.3 不同干旱胁迫与复水周期对北柴胡根中黄酮类和多糖含量的影响
由图4 可知,干旱胁迫后柴胡根中的黄酮含量增加。 复水前,处理Ⅱ、Ⅲ下黄酮类的含量分别较CK 增加20.0%和16.25%,处理Ⅰ与CK 差异不显著。 复水后1 d,处理Ⅰ、Ⅱ、Ⅲ的黄酮类含量分别较CK 增加36.25%、77.5%和31.25%,较复水前增加22.47%、47.92%和12.90%;复水后2 d,黄酮类的含量增加,处理Ⅰ、Ⅱ、Ⅲ的黄酮类的含量分别较CK 增加80.0%、157.50% 和 76.25%, 较 复 水 前 增 加 61.80%、114.58%和51.61%,表现出明显的补偿效应,处理Ⅱ的增幅效应最明显。
由图5 可知,干旱胁迫后柴胡中的可溶性多糖、粗多糖和总多糖含量均增加。 复水前,处理Ⅰ、Ⅱ、Ⅲ的可溶性糖、粗多糖和总多糖的含量分别较CK 增加395.45%、21.74%和47.01%,412.50%、28.71%和54.67%,239.77%、29.61%和44.56%。 复水后1 d,处理Ⅰ、Ⅱ、Ⅲ的可溶性糖、粗多糖和总多糖的含量分别较CK 增加437.50%、23.30% 和51.30%,580.68%、32.57% 和70.21%,398.86%、33.22% 和62.79%,较复水前增加8.49%、1.28% 和2.92%,32.82%、7.52% 和10.05%,46.82%、2.20% 和12.61%;复水后2 d,处理Ⅰ、Ⅱ、Ⅲ的可溶性糖、粗多糖和总多糖的含量分别较CK 增加462.50%、28.06%和57.43%,700.0%、65.87%和108.73%,450.0%、48.24%和75.42%,较复水前增加13.53%、5.19%和7.08%,56.10%、28.87%和34.95%,61.87%、13.72%和21.35%,表现出明显的补偿效应,处理Ⅱ的增幅效应较明显。
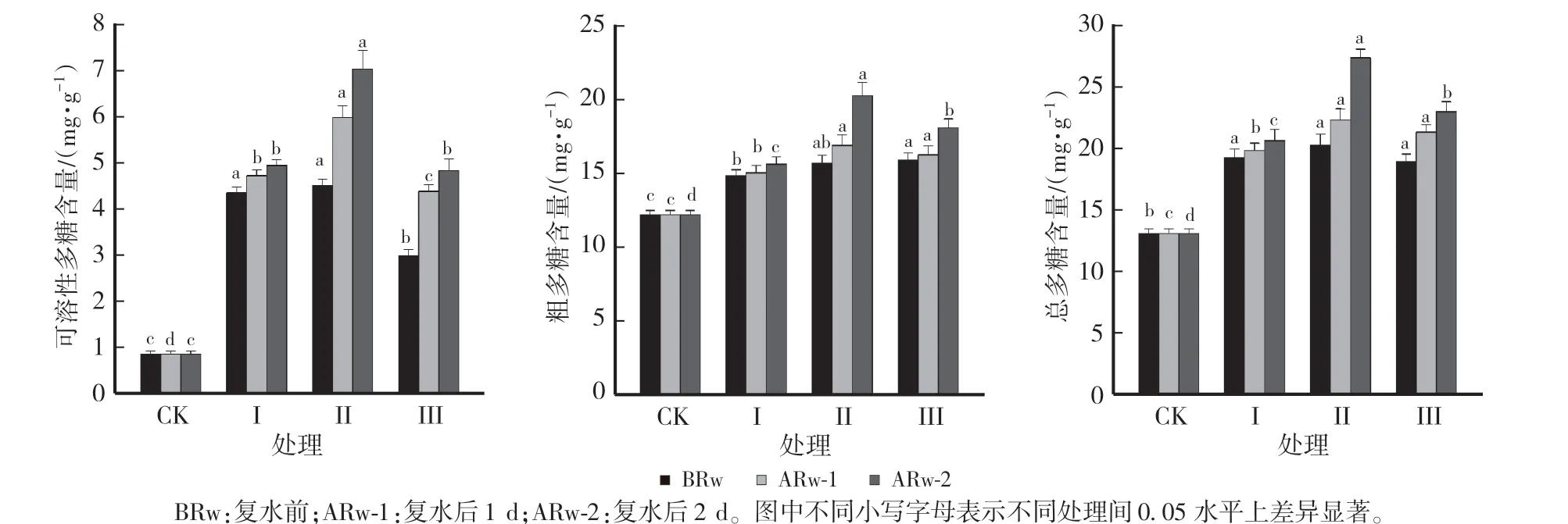
图5 不同处理对北柴胡中可溶性糖、粗多糖和总多糖含量的影响Fig.5 Effects of different treatments on the content of soluble sugar,crude polysaccharide and total polysaccharides in the root of B.chinense
3 结论与讨论
柴胡以根入药,一般认为根越粗、越长,药材所含总皂苷、黄酮、多糖含量越高,柴胡药材品质越好[13]。根类中药材,作为一类特殊的植物,其生长和药效成分的合成积累与环境水分密切相关[14]。 适宜水分条件下,药用植物根系生长良好,构型合理,产量高,但不利于药效成分的合成[15]。 研究表明,适度干旱胁迫可以调节植物地上、地下生物量的分配,促进根系生长[16],增强药用植物体内次生代谢,促进药效成分的合成与积累[17],从而提高中药材的产量与品质。 曾智等[18]研究发现,适度干旱和适量钾肥有利于厚朴中主要药效成分厚朴酚与和厚朴酚的积累。 孔德鑫等[19]研究发现,适当的干旱胁迫有利于两种鸡骨草中皂苷含量的积累。 邓婉月等[20]研究发现,轻度和中度干旱胁迫有利于丹参中酚酸和丹参酮类活性成分的积累。 本研究中,干旱胁迫促进柴胡根系的生长,抑制株高的增加,促进柴胡根中皂苷、黄酮、多糖等次生代谢产物的合成。 复水后柴胡的生长抑制程度有所缓解,表现出一定的补偿效应。 分别表现为:两次、三次干旱复水周期下柴胡的根长、根干重、冠干重和根冠比显著增加,这与前人的研究结果一致[21],说明干旱胁迫能够促进柴胡根系的生长,增加根系的吸水面积[16]。
可溶性糖作为重要的渗透调节物质,在植物抵御逆境胁迫时具有降低细胞渗透势和水势,维持膨压的作用[22]。 本研究中,不同干旱胁迫与复水周期下柴胡根的可溶性糖含量显著增加,有利于提高柴胡的抗旱性能。 黄酮类化合物是药用植物中重要的次生代谢产物,具有多种生理生化功能,能够通过抗氧化作用在一定程度上减轻干旱胁迫引起的膜脂抗氧化作用对植物造成的伤害[23]。 本研究中,干旱胁迫下柴胡根的黄酮化合物积累量增加,这与李柯等[24]和屠玲艳等[25]的研究结果相似,说明柴胡遭遇水分亏缺时,其体内黄酮代谢增强,柴胡的抗氧化能力提高,进而抵制因干旱胁迫产生的自由基[26]。
本研究中,不同干旱复水周期下柴胡根中皂苷a、皂苷d、黄酮类、可溶性糖、粗多糖、总多糖的含量均增加,其中两个干旱复水周期下各指标的增幅效应最明显。 表明当环境水分亏缺时,柴胡生长受到抑制,同化产物减少,次生代谢增强,次生代谢产物积累用于抵御逆境胁迫[9];但若干旱胁迫持续加剧,柴胡自身生长受阻,次生代谢产物合成最终也会减少[5]。 梁建萍等[27]研究发现,轻度水分胁迫能有效启动黄芪体内次生代谢,通过降低地上部分的生长,将营养物质优先运往根部,促进根产量及药材质量的提高。 胡娅婷等[14]研究发现,轻度干旱胁迫能够有效促进黄芪幼苗生长并提高黄芪药材品质,但重度干旱胁迫下次生代谢物含量降低。
综上,柴胡具有一定的耐旱性;干旱胁迫有利于柴胡生物量向地下部的转移,可以促进柴胡有效成分的积累;复水对柴胡的干旱锻炼具有正向补偿效应。 因此,在人工栽培柴胡时,要采用科学合理的控水方式,在保障植物正常生长的同时,促进柴胡次生代谢产物的积累,提高柴胡的产量和品质。

