成人肺内支气管源性囊肿的CT 表现
马延贺 宋振春 元伟
天津市胸科医院影像科,天津 300222
支气管源性囊肿是前肠畸形的一种,是由于在胚胎发育过程中,肺实质的细胞和(或)肺芽脱落导致的肺先天性发育畸形[1]。支气管源性囊肿最常发生于纵隔,也可发生于肺内、颈部及腹部[2],当其发生在肺内时表现多样,需要与肺内多种疾病相鉴别[3]。我们回顾性分析了经组织病理学检查结果证实的46 例肺内支气管源性囊肿患者的影像学资料,探讨其CT 影像学特征及CT 对其的鉴别诊断价值。
1 资料与方法
1.1 一般资料
回顾性分析2014 年2 月至2019 年12 月于天津市胸科医院经组织病理学检查结果证实为肺内支气管源性囊肿的46 例患者的影像学资料,其中男性25 例、女性21 例,年龄23~74(48.3±8.1)岁。患者临床表现以咳嗽、咳痰为主(20 例),其他症状有发热(6 例)、咯血(3 例)、痰中带血(3例)、胸痛或胸闷(2 例),其余患者为体检偶然发现(12 例)。纳入标准:经组织病理学检查结果确诊为肺内型支气管源性囊肿且具有CT 平扫或增强CT 检查资料的患者。排除标准:经组织病理学检查结果确诊为非肺内型支气管源性囊肿且无CT 检查资料的患者。所有患者均于检查前签署了知情同意书。本研究符合《赫尔辛基宣言》的原则。
1.2 扫描方法
46 例患者均行CT 平扫检查,其中31 例同时行增强CT 检查。所有患者均采取平卧位,于吸气相采集数据。CT 平扫使用荷兰Philips 公司的Brilliance 16 层螺旋CT,扫描参数:管电压120 kV、管电流200 mA、层厚和层距均为1.5 mm。增强CT 扫描使用荷兰Philips 公司的 Brilliance 256 层iCT,扫描参数与CT 平扫相同;采用高压注射器进行双期注射,先经肘静脉注射由德国拜耳公司生产的对比剂碘普罗胺80 ml(浓度为370 mgI/ml),再注射40 ml 生理盐水,延迟30 s、120 s 进行扫描,对比剂及生理盐水注射速度均为4 ml/s,扫描范围自肺尖至肺底部。肺窗、纵隔窗的窗宽分别为1600 HU、−500 HU,窗位分别为400 HU、40 HU。
1.3 图像分析
由2 位影像科诊断医师(均为主治医师,分别具有10 年、11 年工作经验)分别阅片,意见有分歧时由第3 位影像科诊断医师(副主任医师,具有15 年工作经验)诊断决定。根据病变在CT 图像上的密度及形态不同,将肺内支气管源性囊肿分为含液囊肿、含气囊肿、蜂窝及肿块样囊肿(部分囊肿壁不规则增厚型含气囊肿类似癌性或结核空洞,归为肿块样囊肿;具有气液平面囊肿,合并囊肿壁不规则、周围肺组织改变时,需与肺脓肿等疾病相鉴别,此类归为蜂窝样囊肿)。分析支气管源性囊肿在肺内的分布、数量、形态(圆形或类圆形、葫芦状、不规则形、蜂窝样等)、密度、延迟强化变化、病变周围肺组织情况及并发症;分析囊肿内及囊肿壁的密度。对接受增强CT 检查的患者,评价行增强CT 前后病变的影像学表现,如实性部分的强化程度、分隔等。
2 结果
2.1 CT 表现
46 例肺内支气管源性囊肿患者中,单发42 例、多发4 例(3 例位于同侧肺的不同肺叶,1 例位于双肺)。位于右肺上叶、中叶、下叶的病变数量分别为10 个、7 个、11 个;位于左肺上叶、下叶的病变数量分别为10 个、12 个。46 例支气管源性囊肿患者的CT 表现与组织病理学检查结果见表1。
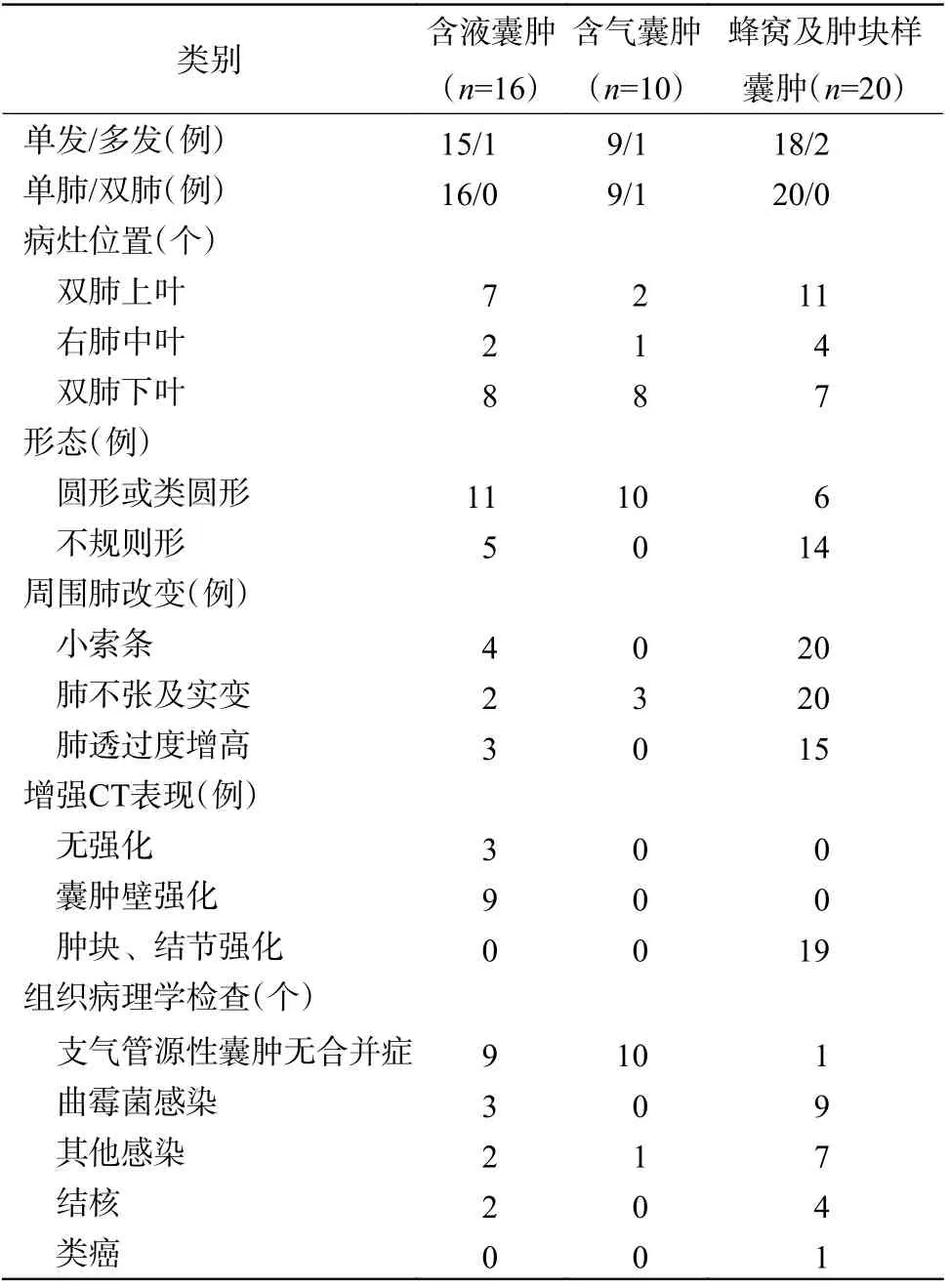
表1 46 例支气管源性囊肿患者的CT 表现及组织病理学检查结果Table 1 CT findings and histopathological examination results of 46 patients with bronchogenic cyst
2.1.1 含液囊肿
16 例患者CT 表现为含液囊肿(球形灶),其中15 例为单发,1 例合并同侧肺含气囊肿。在CT 横断面上,11 例呈圆形或类圆形,5 例呈不规则形(3 例呈分叶状,2 例呈葫芦状);在CT 冠状面或斜冠状面上重建显示,长轴或近似长轴平行于支气管的血管束病变最大径为2~7 cm,边界较清晰,囊肿壁大多较薄且均匀,仅3 例囊肿壁可见钙化,囊肿内密度较均匀,CT 值为5~64 HU。12 例CT 表现为单纯含液囊肿(图1A),4 例CT表现为线状分隔的多房含液囊肿。
16 例含液囊肿患者中有12 例同时行增强CT 检查发现,9 例含液囊肿患者的内容物未见强化,囊肿壁呈轻、中度强化;3 例线状分隔的多房含液囊肿患者的内线状分隔显示更为清晰。
以上患者的CT 合并表现:4 例囊肿周围可见小索条影;3 例囊肿周围可见肺透过度增高;2 例较大囊肿周围可见条带状肺不张及实变,邻近肺叶容积受压变小并可见肺叶间胸膜移位。术后组织病理学检查结果证实,本组患者支气管源性囊肿病灶无合并症9 个;合并曲霉菌感染3 个、结核2 个、其他感染2 个。
2.1.2 含气囊肿
10 例患者CT 表现为含气囊肿,其中9 例为单发,1 例为双肺下叶各有1 个含气囊肿,均呈圆形或类圆形,最大径为2~10 cm(图1B)。囊肿的内壁光滑,囊肿壁较薄(< 2 mm),仅1 例患者囊肿壁可见点状钙化。
以上患者的CT 合并表现:3 例较大囊肿周围可见条带状肺不张及实变,邻近肺叶间胸膜移位。术后组织病理学检查结果证实,本组患者支气管源性囊肿病灶无合并症10 个,仅1 个病灶合并囊肿壁感染及囊肿周围肺感染。
2.1.3 蜂窝及肿块样囊肿
20 例患者CT 表现为蜂窝及肿块样囊肿,其中18 例为单发,2 例位于同侧肺的不同肺叶。6 例CT 表现为大小不等的圆形或类圆形小囊腔,部分小囊腔内可见气液平面,其中3 例囊腔内合并曲霉菌感染,2 例偏心空洞内可见曲霉菌球及新月形裂隙(图1C、E)。14 例CT 表现为不规则形,其中2 例不规则囊腔,分叶状、囊肿壁厚度不均匀(其中1 例囊肿壁可见钙化),此2 例囊肿壁均可见结节影(其中1 例结节为曲霉菌,另1 例为类癌结节)(图1D、F);12 例表现为不规则软组织影,与周围分界不清,内部密度不均匀,其中3 例表现为分叶状。
20 例蜂窝及肿块样囊肿患者中19 例行增强CT 检查结果显示,病变内肿块及结节可见不同程度强化。增强后气液平面、液体成分分界更为清晰;3 例分叶状实性肿块呈明显不均匀强化,术后组织病理学检查结果证实合并感染、局部坏死;1 例呈明显强化的结节,术后组织病理学检查结果证实为类癌。
以上患者的CT 合并表现:20 例支气管源性囊肿患者的囊肿周围均可见小索条和肺不张及实变,其中15 例合并有肺透过度增高、3 例合并肺裂不全。经术后组织病理学检查结果证实,本组患者支气管源性囊肿病灶无合并症1 例,合并曲霉菌感染9 个、结核4 个、其他感染7 个、类癌1 个。
2.2 组织病理学检查结果
46 例患者均行外科手术,术后组织病理学检查结果证实,囊肿内病灶合并曲霉菌感染12 个,其他感染10 个,结核6 个;囊肿内发现肿瘤病灶1 个(类癌),表现为不规则囊肿壁的结节影,结节较光滑(图1D)。
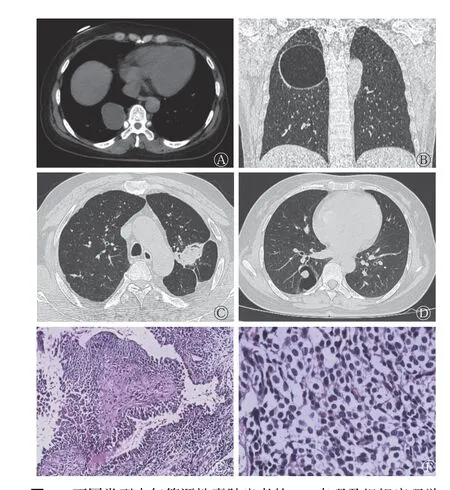
图1 不同类型支气管源性囊肿患者的CT 表现及组织病理学检查图 A 为单纯含液囊肿患者(男性,46 岁)的横断面纵隔窗CT 平扫图,显示右肺下叶类圆形低密度囊肿,边缘较清晰,密度较均匀;B 为单纯含气囊肿患者(女性,52 岁)的冠状面肺窗CT 平扫图,显示右肺上叶巨大支气管囊肿,囊肿壁较薄且光滑,外缘可见少许肺实变;C 为蜂窝及肿块样囊肿患者(男性,49 岁)的横断面肺窗CT 平扫图,显示左肺上叶不规则肿块,密度不均匀,可见含气影,前部见裂隙样空洞;D 为囊肿壁结节患者(女性,48 岁)的横断面肺窗CT 平扫图,显示右肺下叶含气囊肿样影,囊肿壁厚度不均匀,内壁可见圆形结节;E 为蜂窝及肿块样囊肿患者(与C 为同一例患者)的术后组织病理学检查图(过碘酸雪夫染色,×400),显示曲霉菌球的类圆形断面,菌丝粗细均匀,为支气管源性囊肿合并曲霉菌感染;F 为囊肿壁结节患者(与D 为同一例患者)的术后组织病理学检查图(苏木精-伊红染色,×40),显示类癌细胞核染色体呈多发的细颗粒状,为支气管源性肿合并类癌。CT 为计算机体层摄影术Figure 1 CT findings and histopathological examination images of different types of bronchogenic cyst
3 讨论
肺的发育一般始于受孕后第4 周,原始内胚层形成呼吸憩室(喉、气管、支气管和肺的原基,其末端发育膨大形成左右肺芽,并逐级呈树枝状发育)。若在发育过程中发生障碍,一段或多段支气管脱落至不同部位单独发育,则会形成单发或多发的囊肿。根据发病部位的不同,支气管源性囊肿分为纵隔型、肺内型和异位型。肺内型约占先天性肺囊性病变的50%,在组织病理学上主要表现为内衬纤毛柱状上皮的囊壁,同时可见腺体、平滑肌和软骨组织;发生在非肺内部位时,通常表现为水样密度的球形肿块,且无症状。发生在肺内的支气管源性囊肿较为少见,由于囊肿的大小、密度、是否与支气管相通和合并感染等原因,其临床和影像学表现差异较大。
3.1 CT 表现
肺内支气管源性囊肿多为单发,少数为多发。Cardinale 等[4]发现,肺内支气管源性囊肿以右肺、下叶多见。但本研究及Le 等[5]的研究结果显示,肺内支气管源性囊肿患者的肺内病灶分布不具有特征性,这可能与研究的样本数有关。根据支气管源性囊肿的密度不同,一般可分为3 种类型:(1)含液囊肿;(2)含气囊肿;(3)具有气液平面或混杂密度的囊肿或肿块,通常表现为蜂窝及肿块样囊肿[5-6]。多数含液囊肿在CT 图像上表现为清晰、孤立的圆形或类圆形、密度较均匀的囊肿;在影像学上表现为病变的长轴与支气管走行方向一致。含液囊肿的CT 值与纵隔型支气管源性囊肿的CT 值相似,不同成分的内容物具有不同的CT 值,影像学上CT 值的改变是由于囊液成分的改变所致(当囊液内含有高蛋白成分或囊肿出血、钙乳沉积时,CT 值升高)[6]。在囊肿发生过程中或感染后,可形成与支气管相通的活瓣,导致囊肿内成分发生改变,在CT 上可表现为含气囊肿、气液囊肿或肿块;而当支气管与囊肿间存在活瓣性阻塞时,气体进入容易排出困难,可形成张力性囊肿,囊肿体积较大导致肺组织受压不张[7]。本研究中最大的1 例含气囊肿最大径达10 cm,周围可见肺不张。非含液囊肿可表现为多种形态,如葫芦状、长条、不规则形或蜂窝样,这与囊肿内容物、合并感染和出血等有关[7]。
囊肿壁也有多种表现。单纯含液囊肿或含气囊肿的囊肿壁厚度均匀,呈细线样。当囊肿壁内含有支气管壁软骨成分时密度较高,软骨退变时可出现点状或弧线状钙化。感染或出血时,囊肿壁或囊肿内也可见钙化。本研究中有5 例患者的CT 图像表现为不规则囊肿壁钙化。当发生感染时,囊肿壁平滑肌和弹力纤维受到刺激,增生形成肉芽肿,导致囊肿壁不规则增厚,周围出现纤维灶、小索条、斑片、肺实变,甚至出现软组织肿块影。本研究中10 例患者的CT 图像表现为肺内不规则软组织肿块影,内部密度不均匀,边缘可见小索条、斑片、磨玻璃密度影、局限性肺透过度增高。
增强CT 检查对蜂窝及肿块样支气管源性囊肿的诊断价值更高。本研究中行增强CT 检查的患者以蜂窝及肿块样囊肿为主,其对病变内部成分的显示、与周围结构的区分具有一定的鉴别诊断意义,如增强CT 检查易区分周围的肺不张及实变与囊肿壁;对于不规则空洞囊肿且具有囊肿壁结节的患者,囊肿壁及结节的强化方式对合并感染或肿瘤具有一定的鉴别诊断价值。
3.2 合并症和并发症
肺内支气管源性囊肿可有多种合并症、并发症,可合并有其他先天性发育异常[8],最常见的是合并有肺裂不全、邻近肺组织局部发育不良,本研究中我们发现有3 例合并肺裂不全。肺内支气管源性囊肿常合并曲霉菌或结核感染,结核患者可有其他肺段结核病变(如钙化结节、纤维灶、小索条等)。囊肿合并结核可表现为肿块或空洞;囊肿合并曲霉菌感染形成曲霉菌球,可有裂隙样空洞(新月形)、钙化等征象。囊肿内发生感染,囊肿壁在炎症的刺激下可发生恶变,表现为囊肿壁结节、不规则增厚或肿块[9-10]。本研究中1 例48 岁女性右下肺支气管源性囊肿患者的囊肿壁可见结节,术后组织病理学检查结果证实为类癌。囊肿周围肺组织的改变主要是受压和伴感染改变,可表现为囊肿周围的条带和(或)线样影、斑片及磨玻璃密度影、马赛克样改变或局限性透亮影等。条带和线样影代表了囊肿周围的肺不张及实变或肺纤维化;合并感染可出现斑片及磨玻璃密度影;马赛克样改变或局限性透亮影可能是由于纤维化、支气管小分支减小使局部肺组织过度充气所致[11]。
3.3 鉴别诊断
单纯含液囊肿的CT 表现具有一定的特征性,主要与肺大泡相鉴别;而含气囊肿尤其是合并感染的气液囊肿或肿块样囊肿,需要与囊性、囊实性病变相鉴别,如肺脓肿、结核空洞、真菌性空洞、肺癌性空洞等[12]。通过实验室检查、临床病史或随访记录可对多种病变进行鉴别。增强CT 检查对鉴别诊断支气管源性囊肿具有一定的帮助,如空洞性肺癌,可见不规则空洞壁及囊肿壁结节,增强CT 扫描后强化明显,周围有血管穿行[13]。当病变周围肺组织分界不清,形态也不具有特征性时,术前鉴别诊断较困难[14-15]。本研究中1 例合并类癌病例,其囊肿壁可见光滑结节,与周围肺组织分界不清,误诊为感染性肺大泡。
综上所述,肺内支气管源性囊肿的含液或含气囊肿具有一定的CT 影像学特征,如含液、含气囊肿具有圆形或类圆形形态,其内为单纯液体或气体,容易鉴别诊断,但也容易合并细菌感染、结核感染和曲霉菌感染。当形成气液囊肿或肿块时,需要与多种肺内疾病相鉴别,少数难以鉴别诊断的应结合手术和组织病理学检查确诊。当出现囊肿壁结节、不规则增厚或感染时,手术切除是首选治疗方法。
利益冲突 所有作者声明无利益冲突
作者贡献声明 马延贺负责临床和组织病理学资料的收集与验证、论文的撰写与修订;宋振春负责临床和组织病理学资料的收集与验证、影像资料的获取与分析;元伟负责影像资料的获取与分析

