131I 治疗分化型甲状腺癌术后患者辐射剂量预测模型的研究
易婉婉 袁雪宇 蔡海东 刘瑾 张倩 范 素云 吕中伟
同济大学附属第十人民医院核医学科,上海 200072
131I 治疗作为DTC 术后重要的靶向治疗手段,可清除残存甲状腺组织中的微小癌灶,降低复发率、减少远处转移,有效改善患者预后[1-2]。131I 释放的γ 射线会对周围环境造成放射性污染,对医护及陪护人员也会造成辐射损伤,因此131I 治疗后必须对患者进行放射性隔离防护[3]。辐射防护是放射性核素治疗中不可或缺的一部分,国内多数医院规定了固定统一的辐射隔离时间,导致部分患者隔离时间长,造成医疗资源的浪费。鉴于此,本研究采用放射性核素治疗监护机器人(又称为智能陪护机器人)测量辐射隔离患者的辐射剂量,探究131I 治疗DTC 术后患者全身辐射剂量代谢的影响因素,为其辐射防护提供指导。
1 资料与方法
1.1 一般资料
回顾性分析2018 年4 至9 月于3 家三甲医院核医学科住院的72 例DTC 术后患者[其中男性27 例、女 性45 例,年 龄15~75(42.79±14.23)岁]的临床资料,其中同济大学附属第十人民医院23 例、上海交通大学医学院附属仁济医院24 例、华中科技大学同济医学院附属协和医院25 例。纳入标准:(1)具有自主能力的核医学科隔离病房住院患者,能够配合完成本次临床试验;(2)甲状腺全切术后首次进行131I 清甲治疗且TNM分期为Ⅰ期;(3)患者年龄15~75 岁,性别不限;(4)自愿参与本次临床试验并签署知情同意书。排除标准:(1)非首次进行131I 治疗;(2)有远处转移;(3)认知障碍;(4)失聪;(5)患有严重感染性疾病;(6)严重心率不齐;(7)不合作或存在(自)攻击行为(如短暂的精神病综合征);(8)研究者认为因其他原因不适宜参与本次临床试验者。根据患者服用131I 后48 h 的全身辐射剂量是否达到安全值(23.30 μSv/h)将患者分为2 组:安全组(48 h 全身辐射剂量≤23.30 μSv/h)和危险组(48 h 全身辐射剂量>23.30 μSv/h)。本研究获得同济大学附属第十人民医院伦理审查委员会的审批(审批号:SHSYIEC-4.0/18-18/01)。
1.2 采集方法
本研究采用多中心设计方法,收集患者以下信息,包括年龄、性别、体重、2 h 摄碘率[摄碘率=(甲状腺计数率−本底计数率)/(标准源计数率−本底计数率)×100%]、24 h 摄碘率、血清游离三碘甲腺原氨酸(free triiodothyronine,FT3)、血清游离甲状腺素(free thyroxine,FT4)、TSH、甲状腺球蛋白(thyroglobulin,Tg)水平、甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)水平、甲状腺超声提示是否存在甲状腺残留组织(简称超声残甲)等。所有患者首次进行清甲治疗采用固定131I(上海欣科医药有限公司)治疗剂量(3.7×109Bq);智能陪护机器人分别在服药前和服用131I 后24、48、72 h 检测患者的全身辐射剂量,具体方法:智能陪护机器人对入组患者进行人脸识别并存档,在距离患者体部1 m 处测量辐射剂量,每例患者测量3 次后取平均值,扣除本底后为最终测量结果并保存。智能陪护机器人测量仪器为德国COLIY 公司生产的900 型核辐射检测仪,仪器经过上海市计量测试技术研究院检测校准。
1.3 统计学方法
应用SPSS 20.0 软件进行统计学分析。计数资料以例(%)表示,组间比较采用卡方检验或Fisher确切概率法。符合正态分布的计量资料以±s表示,组间比较采用成组t检验(方差齐);不符合正态分布的计量资料以M(IQR)表示,组间比较采用Wilcoxon 秩和检验。对各变量进行单因素分析。将单因素分析中差异有统计学意义的因素作为自变量进行多因素Logistic 回归分析并绘制ROC曲线,评估其最佳临界值及诊断效能,多因素Logistic 回归分析中的变量检验水准α纳入=0.05、α剔除=0.05。P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
由图1 可见,131I 治疗DTC 术后患者全身辐射剂量在服药后24 h时达到最高,之后逐渐下降,在48 h 时接近安全值(23.30 μSv/h)。

图1 131I 治疗分化型甲状腺癌术后72 例患者全身辐射剂量变化的趋势图Figure 1 Variation trend of whole body radiation dose in 72 postoperative patients with differentiated thyroid cancer after iodine-131 treatment
2.2 单因素分析
由表1 可知,安全组患者32 例、危险组患者40 例;危险组2 h 摄碘率、24 h 摄碘率、FT3和FT4水平均高于安全组,且差异均有统计学意义(均P<0.05);危险组Tg 水平各量级分布与安全组的差异有统计学意义(P=0.01);危险组存在超声残甲的患者多于安全组,且差异有统计学意义(P=0.03);2 组患者的性别、年龄、TgAb 水平的差异均无统计学意义(均P>0.05)。
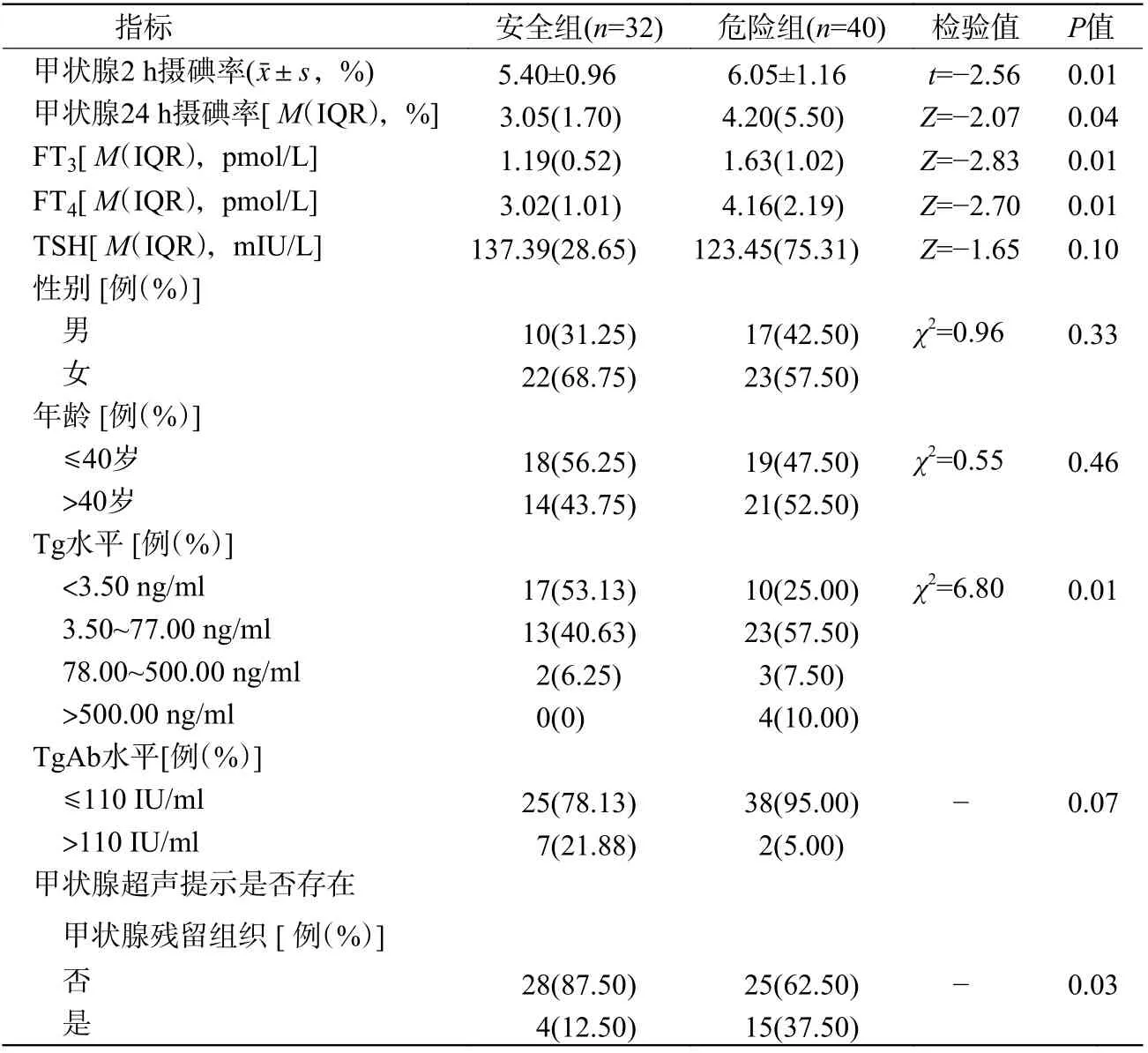
表1 2 组131I 治疗分化型甲状腺癌术后患者全身辐射剂量代谢影响因素的单因素分析结果Table 1 Univariate analysis results of influencing factors of whole body radiation dose metabolism in 2 groups of postoperative patients with differentiated thyroid cancer after iodine-131 treatment
2.3 多因素Logistic 回归分析
多因素Logistics 回归分析结果显示,24 h 摄碘率[OR=1.27(95%CI:1.03~1.57)]和Tg 水平[OR=2.51(95%CI:1.21~5.20)]对全身辐射剂量代谢有影响(P=0.03、0.01),24 h 摄碘率和Tg 水平越高的患者其48 h 全身辐射剂量达到安全水平的可能性越低。
2.4 联合指标的诊断效能
根据多因素Logistic 回归分析结果建立24 h 摄碘率+Tg 水平(联合指标)诊断的预测公式:y=−2.49+0.24×24 h 摄碘率+0.92×Tg 水平。ROC 曲线分析结果显示,联合指标的诊断效能明显优于其他单一指标(图2)。由表2 可知,联合指标的AUC为0.76(95%CI:0.65~0.87)、灵敏度为94.87%、特异度为46.88%、最佳临界值为−0.71,当患者的联合指标>−0.71 时,则认为该患者处于危险期还需要继续留院观察;反之,则认为患者处于安全期可解除隔离。

表2 不同指标对分化型甲状腺癌术后患者131I 治疗后48 h 全身辐射剂量诊断的最佳临界值及效能Table 2 The optimal critical value of various indicators for the diagnosis of whole body radiation dose 48 h after iodine-131 treatment in postoperative patients with differentiated thyroid cancer
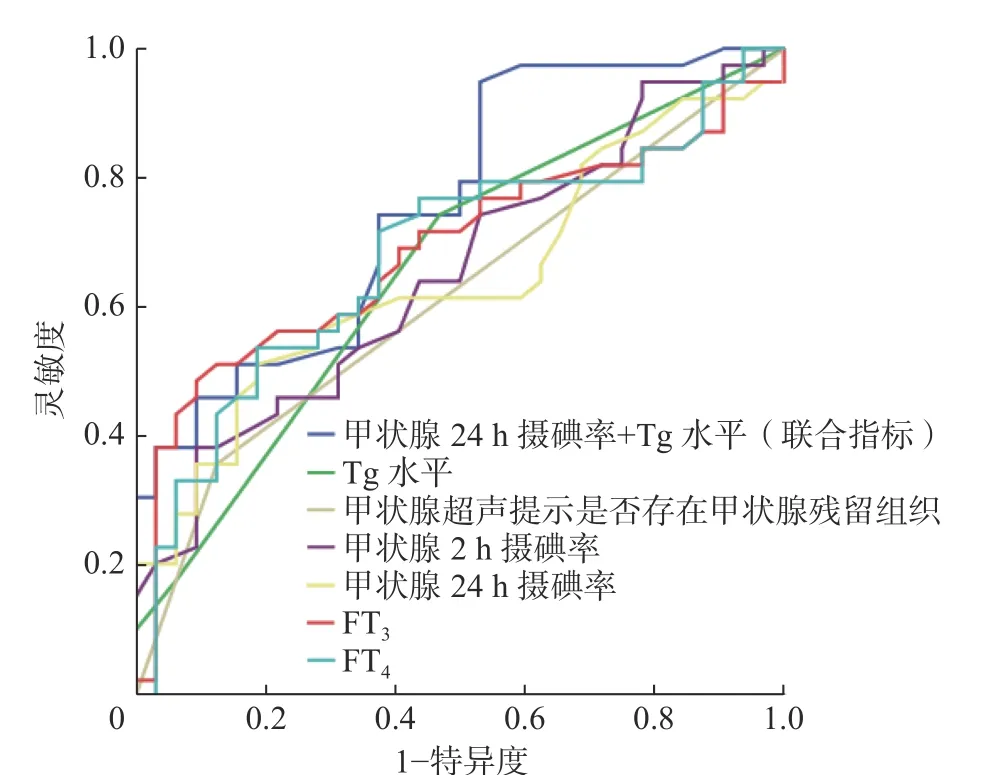
图2 不同指标对分化型甲状腺癌术后患者131I 治疗后48 h 全身辐射剂量预测的受试者工作特征曲线 Tg 为甲状腺球蛋白;FT3 为游离三碘甲腺原氨酸;FT4 为游离甲状腺素Figure 2 Receiver operating characteristic curve of various indicators for the prediction of total body radiation dose 48 h after iodine-131 treatment in postoperative patients with differentiated thyroid cancer
3 讨论
甲状腺癌为临床上常见的恶性肿瘤之一,多数起源于人甲状腺滤泡上皮细胞[4-5]。甲状腺癌常见的外科治疗方式为甲状腺全切除术和次全切除术。但因人体甲状腺的解剖学结构特殊,甲状腺癌切除术后易导致甲状腺组织的部分残留,这是部分甲状腺癌患者术后复发的原因之一[6]。
对甲状腺癌术后患者进行131I治疗,能够显著降低甲状腺癌术后患者的复发率和远处转移率[7]。131I是碘的放射性同位素,是核裂变的产物(人工放射性核素),其物理半衰期为8 d,将其应用于甲状腺疾病的治疗,已取得了显著的临床疗效[8-9]。但是131I 释放的γ 射线具有较强的穿透能力,其会对密切接触人员造成辐射损伤,同时也会对周围环境造成放射性污染。根据我国放射防护的相关规定:进行131I 治疗后,患者体内放射性活度< 400 MBq 才可解除辐射隔离[10]。然而,在隔离病房的实际工作中,人工定时准确监测患者体内残留的放射性活度较为困难。为适应核医学科隔离病房特殊治疗、护理和辐射防护的要求,研究者通过对自主移动技术、感知技术、人机交互技术及云服务等核心技术的研发,结合核医学科病房的实际需求,集成了如血压计、体温计、核辐射仪、红外热成像仪等相关医疗设备,搭建了智能医疗服务机器人平台,重点解决了机器人在医院病房复杂场景下完成精细工作的技术难题[11-12]。目前,智能陪护机器人在核医学科病房中可辅助医护人员完成部分护理工作,减少了医护人员与131I 治疗患者的接触时间,同时机器人能够动态监测患者体内残留的辐射剂量,使医护人员为患者制定个体化隔离方案成为可能[12-13]。
关于131I 治疗DTC 和良性甲状腺疾病患者的辐射剂量代谢影响因素的研究结果不尽相同。Remy 等[14]发现,36 例接受重组人TSH治疗的甲状腺癌患者131I 的半衰期(10.5 h)比218 例停用TSH 的患者131I 的半衰期(15.7 h)短31%,同时该研究结果还显示,131I 的半衰期与人种、性别无关,但与治疗次数、是否转移及Tg 水平有关。本研究中纳入患者均为首次接受131I 清甲治疗,结果显示131I 半衰期与性别无关但与Tg 水平有关,这与Remy 等[14]的研究结果部分一致。Halstenberg等[15]认为,糖皮质激素对131I 的半衰期无明显影响。而Hautzel 等[16]的研究结果表明,甲状腺代谢状态、抗甲状腺药物、促甲状腺素受体抗体水平和糖皮质激素对131I 半衰期具有独立的显著影响;与甲状腺功能亢进症相比,甲状腺毒症和甲状腺功能减退症患者的131I 半衰期缩短;高剂量的抗甲状腺药物、高促甲状腺素受体抗体水平和糖皮质激素治疗以剂量依赖性方式缩短了131I 的半衰期。Berg 等[17]认为在不同甲状腺疾病(格雷夫斯病或中毒性结节性甲状腺肿)中,131I 治疗的半衰期存在很大差异;用抗甲状腺药物预处理后,131I 的半衰期较短。Al-Jabri等[18]的研究结果表明,甲状腺良性疾病对131I 的摄取具有明显的性别差异。而本研究结果显示,131I治疗DTC 术后患者全身辐射剂量代谢的影响因素中无性别因素,但24 h 摄碘率和Tg 水平在2 组间的差异均有统计学意义。Jin 等[19]则认为,24 h 摄碘率是与131I 半衰期相关的唯一重要因素。
本研究结果显示,2 h 摄碘率、24 h 摄碘率、FT3、FT4、Tg 水平越高,患者体内131I 的清除速率越慢,这与Yu 等[20]的研究结果一致。另外,本研究结果还显示,存在超声残甲的患者体内131I 的清除速率也较慢。本研究得出了131I 治疗DTC 术后患者体内131I 残留辐射剂量与24 h 摄碘率、Tg 水平的关系式,通过此公式可以简单快速地对131I 治疗DTC 术后患者全身辐射剂量进行计算。
综上,本研究通过对131I 治疗DTC 术后患者全身辐射剂量代谢的影响因素的分析,得出了患者131I 治疗后48 h 的全身辐射剂量的预测模型,该模型计算简单且具有较高的诊断效能,能够准确识别剂量安全的患者,减少非必要的隔离观察带来的就医成本的增加和医疗资源的消耗,值得临床推广应用。但是,本研究仅纳入了72 例患者,样本量较少,且未将饮水量及尿量等影响因素纳入研究,存在一定的局限性,未来将增加样本量对本模型进行深入的探索研究。
志谢 本研究得到了上海交通大学医学院附属仁济医院核医学科、华中科技大学同济医学院附属协和医院核医学科在患者一般资料的收集、录入、血样回收等工作中的协助
利益冲突 所有作者声明无利益冲突
作者贡献声明 易婉婉负责论文的起草与撰写;袁雪宇负责研究设计的提出与修改、数据的整理;蔡海东负责数据的统计与分析;刘瑾、张倩、范素云负责病例和数据的收集;吕中伟负责论文的修改及最终版本的修订

