一株高产β-苯乙醇酵母菌的分离及产香特性研究
王光路,刘兰茜,郑颖,马歌丽,张治刚,王永亮,杨雪鹏*
1(郑州轻工业大学 食品与生物工程学院,食品生产与安全河南省协同创新中心,河南 郑州,450001) 2(贾湖酒业集团有限责任公司,河南 舞阳,462400)
高温堆积发酵是白酒生产过程中的一个重要环节,又称“二次制曲”,堆积发酵可汇聚空气中的微生物[1-2],促进酒醅中的淀粉和蛋白质等物质进行分解转化,还为美拉德反应提供反应条件及前体物质[3]。高温堆积发酵可以较好地改良原酒酒体的风味与品质,改善原酒的风格及丰富原酒的香味物质成分,为形成酒体风格提供香味成分或积累香味前体物质[4]发挥重要的作用。
张治刚等[5]利用GC法对贾湖白酒的香气成分进行分析检测,得出醇类物质是香气成分中占比最大一类物质,大量文献表明,白酒中主要醇类物质除乙醇外,还有丙醇、正丁醇、异丁醇等高级醇,且含有芳香族类的β-苯乙醇[6-9]。β-苯乙醇是白酒、黄酒、酱油等传统发酵食品中重要的风味物质,具有柔和、淡雅细腻的玫瑰气味[10]。β-苯乙醇是白酒形成独特风味的重要因素之一,同时也与拥有玫瑰香气的壬酸乙酯的合成有关[6]。由此可见,β-苯乙醇对白酒呈香具有较为重要的影响[5,11]。酵母菌是合成β-苯乙醇主要菌属,已有酿酒酵母、马克斯克鲁维酵母等种属合成β-苯乙醇的研究[12-15]。因此本文尝试从贾湖酒厂高温堆积酒醅中分离筛选出高产β-苯乙醇酵母菌株,并对其进行分子生物学鉴定、产香培养条件优化以及产香特性的研究[16-17]。
1 材料与方法
1.1 材料与试剂
贾湖高温堆积酒醅样品;β-苯乙醇标品、L-苯丙氨酸(L-phenylalanine,L-Phe)、UNIQ-10柱式真菌基因组DNA抽提试剂盒、2×SanTaqPCR Mix,上海生工生物工程有限公司;色谱级甲醇,Giovini Chemical Technology有限公司;磷酸二氢钾,天津市科密欧化学试剂有限公司;无水葡萄糖、无水硫酸镁,天津市大茂化学试剂厂。
1.2 仪器与设备
YP20001电子天平,上海奥豪斯仪器有限公司;D-37085 PCR仪,Veriti(德国);UV-1800PC分光光度计,上海美谱达仪器有限公司;DYY-6C电泳仪,北京市六一仪器厂;Tanon-3500全自动数码凝胶图像分析系统,上海天能科技有限公司;GR85DA型蒸汽灭菌锅,济南来宝医疗器械有限公司;SHP-25型恒温培养箱,上海森信实验仪器有限公司;ZNC-1500智能型洁净工作台,苏洁医疗器械(苏州)有限公司。
1.3 培养基
YPD培养基、PDA培养基、转化培养基均参考文献[18]。其中转化培养基成分调整为(g/L):酵母提取物10.0、L-Phe 5.0、蛋白胨10.0、磷酸二氢钾2.0、无水硫酸镁0.5、葡萄糖25.0。
1.4 试验方法
1.4.1 酵母菌株的分离和产β-苯乙醇酵母菌株筛选
无菌条件下,取适量高温堆积酒醅加入到含100 mL 无菌水锥形瓶中,30 ℃、200 r/min培养30 min。取不同稀释梯度涂布于PDA培养基平板,培养2 d,观察菌株形态。将分离菌株30 ℃、200 r/min培养15 h,以1%接种量接入转化培养基,培养至葡萄糖完全耗尽结束发酵。发酵液于12 000 r/min离心10 min,取上清液,高效液相色谱法检测β-苯乙醇含量。
1.4.2 菌株的鉴定
形态观察:选取培养24 h菌株纯培养物,对其进行细胞观察和菌落形态观察。
分子生物学鉴定:使用试剂盒提取酵母菌基因组,以基因组DNA为模板进行ITS序列扩增,所用引物为通用引物ITS1(5′-CTTGGTCATTTAGAGGAAGTAA-3′),ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。PCR反应体系、基因测序及序列比对分析和系统发育树构建方法均参考文献[18]。
1.4.3 菌株对苯乙醇、乙醇和NaCl耐受性的检测
采用平板划线法考察菌株耐受性。β-苯乙醇添加质量浓度为2.0、4.0、6.0、8.0、10.0 g/L;乙醇添加体积分数为2%、4%、6%、8%、10%;NaCl添加质量分数为5%、10%、15%、20%、25%。
1.4.4 菌株的最适生长初始pH值和温度
将菌液按1%的接种量转接至pH值为1~10的100 mL YPD液体培养基,培养48 h,每隔12 h测量吸光值OD600。温度设置为20、25、30、35、40 ℃培养48 h,同样每隔12 h测量吸光值OD600。
1.4.5 β-苯乙醇合成优化试验
依次考察碳源种类(麦芽糖、葡萄糖、蔗糖)及质量浓度(20.0、40.0、60.0、80.0、100.0 g/L)、氮源种类(酵母提取物、蛋白胨)及质量浓度(3.0、5.0、7.0、9.0、11.0 g/L)、L-Phe(1.0、2.0、3.0、4.0、5.0 g/L)对菌株发酵合成β-苯乙醇的影响。
1.4.6 菌株的产香试验
将菌株接种于YPD液体培养基活化15 h,按1%的接种量接种50 mL优化培养基培养24 h。发酵液离心,取上清液[18],采用同时蒸馏萃取法萃取香气成分,GC-MS法检测发酵液挥发性成分。
1.4.7 高效液相色谱法测定β-苯乙醇含量
采用0.22 μm水系滤膜过滤发酵上清液,HPLC测定β-苯乙醇含量。操作参数:色谱柱ZORBAX Eclipse Plus C18(4.6 mm×250 mm,5 μm);流动相为V(甲醇)∶V(水)=1∶1;流速0.3~0.5 mL/min梯度上升;检测波长260 nm;柱温30 ℃;进样量10 μL[5,18]。
1.4.8 同时蒸馏萃取法和GC-MS分析条件
发酵液离心,取5 mL上清液利用同时蒸馏萃取装置浓缩至1.0 mL,有机滤膜过滤后转入1.5 mL色谱瓶,待GC-MS上样。GC-MS条件参数:毛细管色谱柱DB-FFAP(60 m×250 μm×0.25 μm);手动进样,分流比为10∶1,进样口温度250 ℃;程序升温50 ℃,保留2 min,以8 ℃/min 的速率升至120 ℃,保留2 min;再以10 ℃/min升至200 ℃,稳定5 min;最后以5 ℃/min升至250 ℃,稳定20 min;检测器温度250 ℃;载气为He,流速1 mL/min;电子轰击电离(electron impact ionization,EI)源,电子能量70 eV;扫描范围10~500 u;离子源温度250 ℃;接口温度250 ℃[19]。
2 结果与分析
2.1 β-苯乙醇合成酵母筛选
通过梯度稀释结合平板涂布法[18]从酒醅中分离出8株菌株,经菌落形态和显微观察,8株酵母都具有典型的酵母菌特征,初步判定这些菌株为酵母菌,分别编号为Z01,Z02,Z03,Z04,Z05,Z06,Z07和Z08。将转接转化培养基培养24 h,考察其转化能力,结果如图1所示。其中,酵母菌株Z08合成β-苯乙醇能力最强,含量达到(2.01±0.043)g/L,因此后续选用酵母Z08进一步试验。
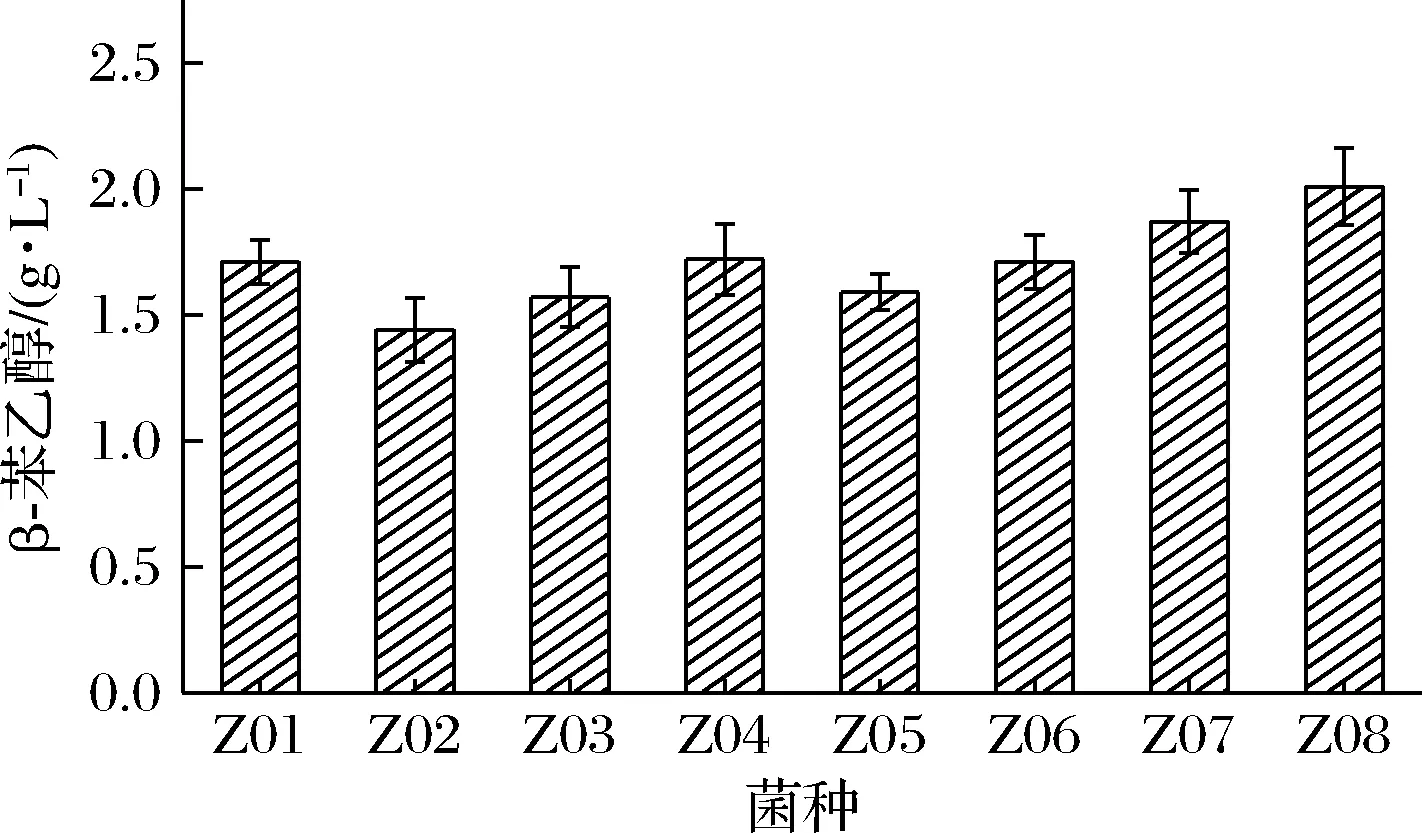
图1 不同酵母菌株发酵液中β-苯乙醇含量Fig.1 β-phenylethanol concentration in fermentation broth of different yeast strains
2.2 酵母Z08的鉴定
2.2.1 形态学鉴定
菌株Z08其平板菌落和细胞形态特征见图2。由图2可以看出,菌落呈现乳黄色,表面光滑,黏稠,边缘整齐(图2-a);菌体为长椭圆形,无菌丝体,具有酵母菌株特征(图2-b)。
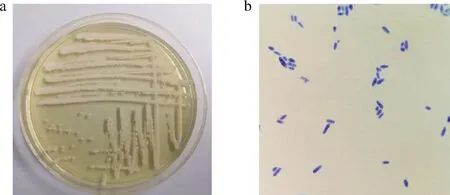
a-菌株Z08菌落形态特征;b-菌株Z08细胞形态特征图2 菌株Z08在YPD培养基上菌落形态特征及光学 显微镜(10×100倍)下细胞形态特征Fig.2 Strain Z08 colony morphology characteristics on YPD medium and cell morphology characteristics under optical microscope (10×100 times)
2.2.2 分子生物学鉴定
通过PCR成功扩增出酵母Z08的ITS1~ITS4片段,测序后获得基因序列,将其于Genebank数据库进行BLAST比对,结果表明该菌与库德里阿兹威(氏)毕赤酵母(Pichiakudriavzevii)的同源性最高,其相似度达到90%。使用MEGA X构建菌株间系统发育树(图3),结果表明酵母Z08与库德里阿兹威(氏)毕赤酵母(Pichiakudriavzevii)的亲缘关系最近。根据分子生物学鉴定菌株Z08属于库德里阿兹威(氏)毕赤酵母。

图3 基于ITS基因序列的Z08菌株系统发育树Fig.3 Phylogenetic tree of Z08 strain based on ITS gene sequence
2.3 菌株耐受性测定
按照方法1.4.3分别考察菌株Z08对β-苯乙醇、乙醇、NaCl的耐受特性,结果如表1所示,当β-苯乙醇质量浓度为4.0 g/L时,该菌生长受到抑制;当质量浓度达到6.0 g/L时,菌株完全不能生长。该菌对乙醇最大耐受体积分数为10%,属于乙醇高耐受性菌株;而其对NaCl的最大耐受质量分数高达5%,也具有一定的耐高渗能力。

表1 酵母菌株Z08耐受性试验结果Table 1 Yeast strain Z08 tolerance test results
2.4 最适生长pH值和温度
按照方法1.4.4分别考察菌株的最适生长pH和最适生长温度。如图4-a所示,酵母Z08在pH 1~10均能生长,pH适应范围广,具有一定酸碱耐受能力。该菌最适生长pH为6~8,比一般酵母最适生长pH 4.0~5.5高。从图4-b可以看出,酵母Z08最适生长温度为30 ℃,与大多数酵母生长最适生长温度相一致。

a-酵母菌株Z08的最适生长pH;b-酵母菌株Z08的最适生长温度图4 酵母菌株Z08的最适生长pH和温度Fig.4 Optimal growth pH and temperature of yeast strain Z08
2.5 酵母Z08优化合成β-苯乙醇
2.5.1 碳源种类对生物转化β-苯乙醇的影响
按照方法1.4.5考察碳源对β-苯乙醇合成的影响。根据酵母菌同化碳源试验文献,选用葡萄糖、蔗糖、麦芽糖为碳源,质量浓度均为50.0 g/L,L-Phe添加量为6.0 g/L,其余成分均与转化培养基相同,发酵结果如表2所示,Z08基本无法利用蔗糖和麦芽糖生产β-苯乙醇,但可以利用葡萄糖高效合成β-苯乙醇。

表2 不同碳源对转化合成β-苯乙醇的影响Table 2 The influence of different carbon sources on the conversion and synthesis of β-phenylethanol
在上述结果基础上,在转化培养基中添加20.0、40.0、60.0、80.0、100.0 g/L的葡萄糖,考察不同葡萄糖浓度对β-苯乙醇合成水平的影响,结果如图5所示。葡萄糖质量浓度为20.0~60.0 g/L时,随着葡萄糖浓度的增加,β-苯乙醇产量也在增加。当葡萄糖质量浓度为60 g/L时β-苯乙醇产量达到最高值(2.78±0.049)g/L,而当葡萄糖质量浓度增加到80.0、100.0 g/L时,β-苯乙醇产量大幅下降。

图5 不同浓度葡萄糖对转化合成β-苯乙醇的影响Fig.5 The effect of different concentrations of glucose on the conversion and synthesis of β-phenylethanol
2.5.2 氮源对生物转化β-苯乙醇的影响
按照方法1.4.5考察碳源对β-苯乙醇合成的影响。根据酵母菌文献报道,选择酵母提取物和蛋白胨,质量浓度为10 g/L,在培养基中添加6.0 g/LL-Phe,发酵结果如表3所示,酵母提取物作为氮源时,β-苯乙醇产量比蛋白胨高1.53倍。

表3 不同氮源对转化合成β-苯乙醇的影响Table 3 Effects of different nitrogen sources on the conversion and synthesis of β-phenylethanol
在上述结果基础上,于转化培养基中添加3.0、5.0、7.0、9.0、11.0 g/L酵母提取物,考察不同酵母提取物浓度对β-苯乙醇合成水平的影响,结果如图6所示。酵母提取物在0~7.0 g/L时,β-苯乙醇产量增加较明显,当酵母提取物质量浓度超过7.0 g/L后,β-苯乙醇产量虽然在增加,但幅度不大。

图6 酵母提取物浓度对β-苯乙醇转化合成的影响Fig.6 Effect of yeast extract concentration on the conversion and synthesis of β-phenylethanol
2.5.3L-Phe对生物转化β-苯乙醇的影响
酵母合成β-苯乙醇主要是通过艾氏途径,消耗底物L-Phe,将其转化为β-苯乙醇。按照方法1.4.5考察不同L-Phe浓度对β-苯乙醇合成的影响,结果如图7所示。在L-Phe质量浓度为0~4.0 g/L时,随着底物的增加,β-苯乙醇合成水平不断增加,当底物质量浓度超过4.0 g/L后,β-苯乙醇合成水平开始下降。

图7 不同浓度L-Phe对转化合成β-苯乙醇的影响Fig.7 The effect of different concentrations of L-Phe on the conversion and synthesis of β-phenylethanol
2.5.4 培养基主要成分的正交试验
通过单因素优化试验初步确定酵母菌Z08合成β-苯乙醇主要影响因子为酵母抽提物、葡萄糖、L-Phe和pH,磷酸二氢钾和无水硫酸镁由于单因素试验不能综合反应各因素、水平间的交互作用,因此在单因素试验结果的基础上,即2.0 g/L的磷酸二氢钾和0.5 g/L的无水硫酸镁的条件下,采用正交试验对培养基进行优化,实验设计见表4。
正交试验结果表明,最佳转化培养基成分为葡萄糖50.0 g/L,酵母提取物12.0 g/L,L-Phe 5.0 g/L,pH 6.0,可见酵母提取物对酵母细胞Z08合成β-苯乙醇有显著影响。
2.5.5 不同发酵时间对β-苯乙醇产量的影响
由于β-苯乙醇具有一定的挥发性,因此合适的发酵时间对β-苯乙醇合成也有一定影响。在上文确定最优培养基条件下,测定不同发酵时间β-苯乙醇含量,结果如图8所示。发酵38 h时达到最高产量(3.74±0.084)g/L,随后产量逐渐下降,并且菌体密度不断降低,因此确定38 h为最佳发酵时间。

表4 正交试验设计与结果分析Table 4 Result analysis and design of orthogonal experiment
2.6 酵母Z08发酵产香特性
将菌株酵母Z08接种于优化培养基培养72 h。发酵液取10 mL,离心除去菌体,取上清液与二氯甲烷等体积混合后进行蒸馏收集馏分。采用GC-MS对馏分进行挥发性香味成分进行分析,各成分含量检测结果如表5所示,在发酵产物挥发性成分中,醇类化合物相对含量最高,达到了55.38%,其中苯乙醇相对含量达到了55.32%。其次是芳香族化合物,相对含量为16.17%,以2,4-二甲基苯并[H]喹啉为主,其相对含量为4.42%。酯类化合物相对含量为14.35%,以乙酸苯乙酯为主,其相对含量为8.91%。酮类化合物相对含量为10.71%,其中以2-乙基吖啶为主,相对含量为5.47%。酸类物质相对含量为0.78%,醛类物质相对含量为0.16%,还有一些其他的烷烃类和杂环类和未测定出的化合物,总相对含量为2.45%。
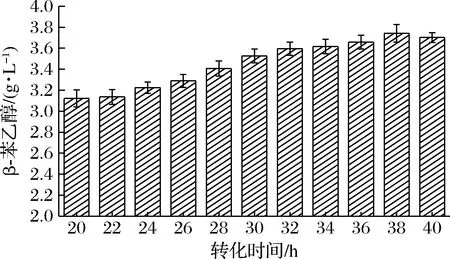
图8 不同发酵时间对β-苯乙醇产量的影响Fig.8 The effect of different conversion times on the yield of β-phenylethanol
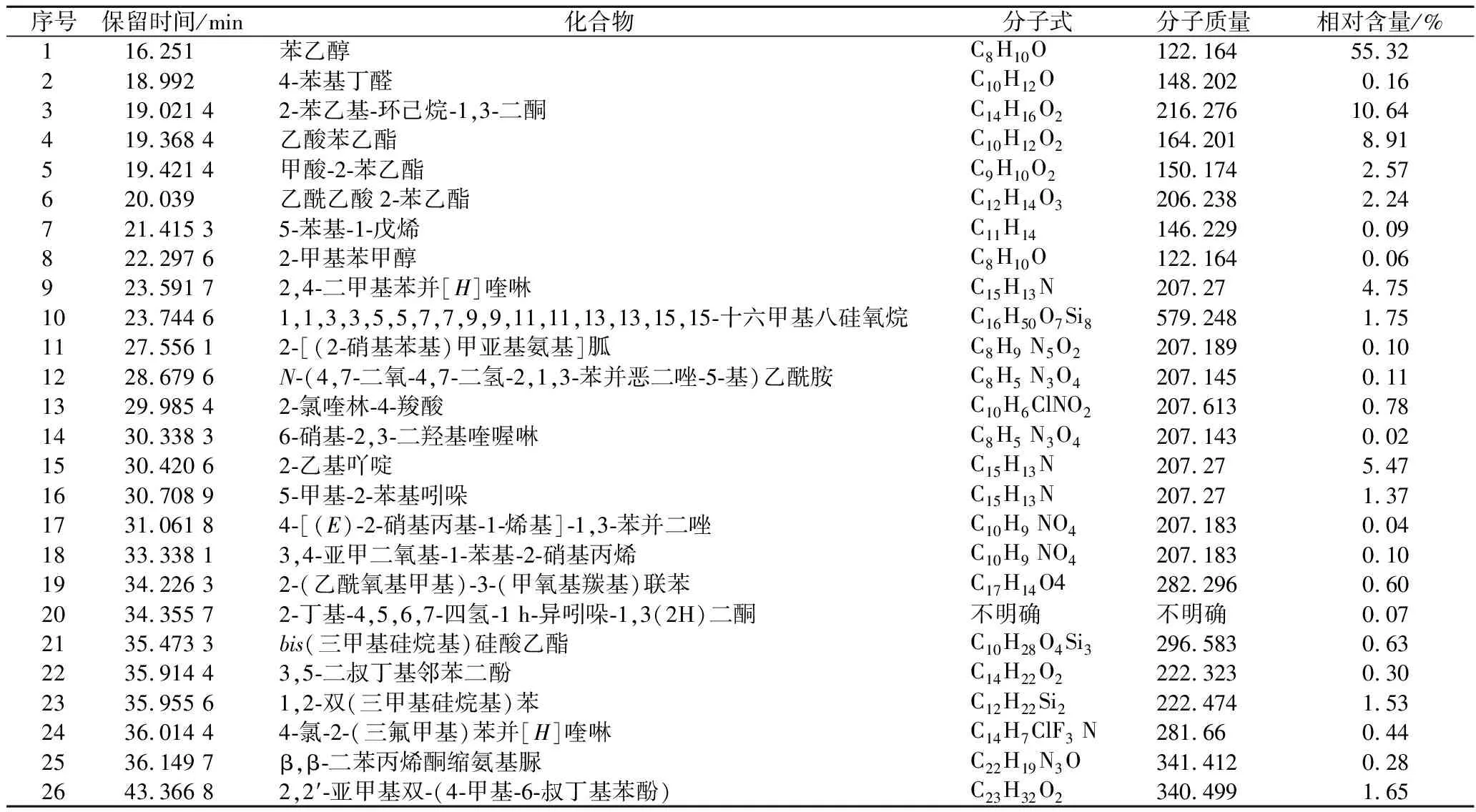
表5 酵母Z08发酵液中挥发性成分检测结果Table 5 Test results of volatile components in yeast Z08 fermentation broth
3 讨论
目前国内外发酵生产β-苯乙醇菌种以酵母菌为主,如产朊假丝酵母(Candidautilis)、酿酒酵母(Saccharomycescerevisiae)和克鲁维酵母(Kluyveromycessinensis)等[20]。本文针对贾湖堆积酒醅中的酵母进行分离、筛选,从中获得1株产β-苯乙醇的酵母菌株。通过对其进行形态和分子生物学鉴定,发现该酵母Z08为库德里阿兹威(氏)毕赤酵母。库德里阿兹威毕赤酵母(Pichiakudriarzerii)存在于各种天然发酵、果实和土壤中,能够较好地适应各种环境压力,如低氧、低pH值、高温、高乙醇浓度等等。在传统食品和饮料的发酵过程中容易分离得到,如白酒、可可豆发酵、葡萄酒、发酵乳等。通过考察Z08对β-苯乙醇、乙醇、NaCl的耐受性,发现其具有较好的乙醇和耐高渗特性。同时验证了该菌在不同温度和pH条件下生长情况,确定该菌株具有较宽泛pH生长范围。通过单因素和正交试验最终确定了该菌株最适发酵条件为葡萄糖50 g/L、酵母提取物12.0 g/L、L-Phe 5.0 g/L、磷酸二氢钾2.0 g/L和无水硫酸镁0.5 g/L。在温度30 ℃,pH 6.0,200 r/min条件下发酵38 h后,β-苯乙醇产量最终达到(3.74±0.084)g/L,比优化前大幅提升。产香试验结果表明,苯乙醇、芳香族化合物、乙酸苯乙酯等香味物质含量较高。在产香成分中,苯乙醇、乙酸苯乙酯、2-苯乙基-环己烷-1,3-二酮等多种风味物质对白酒品质有重要贡献,说明该菌株产香特性有利于其在白酒酿造中的进一步应用,对提升白酒品质有重要意义。此外,库德里阿兹威毕赤酵母(Pichiakudriarzerii)还具有作为益生菌和生物控制剂的潜力,同时该菌也在生物乙醇、甘油和琥珀酸生产等方面发挥重要作用[21]。

