十二烯基琥珀酸纳米纤维素酯的合成制备与结构表征
刘婉嫕 王 聪 栾云浩 李宇航 曹 慧 刘鹏涛
(天津科技大学天津市制浆造纸重点实验室,天津,300457)
纤维素是一种多糖,作为自然界中最丰富的可再生资源之一,其不仅来源广泛且简单易得、成本低廉[1]。纤维素具有质量轻、无毒、高亲水性、可生物降解等特性,被认为是未来绿色可持续发展中可替代石油聚合物的最有前景的替代品之一[2-4]。植物纤维素纳米材料首次于1977 年被发现[5],而后研究人员发现可以通过酶法、化学法或机械处理从木质纤维素残留物中分离出纤维素纳米材料,依据分离方法不同,分离得到的纳米材料尺寸、结构也不相同[6]。纤维素纳米材料不仅具有纤维素固有的特性优势,还具有纳米材料的优势,如比表面积大、反应活性高等[7]。
琥珀酸酐又称丁二酸酐,其可发生水解、醇解、酯化等反应,已在医药、合成树脂、微胶囊等领域被广泛应用[8]。糖酯以其优异的乳化、渗透、绿色无毒等特性已在食品、日用品、洗涤产品中得到了广泛应用[9]。目前,国内外对糖酯的研究主要聚焦于辛烯基琥珀酸酐(OSA)和淀粉类多糖物质。张明月等[10]总结了合成辛烯基琥珀酸酐-淀粉酯类物质时的常用方法、表征手段及淀粉酯在各领域的应用,展示了辛烯基琥珀酸淀粉酯的广阔应用前景。十二烯基琥珀酸酐(DDSA)是继OSA 后备受关注的生物大分子酯化剂[11],与OSA 相比,其分子链更长,若与糖类物质反应,产物疏水性能更好;然而,其分子链上所含甲基更多,活性也相对较低。因此,研究人员对DDSA的研究更多着重于十二烯基琥珀酸淀粉酯的合成与利用。Li 等[12]以藜麦淀粉颗粒为原料,选用DDSA 对其进行改性,研究取代度不同的改性淀粉各方面的性能差异;结果表明,与OSA改性藜麦淀粉相比,DD⁃SA 改性藜麦淀粉可制备出乳液液滴尺寸更小的O/W Pickering 乳液。在已有的研究报道中,鲜少有以DD⁃SA 和纤维素纳米材料为原料合成十二烯基琥珀酸纳米纤维素酯的研究。因此,为了解DDSA对纤维素纳米纤丝(CNFs)的酯化能力与效果,本课题采用反应更为均匀、体系绿色无毒的湿法工艺[13]进行十二烯基琥珀酸纳米纤维素酯(D-CNFs)的合成制备工艺研究,并对产物进行表征,以期为其今后在食品、医药等领域的应用提供更多可能性。
1 实 验
1.1 试剂及原料
CNFs,机械法制备,水接触角为0,北方世纪(江苏)纤维素材料有限公司;DDSA,上海麦克林生化科技有限公司;盐酸、氢氧化钠、无水乙醇,天津国药化学试剂有限公司;实验所用试剂均为分析纯,所有实验均使用去离子水。
1.2 仪器与设备
IKA RW20 磁力搅拌器,艾卡(广州)仪器设备有限公司(IKA中国);STARTER 3C Pro-F pH计,上海右一仪器有限公司;H3021D 高速离心机,上海知信实验仪器技术有限公司;Scientz-N 真空冷冻干燥机,宁波新芝生物科技股份有限公司;PGX型接触角测量仪,瑞典FIBRO 公司;FT-IR 650 傅里叶变换红外光谱(FT-IR)仪,天津港东科技发展股份有限公司;Q50-TGA热重分析仪,美国TA仪器公司;XRDUltima IV X 射线衍射(XRD)仪,日本理学仪器公司;90Plus激光粒度仪,美国布鲁克海文公司。
1.3 实验方法
1.3.1 D-CNFs的合成制备
称取一定质量的DDSA,与85%的乙醇溶液配制成10 wt%的溶液。称取一定质量的CNFs 配制成2 wt%的悬浮液,利用盐酸或氢氧化钠溶液调节悬浮液的pH 值。随后将DDSA 乙醇溶液加入至CNFs 悬浮液中,并使反应悬浮液pH 值的变化值在整个反应过程中保持在±0.2以内。反应一段时间后,重新调节反应悬浮液的pH值至中性。将此悬浮液置于离心机内,在8000 r/min 的转速下离心5 min 后保留下层沉淀物,随后分别利用70%乙醇溶液和去离子水各清洗2 次。将产物真空冷冻干燥48 h后,即得到D-CNFs固体。
1.3.2 D-CNFs的制备工艺优化
在CNFs 悬浮液中滴加10 wt%的DDSA乙醇溶液,控制其他条件不变,分别考察反应体系温度(20℃~60℃)、反应体系pH 值(6.5~10.5)及反应时间(4~8 h)对最终反应产物D-CNFs 水接触角的影响。在上述单因素实验的基础上,以水接触角为优化指标,设计正交优化实验方案,最终确定最适宜的制备工艺。
1.3.3 性能分析
将样品压成片状后,使用接触角测量仪测定DCNFs的水接触角。采用FT-IR仪分别对反应前后的样品进行红外光谱分析;扫描范围为400~4000 cm-1,分辨率为4 cm-1。将样品稀释于水中,超声至混合均匀,取部分置于比色皿中,利用激光粒度仪检测样品的Zeta 电位。采用TG 分析仪,以10℃/min 的升温速率将温度从30℃升至600℃,通过样品的质量损失来分析样品的热稳定性能。采用XRD 仪分析反应前后样品的结晶性能,扫描范围设定为2θ=10°~60°,扫描速率设定为4°/min。根据式(1)计算样品的结晶度指数(CrI)。

式中,I200为2θ≈22.5°处纤维素结晶区的衍射峰强度;Iam为纤维素无定形区的衍射峰强度。
本课题中,水接触角及Zeta电位测试均平行检测3次,以求取平均值;并利用IBM SPSS Statistics 22软件进行实验数据处理和差异性分析;应用Origin 8.0对实验数据进行分析、作图。
2 结果与讨论
2.1 D-CNFs合成反应机理
D-CNFs的合成反应机理如图1所示。纤维素是由葡萄糖分子通过β-1,4 糖苷键连接而成,每一个葡萄糖单元上都有3个醇羟基基团,任一羟基都可能被攻击,发生亲核取代反应。从图1可以看出,酸酐水解后生成羧酸,其与葡萄糖单元上的某羟基反应生成酯基。
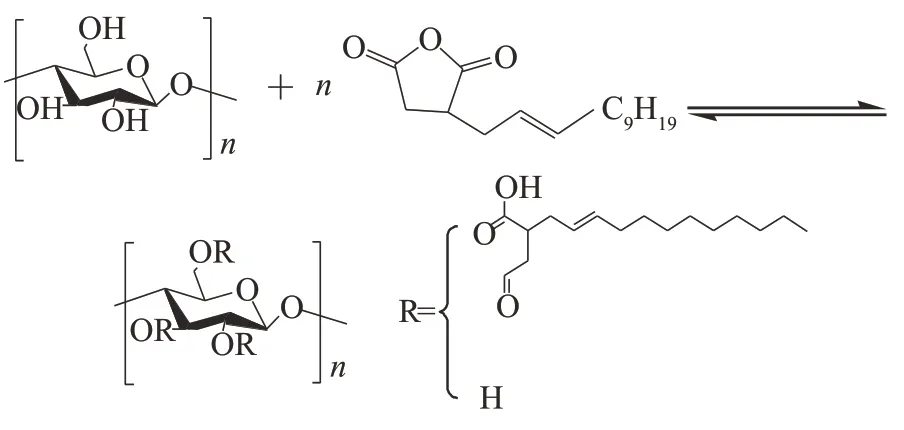
图1 D-CNFs的合成反应机理图Fig.1 Synthesis reaction mechanism of D-CNFs
2.2 反应体系温度对D-CNFs水接触角的影响
控制反应体系pH 值为8.5,反应时间6 h,对反应体系温度进行单因素实验。图2 为D-CNFs 水接触角随反应体系温度变化的趋势图。由图2可知,在反应体系温度为20℃~30℃时,D-CNFs 水接触角随温度升高而急剧增大;当反应温度高于30℃,D-CNFs 水接触角随温度升高逐渐减小。在一定的温度范围内,升高温度有利于分子变得“活跃”,加快分子之间的碰撞,使得反应进行的更加充分。但温度过高时,酸酐被加速水解,且此时发生副反应,造成纤维素酯产物减少;且由于酯化反应本身是一个可逆反应,已经生成的纤维素酯产物也会发生水解,导致最终产物水接触角减小。因此,选取反应体系温度20℃~40℃作为正交优化实验的范围。
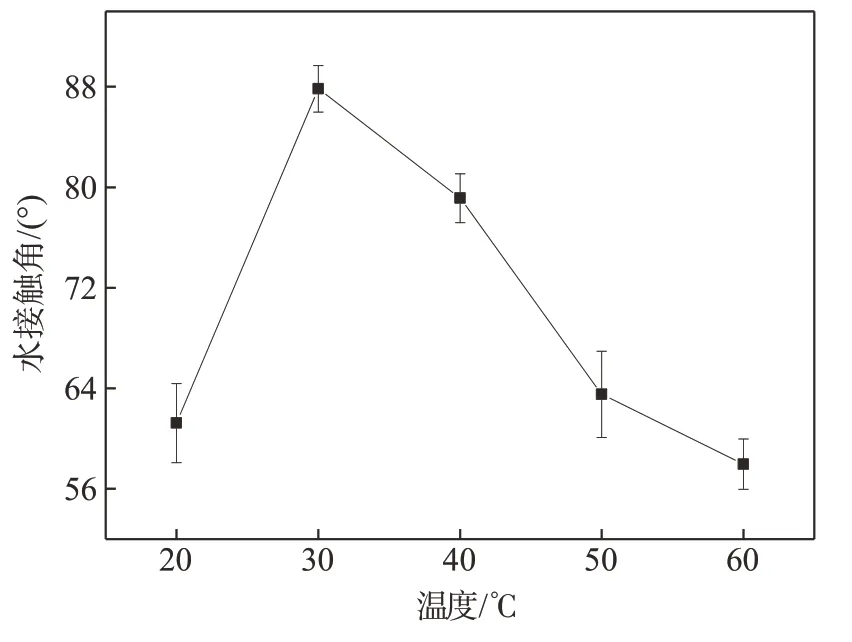
图2 反应体系温度对D-CNFs水接触角的影响Fig.2 Effect of temperature on the water contact angle of D-CNFs
2.3 反应体系pH值对D-CNFs水接触角的影响
控制反应体系温度30℃,反应时间6 h,对反应体系pH 值进行单因素实验。图3为D-CNFs 水接触角随反应体系pH 值变化的趋势图。由图3 可知,随着反应体系pH值增大,D-CNFs的水接触角呈先增大后减小的趋势。当pH值为6.5~8.5,D-CNFs水接触角呈增大趋势;pH 值为 8.5~10.5 时,D-CNFs 水接触角与反应体系pH值呈负相关性。这是因为,CNFs上的羟基需要在碱性环境下进行活化,当pH 值=6.5 时,体系呈弱酸性,且酸酐水解后一端与纤维素上的羟基反应形成酯基,另一端则形成羧酸,若环境中没有碱与之反应,则不利于反应向酯化方向进行[14],致使反应缓慢且不充分。随着pH值提高至7.5时,葡萄糖单元上的羟基变成活跃亲核单元的程度依然不足,反应速率虽逐渐加快但反应仍不够充分。而pH值过高时,酸酐水解生成酸后直接与碱性的氢氧化钠反应生成盐类物质,且生成的纤维素酯类物质在碱性条件下易发生水解反应,导致产物水接触角减小;故选择适宜的反应体系pH值范围为7.5~9.5。
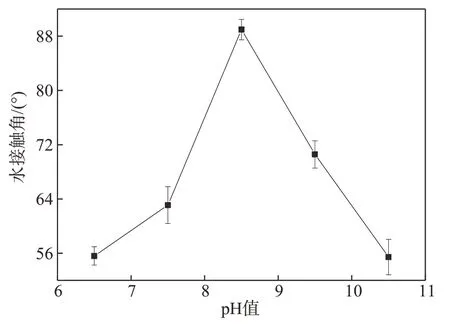
图3 反应体系pH值对D-CNFs水接触角的影响Fig.3 Effect of pH value on the water contact angle of D-CNFs
2.4 反应时间对D-CNFs水接触角的影响
控制反应体系温度30℃,反应体系pH值8.5,对反应时间进行单因素实验。图4 为D-CNFs 水接触角随反应时间变化的趋势图。由图4可知,随着反应时间的延长,D-CNFs 的水接触角呈先增大后减小的趋势。反应时间过短,反应物之间无法进行充分碰撞,反应无法充分进行。当反应进行到一定程度后,反应物浓度降低,生成的纳米纤维素酯发生水解反应的速率将大于其生成速率,导致其水接触角开始减小。因此,选择反应时间5~7 h作为正交实验的优化范围。
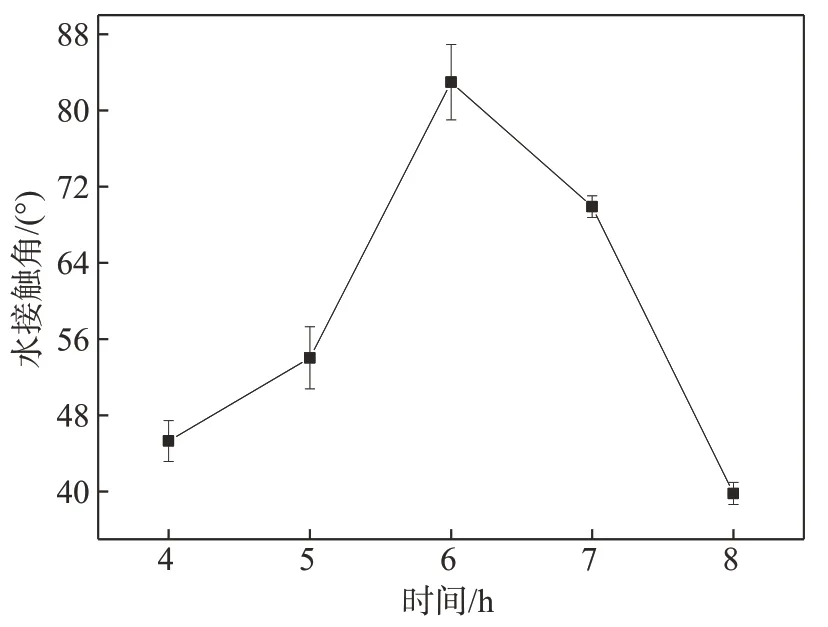
图4 反应时间对D-CNFs水接触角的影响Fig.4 Effect of reaction time on the water contact angle of D-CNFs
2.5 反应条件正交优化实验设计及结果分析
在单因素实验的基础上,选取各因素最适宜的水平范围,设计出三因素三水平的正交优化实验方案并对其进行分析,结果如表1所示。
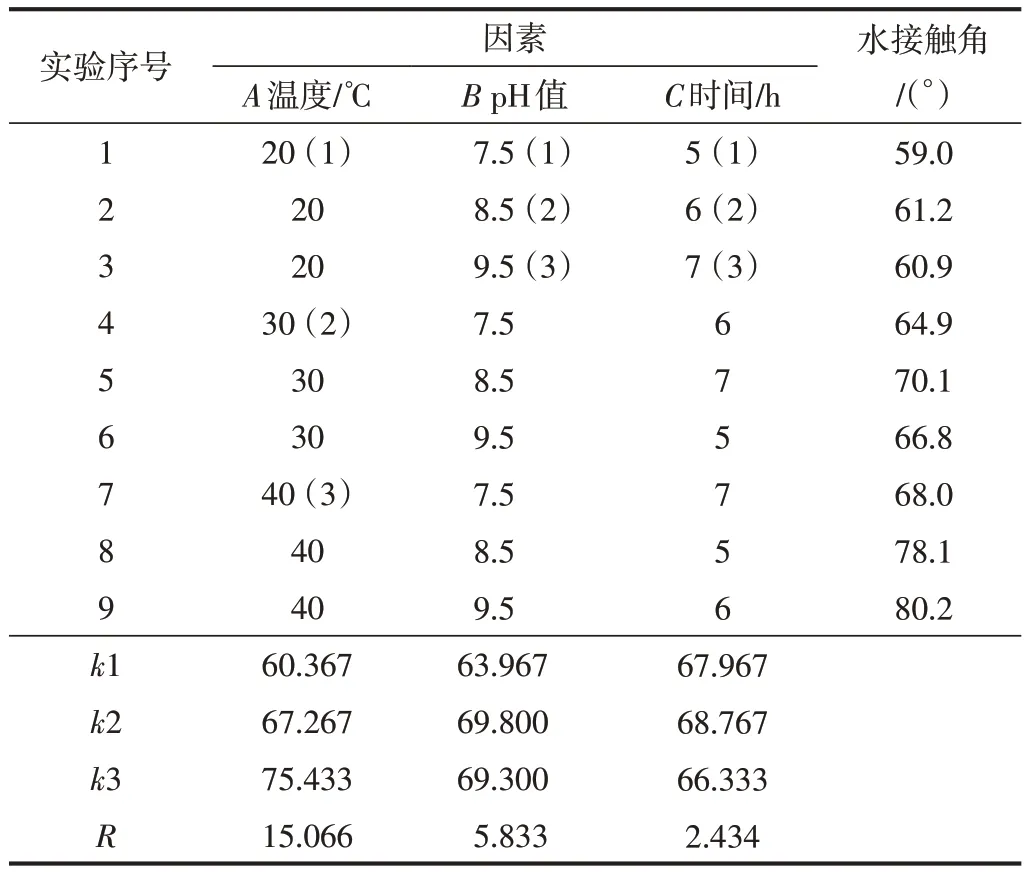
表1 反应条件的正交优化设计方案及分析Table 1 Experimental design and analysis of orthogonal optimization for reaction conditions
由表1 的极差分析可知,影响D-CNFs 水接触角的因素由大到小为A>B>C,结合k值得到最适宜的反应条件应为A3B2C2,即反应体系温度40℃、反应体系pH值8.5、反应时间6 h。由于以上9组实验方案中未出现此推导出的最优组合,故在此条件下进行验证实验,可知在此条件下制得的D-CNFs 水接触角为83.2°。进一步进行正交实验方差分析,结果如表2所示。
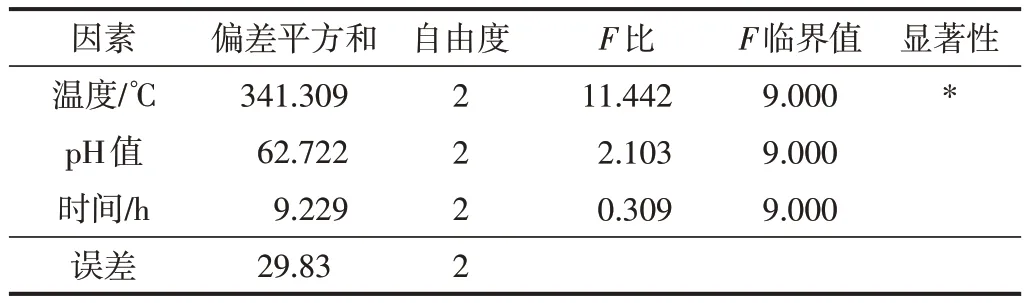
表2 正交实验方差分析Table 2 Variance analysis of orthogonal experimental
由表2 的方差分析可知,温度对D-CNFs 水接触角的影响较大,这一结论与极差分析结果一致。
2.6 FT-IR分析
图5 为 CNFs 和 D-CNFs 的 FT-IR 谱图。由图 5 可知,3432 cm-1处是—OH 的伸缩振动特征吸收峰;2900 cm-1附近为—CH 的伸缩振动特征吸收峰;1635 cm-1处是CNFs 中残留水分的弯曲振动引起的特征吸收峰;896 cm-1附近为纤维素中β-1,4糖苷键振动引起的特征吸收峰[15],以上均为纤维素分子的特征吸收峰,在CNFs 和D-CNFs 的FT-IR 谱图中均可见上述特征吸收峰的存在,表明DDAS改性没有改变CNFs的化学结构。然而,D-CNFs 的FT-IR 谱图中,1733和1165 cm-1处均出现新的特征吸收峰,分别对应酯羰基(C=O)的伸缩振动特征吸收峰和RCOO—的特征吸收峰[16],表明DDSA 已成功与CNFs 发生反应,生成了酯基基团。
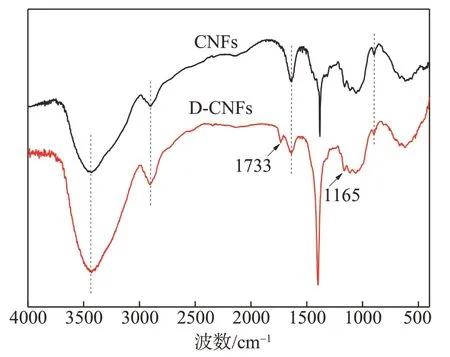
图5 CNFs和D-CNFs的FT-IR谱图Fig.5 FT-IR spectra of CNFs and D-CNFs
2.7 Zeta电位分析
CNFs和D-CNFs的Zeta电位测量结果如表3所示。由表3 可知,经酯化后,CNFs 的Zeta 电位略有下降,这是因为DDSA 与CNFs 反应时,其上的酸酐被打开,其中一端与葡萄糖单元上的羟基反应生成酯基,另一端形成羧基,此端的羧基离子化使得悬浮液的Zeta电位降低[17]。当固体颗粒表面Zeta 电位绝对值≥30 mV时,形成的悬浮液体系较稳定;而当颗粒表面Zeta电位绝对值在5~15 mV 之间时,则悬浮液容易发生絮聚。改性前后CNFs 的Zeta 电位绝对值均大于30 mV,表明二者均可以形成稳定悬浮液体系,且改性后,D-CNFs 的Zeta 电位绝对值更大,表明D-CNFs 悬浮液的稳定性更好。
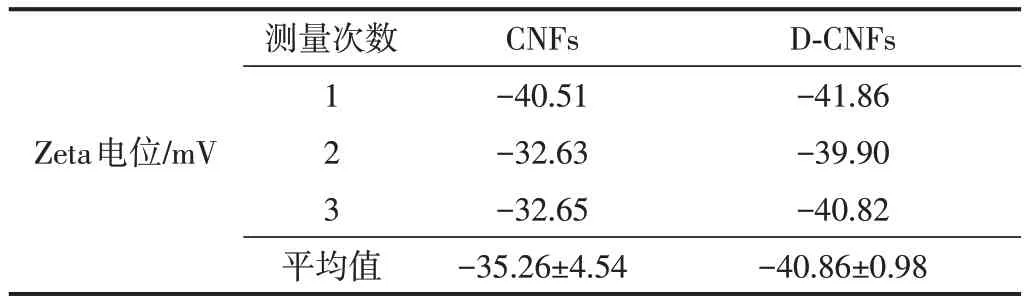
表3 CNFs和D-CNFs的Zeta电位测量值Table 3 Zeta potential of CNFs and D-CNFs
2.8 热稳定性能分析
CNFs和D-CNFs的TGA曲线如图6(a)所示。由图6(a)可知,CNFs和D-CNFs的TGA曲线表现出相似的变化趋势,二者的热降解过程可分为2个质量损失阶段。第一阶段的质量损失发生在<150℃,经过干燥处理的样品在贮存过程中又吸收了空气中少量的水分,因此出现微量的质量损失。第二阶段的质量损失则发生在200℃~400℃的范围内,D-CNFs 先于CNFs 发生热降解,这可能是由CNFs 和DDSA 反应生成的酯键断裂及烯基链的损失所致[18]。从图6(b)可以看出,D-CNFs和CNFs出现最大热降解速率时对应的温度分别是303℃和350℃;这表明,经酸酐改性的CNFs 由于引入了酯基基团且此基团受热先发生降解,因而其热稳定性出现一定程度的下降,但二者最终残余物的质量没有出现较大差别。
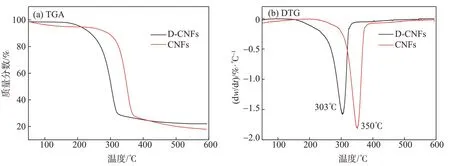
图6 CNFs与D-CNFs的TGA和DTG曲线Fig.6 TGA and DTG curves of CNFs and D-CNFs
2.9 结晶性能分析
图7 为 CNFs 和 D-CNFs 的 XRD 谱图。从图 7 可以看出,经DDSA改性的CNFs依然保持纤维素I型的典型晶体结构,改性前后的CNFs 均在2θ=16.5°、22.5°和34.5°处出现明显的特征衍射峰,分别对应纤维素(101)、(200)和(040)的晶面结构。通过结晶度公式计算得知,CNFs的结晶度为76.14%,D-CNFs的结晶度为70.87%,略有下降。这可能是因为,改性后,DDSA 引入的疏水链降低了纤维素分子间形成氢键的能力[19]。总体来说,D-CNFs的结晶度出现小幅下降,衍射峰位置并未发生变化,因此可推断,DDSA 对CNFs的酯化反应几乎都发生在纤维素的无定形区。
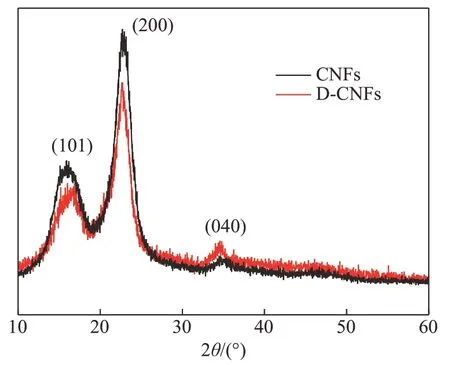
图7 CNFs与D-CNFs的XRD谱图Fig.7 XRD spectra of CNFs and D-CNFs
3 结 论
以纤维素纳米纤丝(CNFs)及十二烯基琥珀酸酐(DDSA)为原料、采用湿法工艺成功制备出了水接触角为83.2°的十二烯基琥珀酸纳米纤维素酯(DCNFs),经单因素实验及正交优化实验优化得到DCNFs 的最佳制备条件为:反应体系温度40℃、反应体系pH 值8.5、反应时间6 h。经傅里叶变换红外光谱测定,D-CNFs 中出现了新的酯羰基伸缩振动特征吸收峰,佐证了D-CNFs 的成功合成。由于酯基基团的引入,D-CNFs 受热时率先发生分解,与CNFs 相比,其热稳定性略有下降,但依然可以满足一般加工处理时的要求;D-CNFs 结晶度相较CNFs 下降了5.27个百分点,且二者的X射线衍射谱图中的衍射峰位置一致,因此可知,DDSA与CNFs的酯化反应大都发生在纤维素的非结晶区。综上,本课题制备的D-CNFs亲水性相较CNFs 有所降低,但其Zeta 电位绝对值较CNFs的大,因此,其悬浮液体系稳定性更好。

