外周血中HPR、PLR联合CEA对胃癌的诊断预测价值
刘宁 卢宁
胃癌是全球第五大最常见的癌症和第三大最常见的癌症死亡原因[1]。早期胃癌无明显临床症状,容易被忽视。在东亚地区由于胃癌经常确诊时处于晚期,常常死亡率较高,治疗效果差,预后不理想,近些年经过不断的努力,虽然我国胃癌发病率及死亡率有所下降,但由于我国人口基数大、人口老龄化、区域发展不平衡等相关因素的存在,可推测胃癌仍为危害我国居民身体健康的重要疾病之一[2]。胃癌的早期诊断和筛查能有效改善胃癌患者的预后,早已成为各国专家共识,随着内镜技术 ME-NBI(magnifying endoscopy with narrow-band imaging)、PET-CT(positron emission tomographycomputed tomography)及胃癌筛选方案的不断发展,胃癌的早期筛检及诊断能力有了长足的进步,像日本和韩国胃癌发病率较高的地区,死亡率大幅度下降[3-5]。但仍要看到对于基层医院、经济欠发达地区医疗设备相对落后,医疗技术人员相对不足,加上检查费用相对较高,难以普及。另外常规组织病理学检查为胃癌确诊的金标准,但其有创性不适合人群筛查。内镜、染色等技术可提高胃癌诊断率,但其要求患者耐受胃镜检查,不适合心肺功能较差或者其他基础疾病患者及高龄患者。造成胃癌确诊率较低。因此,简单有效的诊断预测方法对胃癌的诊断预测愈发重要。研究表明,肿瘤细胞引起的炎症反应对肿瘤发生发展起到重要作用,肿瘤细胞分泌的炎性介质可导致外周血中相关细胞反应性增生,淋巴细胞在抗肿瘤过程中起到重要作用[6]。很多研究表明PLR在胃癌、食管癌、大肠癌等癌肿辅助诊断及预后中起到重要作用[7-9]。但关于血红蛋白水平对癌症患者的诊断价值研究报道较少。癌胚抗原(carcinoembryonic antigen,CEA)作为消化道肿瘤诊断常见指标,其敏感性较差及缺乏肿瘤特异性,很难单独作为筛查消化道肿瘤指标[10-12]。因此,本研究旨在探讨血红蛋白与血小板比(HPR)、血小板与淋巴细胞比(PLR)联合CEA对胃癌的诊断预测价值。
1 资料与方法
1.1 一般资料
回顾性选取2018年1月-2020年12月在新疆军区总医院就诊的239例胃癌患者(胃癌组)、196例胃息肉患者(胃息肉组)和226例健康体检者(健康人群组)为研究对象。纳入标准:(1)胃癌组均经病理明确诊断为胃癌;(2)胃息肉组均经病理诊断为息肉;(3)健康组为在本院院体检中心体检的健康人群。排除标准:(1)无明确的组织病理学诊断;(2)胃癌患者在入组前已经或正在接受新辅助放化疗、辅助放化疗、靶向及免疫治疗;(3)年龄>80岁;(4)患有血液系统疾病、糖尿病、慢性肾脏疾病、慢性肝脏疾病、自身免疫性疾病、心血管系统疾病;(5)近1周服用过糖皮质激素类、非甾体抗炎类、抗血小板类等影响血液细胞的药物;(6)近2周内出现发热病史,1个月内输血及献血史,有脾功能亢进病史。根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)TNM肿瘤分期的第8版对胃癌组患者进行分期,胃癌组中Ⅰ期患者54例,Ⅱ期患者52例,Ⅲ期患者102例,Ⅳ期患者31例。本研究得到新疆军区总医院伦理委员会批准。
1.2 方法
通过新疆军区总医院电子病历系统收集胃癌组、胃息肉组和健康人群组的相关资料:性别、年龄、外周血中相关指标如白细胞计数、淋巴细胞计数、血红蛋白、CEA 等,应用 Microsoft Office Excel 2013进行数据整理,计算HPR、PLR。其中外周血中所有数据均为本院检验科检测,全血细胞计数采用贝克曼780(贝克曼库尔特)检测,血清CEA的浓度采用罗氏E6000分析仪(罗氏诊断公司)检测。
1.3 统计学处理
所有数据来自新疆军区总医院电子病历系统,应用SPSS 25.0进行统计学分析,应用Kolmogorov-Smirnov检验各组正态性,偏态分布计量资料应用中位数四分位间距[M(P25,P75)]表示,三组间数据先采用Kruskal-WallisH检验有无差异,两组间比较应用Mann-whitneyU检验;χ2检验分析计数资料;Graphpad prism 9绘制散点图观察HPR、PLR分部趋势;采用Spearman相关系数来检验HPR、PLR与CEA的相关性;应用MedCalc 20.0绘制受试者工作曲线(receiver operating characteristic curve,ROC曲线)评价HPR、PLR联合CEA在胃癌的诊断预测价值,P<0.05为差异有统计学意义。
2 结果
2.1 三组一般临床特征比较
胃癌组、胃息肉组及健康人群组性别比较,差异无统计学意义(P>0.05);胃癌组较胃息肉组及健康人群组有较高的年龄、白细胞计数和血小板计数,除胃癌组血小板计数水平与胃息肉组比较,差异无统计学意义(P=0.186),其余组间比较,差异均有统计学意义(P<0.05);胃癌组较胃息肉组和健康人群组有较低的淋巴细胞计数和血红蛋白,差异均有统计学意义(P<0.05);胃癌组的CEA、PLR高于胃息肉组(P<0.001),同时高于健康人群组(P<0.001);胃癌组HPR低于胃息肉组(P<0.001),同时低于健康人群组(P<0.001),见表1。结合图1可观察三组PLR、HPR的分布情况。
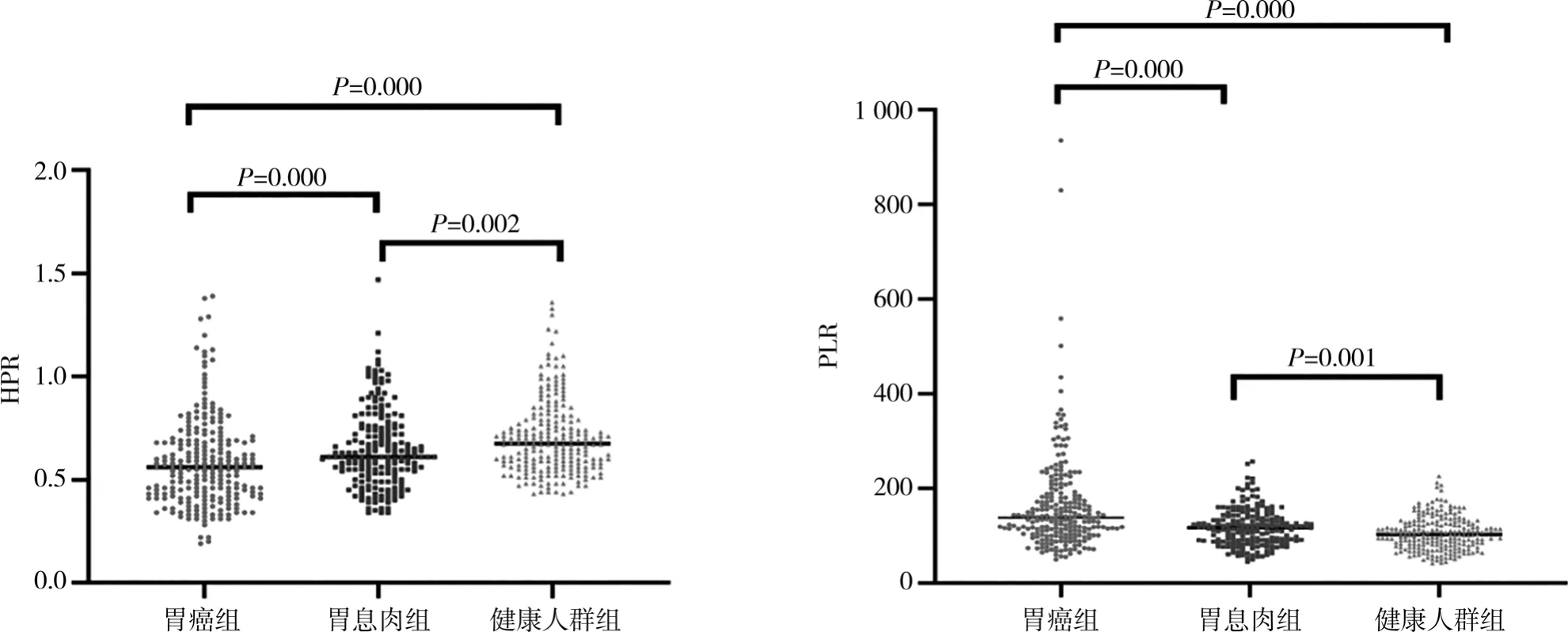
图1 三组HPR、PLR分布散点图
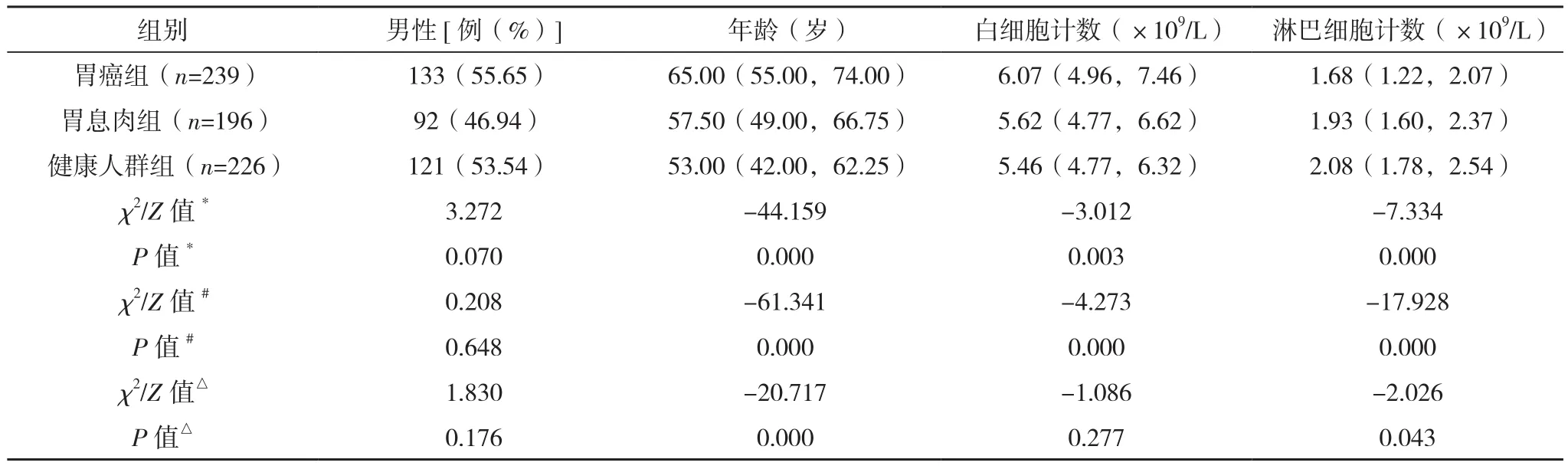
表1 三组临床特征比较
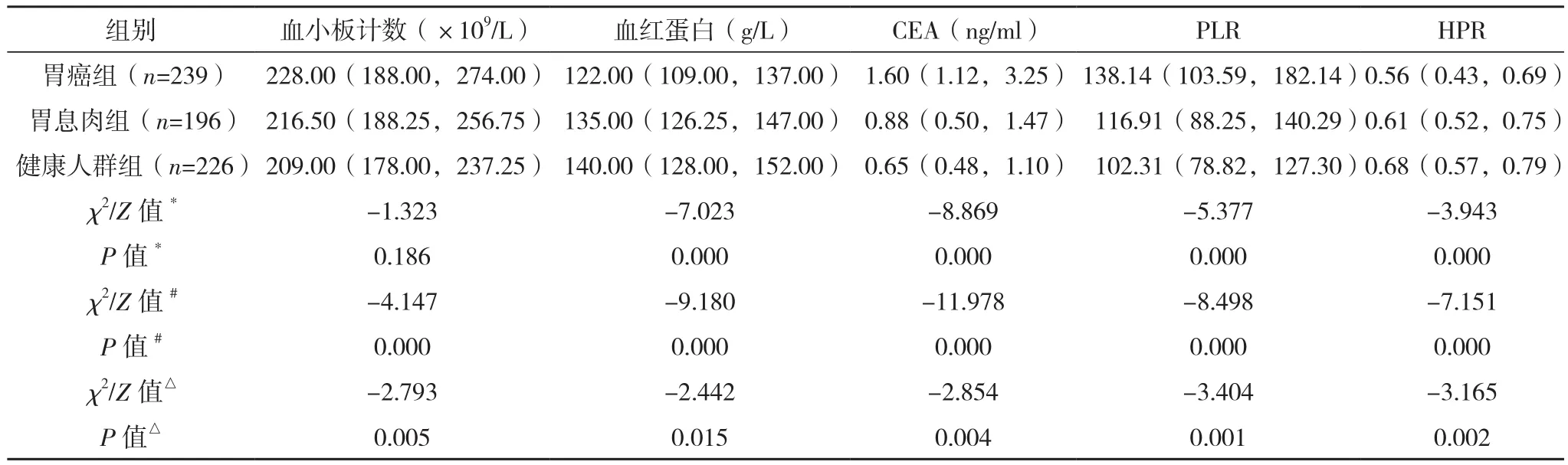
表1(续)
2.2 胃癌患者不同临床病理特征间PLR、HPR、CEA的比较
男性胃癌患者HPR值高于女性(P<0.05);PLR和CEA在男女胃癌患者中的差异无统计学意义(P=0.532、0.396)。HPR值随着胃癌的原发肿瘤浸润加深、淋巴结转移、肿瘤分期进展在降低(P<0.05);但肿瘤远处转移与否的HPR值比较,差异无统计学意义(P>0.05)。PLR、CEA随着胃癌的肿瘤浸润加深、淋巴结转移、肿瘤分期进展在升高(P<0.05),见表 2。
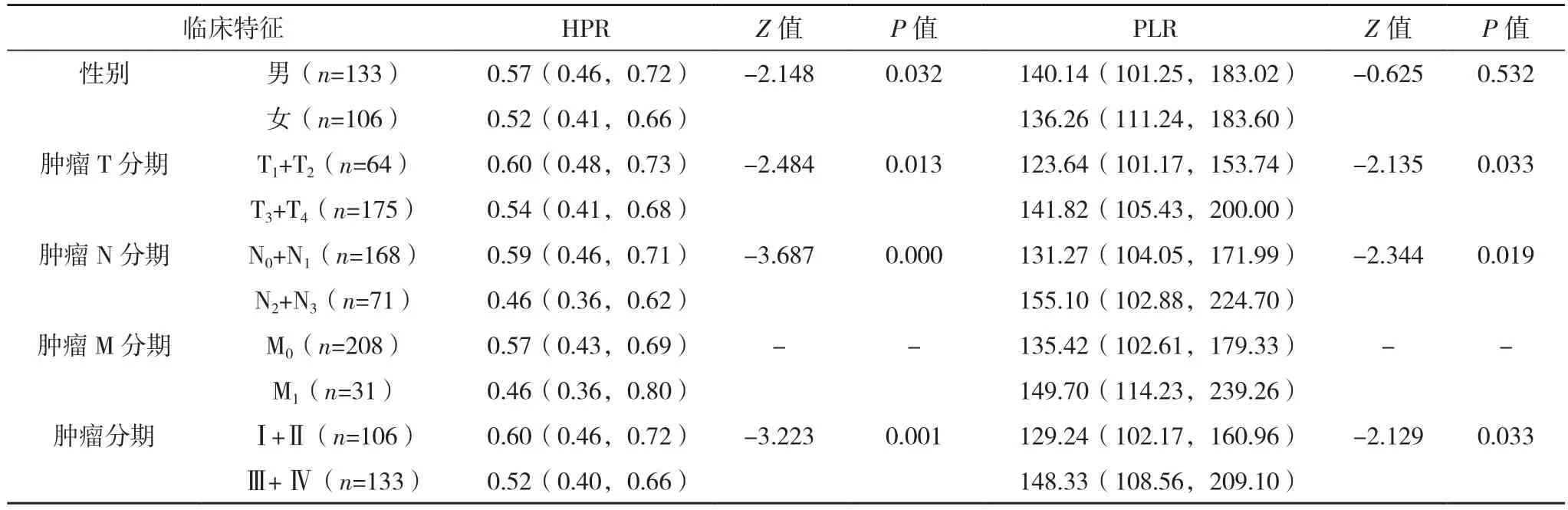
表2 胃癌患者不同临床特征间PLR、HPR、CEA的比较[M(P25,P75)]
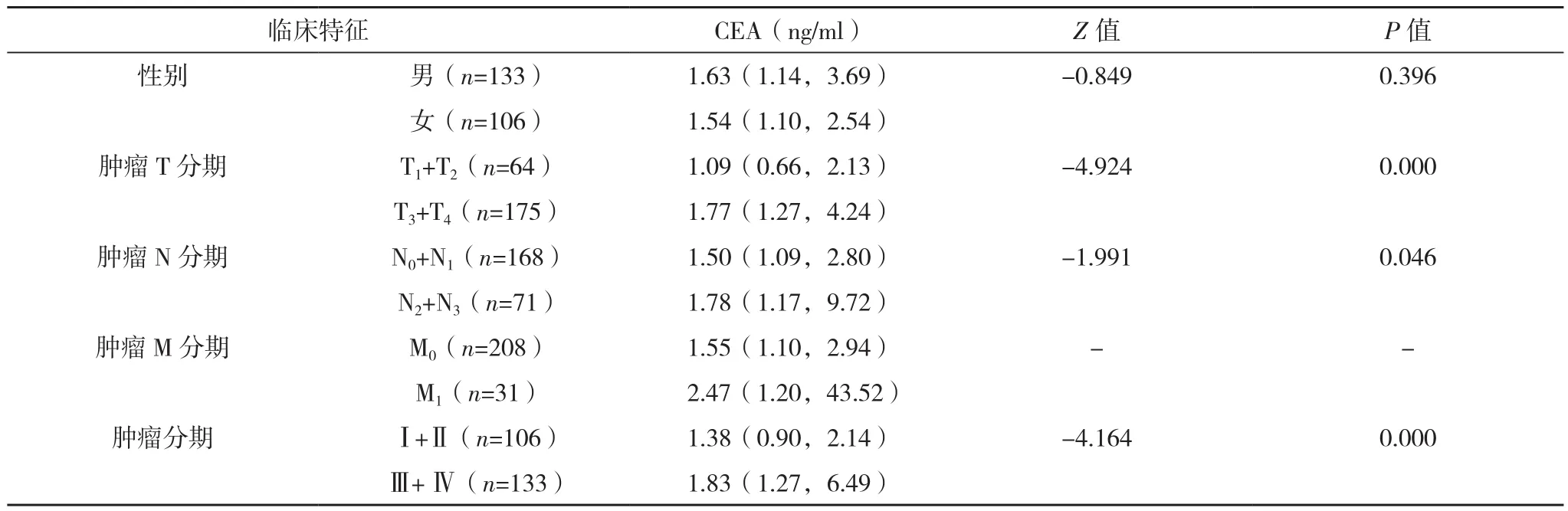
表2(续)
2.3 胃癌患者HPR、PLR与CEA的相关性分析
在胃癌患者中,HPR与CEA无相关性(rs=-0.034,P=0.606),见图2a;PLR与CEA之间无相关性(rs=0.019,P=0.769),见图 2b。
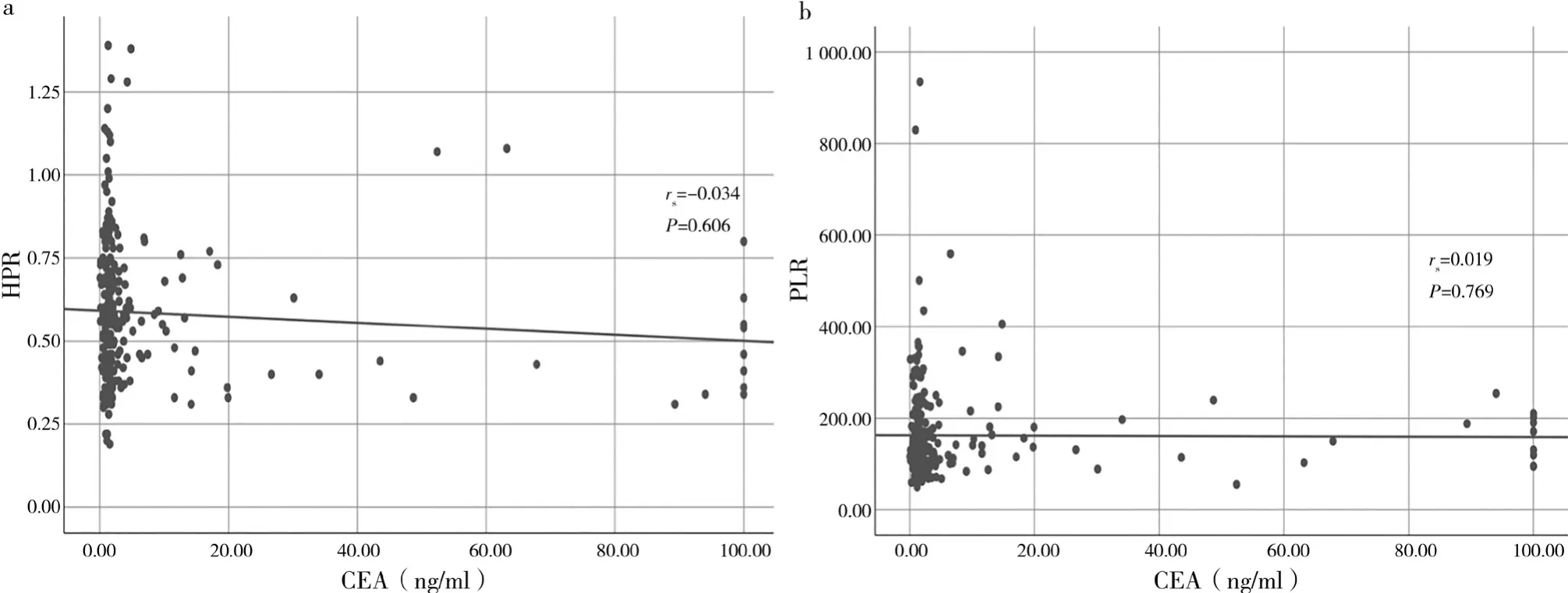
图2 胃癌患者中HPR、PLR与CEA的相关性分析
2.4 外周血HPR、PLR联合CEA对胃癌的诊断预测价值ROC曲线分析
HPR、PLR联合CEA诊断胃癌的特异性较单独CEA诊断胃癌的特异性上升。HPR、PLR、CEA的AUC面积分别为0.69(0.65,0.73)、0.73(0.69,0.77)、0.82(0.78,0.86),HPR、PLR 联合 CEA 诊断胃癌的AUC分别为AUCPLR+CEA=0.87(0.84,0.90),AUCHPR+CEA=0.85(0.81,0.88),AUCPLR+HPR+CEA=0.87(0.84,0.90)。HPR联合CEA诊断胃癌的AUC大于单独CEA(P=0.038 7)或HPR(P<0.000 1);PLR联合CEA诊断胃癌的AUC大于单独CEA(P=0.000 1)或 PLR(P<0.000 1)。HPR、PLR、CEA联合诊断胃癌的AUC大于CEA、HPR联合诊断胃癌的AUC(P=0.004 8),但与PLR、CEA联合诊断胃癌的AUC比较,差异无统计学意义(P=0.884 2),见表3、图3。
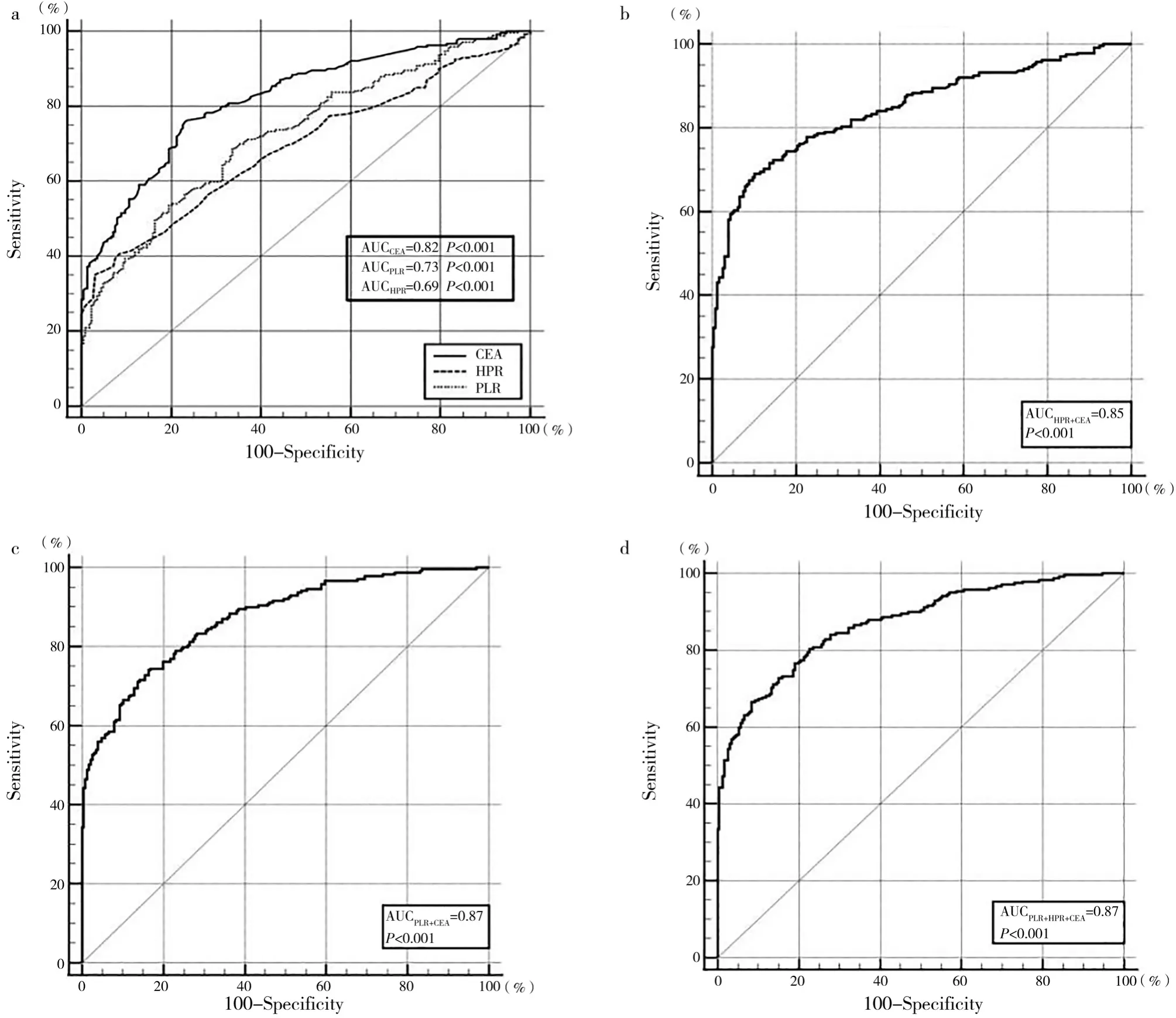
图3 HPR、PLR与CEA单独或联合诊断胃癌的ROC曲线
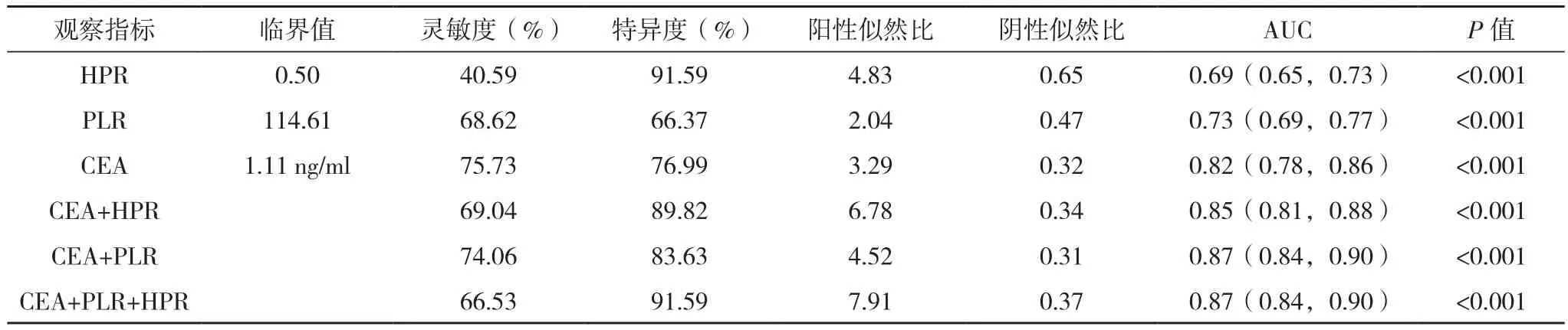
表3 PLR、HPR联合CEA对胃癌的诊断预测价值ROC曲线分析
3 讨论
本研究使用血常规中HPR、PLR联合CEA对胃癌诊断预测价值进行探讨,结果显示胃癌组患者中PLR明显高于胃息肉组及健康人群组(P<0.05),这与其他学者研究结果一致[13-15]。Lian等[14]发现胃癌组术前患者的PLR高于健康受试者,术前较高的中性粒细胞与淋巴细胞比(NLR)和PLR降低了总生存率(OS)和无病生存期(DFS)。Kim等[15]发现术前PLR较高的有明显的不良预后。Wu等[13]发现PLR和CEA有助于区分胃癌和良性胃疾病,CEA与PLR联合使用比单独使用提供更好的诊断预测价值。
本研究表明胃癌组血红蛋白水平低于正常组及胃息肉组(P<0.05),这与Liu等[16]发现胃癌患者术前贫血状态影响患者预后的研究结果相一致。据了解,HPR在恶性肿瘤疾病中的临床价值很少被研究。本研究发现与胃息肉组或者健康人群组相比,胃癌组的HPR值较低(P<0.05)。Hu等[17]研究指出低HPR和低血红蛋白在直肠癌患者中也有类似表现。Tang等[18]研究了膀胱癌患者术前HPR的进展和预后价值。本研究首次探讨了HPR与胃癌患者的临床病理特征之间的关系,结果表明HPR与胃癌浸润加深、淋巴结转移进展、肿瘤分期进展相关(P<0.05),同时研究表明男女患者HPR中位数不同,可能与男女患者血液中血红蛋白浓度生理性差异有关。
本研究发现CEA在胃癌组患者中浓度大于胃息肉组(P<0.05),Miki等[19]发现胃癌患者循环肿瘤细胞中CEA阳性影响患者预后,同时CEA在临床工作中有助于对肿瘤的诊断及预后分析。同时对肿瘤残留、复发、转移有重要意义[20]。本研究发现HPR、PLR联合CEA诊断胃癌的AUC大于其中任何单个指标AUC(P<0.05),表明HPR、PLR联合CEA更有利于胃癌诊断预测,操作简单,患者痛苦小,临床实用性强。
同时由于本研究为回顾性分析,不能完全避免选择性偏倚,纳入影响因素较局限,比如高盐饮食、吸烟、幽门螺杆菌感染等引起胃癌高危因素在内可能影响研究结果。另外该研究是单一中心研究,样本量较局限,期待更大的样本量和更多中心的临床研究。
总之,本研究发现PLR和HPR与胃癌及其淋巴结转移、肿瘤分期显著相关。HPR、PLR联合CEA可提高对胃癌的诊断预测价值,为胃癌的诊断提供依据。

