吴氏侗药烧伤油安全性评价*
兰 岚,唐佳璇,石秋梅,薛凯阳,崔 瑾
(贵州中医药大学研究生院,贵州 贵阳 550002)
烧伤烫伤是由物理、化学、辐射等热力因素引起的组织损伤[1]。吴氏侗药烧伤油有解热镇痛、散毒消肿、去腐生肌之功效,适用于浅Ⅰ度~深Ⅱ度烧烫伤等的治疗。依据原国家食品药品监督管理局药品评审中心《中药、天然药物急性毒性研究技术指导原则》([Z]GPT2-1)、《中药、天然药物刺激性和溶血性研究的指导原则》([Z]GPT4-1)及《中药、天然药物免疫毒性(过敏性、光变态反应)研究的技术指导原则》([Z]GPT5-1),现对吴氏侗药烧伤油进行皮肤急性毒性、皮肤刺激性、皮肤过敏性研究,评价其安全性与有效性,为其临床应用提供科学依据。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:EL104型电子天平(梅特勒-托利多仪器<上海>有限公司);BCD - 642WEGX5S 型冰箱(康佳集团股份有限公司);HH - 2 型数显恒温水浴锅(上海梅香仪器有限公司);X5 - S 型电子秤(凯丰电子秤有限公司);X1型剃毛剪(迈牙堂公司)。
试药:吴氏侗药烧伤油(吴氏侗医家族传承自制);2,4 - 二硝基氯苯(西亚化学科技<山东>有限公司,批号20210420);乙醇(重庆川东化工集团有限公司,批号20200001);生理盐水(贵州科伦药业有限公司,批号D21040704);水为娃哈哈纯净水。
动物:健康SPF级SD大鼠50只,体质量200~300g,雌雄各半;健康普通级Hartely 白色豚鼠30 只,体质量250~350g,雌雄各半,均购自长沙天勤生物技术有限公司,实验动物生产许可证号分别为SCXK(湘)2019-0014,SCXK(湘)2019-0015。实验期间雌雄分笼饲养、每笼5只,环境温度(23 ± 2)℃,相对湿度50%~65%,人工昼夜交替(12 h/12 h),所有实验动物均自由饮水、摄食,保持良好通风。本实验经学校动物实验伦理委员会批准,符合《实验动物福利伦理审查指南》要求。
1.2 方法
1.2.1 皮肤急性毒性实验
分组与给药:取30 只SD 大鼠,随机分为空白对照组(A组,等量生理盐水)、皮肤完整组(B组,吴氏侗药烧伤油2 mL)、皮肤破损组(C 组,吴氏侗药烧伤油2 mL),各10 只。于给药前24 h 用剃毛剪剃去大鼠脊柱背部两侧毛发,再用脱毛膏脱毛(面积约5 cm×6 cm),检查皮肤有无红斑、水肿及破损情况(下同)。将已脱毛区域皮肤用消毒针头作“#”形划破,长宽各约2 cm,间隔0.5 cm,深度为1~2 mm,以皮肤出现轻度渗血为度。各组大鼠分别涂抹相应药物或生理盐水,每天3 次,连续7 d,涂药后用无刺激性纱布和胶带分层固定。
观察指标:给药期间每日观察大鼠给药区域及全身皮肤状态、饮食、粪便、毛发光泽、眼和黏膜、呼吸、活动及中枢神经系统症状;分别于给药24 h、48 h、7 d 记录大鼠的体质量。末次给药后,解剖并观察大鼠的主要脏器(心、肝、脾、肺、肾),实验期间若发现动物死亡,需对其进行病理学检查。
1.2.2 皮肤刺激性实验
分组及给药:取20 只SD 大鼠,随机分为皮肤完整组(D 组)及皮肤破损组(E 组)大鼠,各10 只。两组采取同体左右侧自身对比法,取纱布3 cm ×3 cm(4 层),浸吴氏侗药烧伤油2 mL,贴于左侧已脱毛区域皮肤上,用塑料薄膜覆盖,再用无刺激性胶布和绷带固定;右侧皮肤同法贴敷纱布(2 mL 水浸润)作为对照。贴敷6 h 后,除去药物及水后用温水清洁给药部位,破损皮肤采用无菌操作。相同部位给药每天3 次,连续7 d,于每日首次贴敷去除药物后24 h 进行日间给药,于每次去除药物后1 h进行日内给药。
观察指标及评价标准:肉眼观察并记录贴敷部位是否有红斑、水肿、色素沉着、出血点、皮肤粗糙或皮肤菲薄等情况,及其发生时间和消退时间。对红斑及水肿刺激反应症状进行评分,无红斑、轻度红斑、中度红斑、重度红斑和水肿性红斑分别计0,1,2,3,4 分;无水肿、轻度水肿、中度水肿、重度水肿、严重水肿分别计0,1,2,3,4 分。根据评分结果,计算观察期间每日每只大鼠刺激积分。刺激评分<0.05分为无刺激性,0.05~2.99分为轻度刺激性,3.00~5.99 分为中度刺激性,6.00~8.00 分为强度刺激性。如存在持久性损伤(损伤持续72 h以上),则延长观察期,以评价上述症状的恢复情况和时间(不超过14 d)。对于出现中度及其以上皮肤刺激性的大鼠,在观察期结束时对给药局部进行组织病理学检查。
1.2.3 皮肤过敏性实验
分组及给药:将30只豚鼠随机分为吴氏侗药烧伤油组(F 组,吴氏侗药烧伤油0.2 mL)、阴性对照组(G 组,等量生理盐水)、阳性对照组(H 组,2,4 - 二硝基氯苯0.2 mL,致敏浓度1%,激发浓度0.1%),各10 只,雌雄各半。于致敏及激发前24 h 分别于豚鼠左右侧背部脱毛(面积约3 cm × 3 cm)。致敏给药分别于第0,7,14 天在豚鼠背部左侧脱毛区域皮肤涂抹相应药物,涂药后依次经滤纸、纱布、牛皮纸、无刺激胶布覆盖,再用绷带固定身体,给药6 h 后去除覆盖物,用温水洗去药物;第14~28 天仅保证其饮食用水自由,垫料清洁即可;于第28天于豚鼠右侧背部脱毛区域皮肤进行激发给药。
观察指标及评价标准:末次给药后,分别于6,24,48,72 h后观察豚鼠皮肤红斑、水肿症状并评分,刺激反应评分标准同1.2.2项下相应标准。计算各组豚鼠的致敏率,并判断豚鼠的致敏强度。皮肤过敏反应平均值=(红斑积分+水肿积分)/动物只数。致敏率=该组发生过敏反应的豚鼠数/ 该组豚鼠总数× 100%,药物致敏强度分为弱致敏(0~8%)、轻度致敏(9%~28%)、中度致敏(29%~64%)、强致敏(65%~80%)、极强致敏(81%~100%);每日笼边观察豚鼠是否有不安、抓鼻、喷嚏、呼吸困难、站立不稳、大小便失禁、痉挛性跳跃、休克等严重全身性过敏反应出现,如难以判定,1 周后再次进行激发给药。
1.3 统计学处理
采用SPSS 26.0 统计学软件分析。计量资料以±s表示,行单因素方差分析。P< 0.05 为差异有统计学意义。
2 结果
2.1 大鼠皮肤急性毒性实验
观察期间,A 组、B 组和C 组大鼠皮肤、毛发、饮食、分泌物、排泄物、呼吸、眼和黏膜、精神状态、四肢活动均正常,无中毒及死亡现象,其中C 组大鼠涂药后第5 日均已完全脱痂愈合。给药24 h、48 h、7 d 时,与A 组比较,B组和C组大鼠体质量均显著改变(P>0.05)。详见图1及表1。
表1 3组大鼠体质量比较结果(±s,n=10)Tab.1 Comparison of rats′ body mass in the three groups(X±s,n=10)
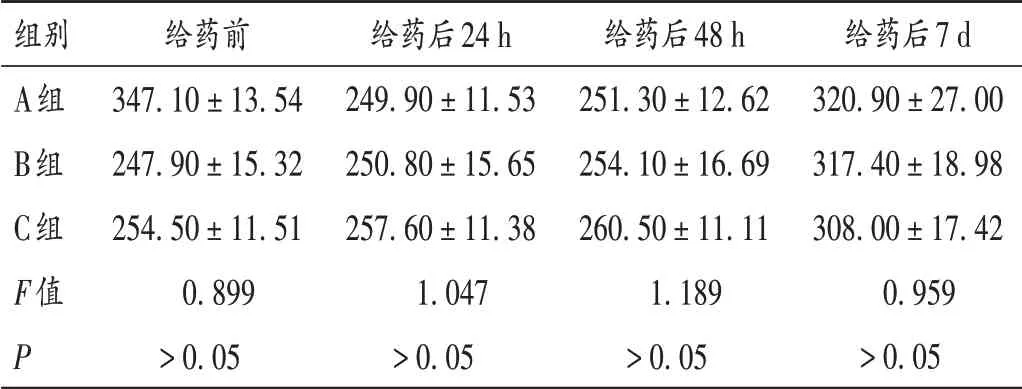
表1 3组大鼠体质量比较结果(±s,n=10)Tab.1 Comparison of rats′ body mass in the three groups(X±s,n=10)
组别A组B组C组F值P给药前347.10±13.54 247.90±15.32 254.50±11.51 0.899>0.05给药后24 h 249.90±11.53 250.80±15.65 257.60±11.38 1.047>0.05给药后48 h 251.30±12.62 254.10±16.69 260.50±11.11 1.189>0.05给药后7 d 320.90±27.00 317.40±18.98 308.00±17.42 0.959>0.05

图1 3组大鼠给药前后皮肤外观变化Fig.1 Changes of rats′ skin appearance in the three groups before and after administration
2.2 大鼠皮肤刺激性实验
观察各组大鼠皮肤及外观,均未见涂抹部位或全身出现红斑、水肿、色素沉着、出血点、皮肤粗糙或皮肤菲薄等症状。即D组、E组大鼠左侧背部刺激评分均为0分。详见图2。
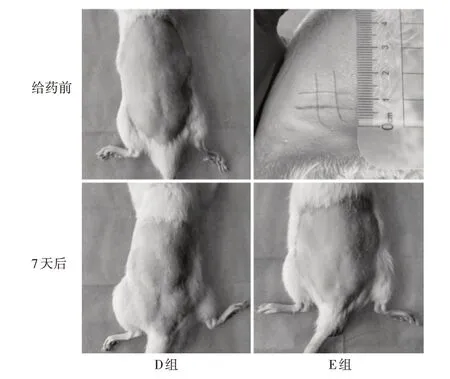
图2 2组大鼠给药前后皮肤外观变化Fig.2 Changes of rats′ skin appearance in the two groups before and after administration
2.3 豚鼠皮肤过敏性实验
F 组及G 组豚鼠给药处皮肤均未见红斑和水肿形成,皮肤过敏反应平均值均为0分,致敏强度为弱致敏;H组在去除药物72 h内出现不同程度的红斑和水肿,激发6,24 h后过敏反应评分表明10只豚鼠出现不同程度的过敏反应,48,72 h 后皮肤过敏反应评分表明个别豚鼠过敏反应减弱,其6,24,48 h 过敏反应强度为极强致敏、72 h 后过敏反应强度为中度致敏。3 组豚鼠各时间段均未见全身过敏反应。激发后6,24,48,72 h G 组与F 组比较,致敏率均无显著差异(P> 0.05)。详见表2及图3。
表2 3组豚鼠激发给药后皮肤过敏性实验结果比较(±s,n=10)Tab.2 Comparison of the incidence of allergic reaction of guinea pigs′ skin in the three groups after irritation administration(X±s,n=10)
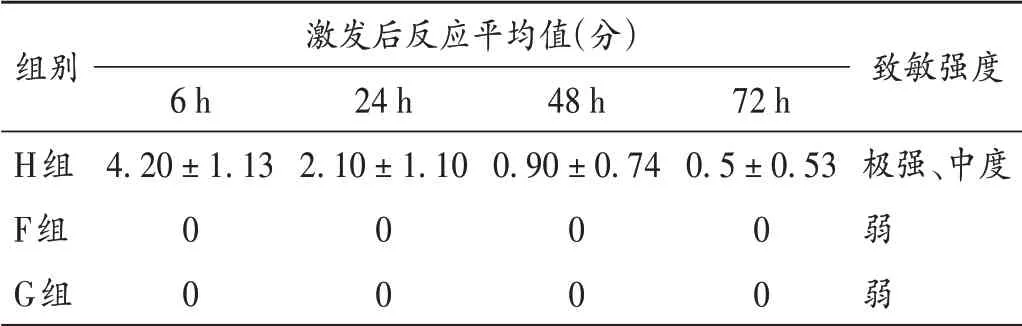
表2 3组豚鼠激发给药后皮肤过敏性实验结果比较(±s,n=10)Tab.2 Comparison of the incidence of allergic reaction of guinea pigs′ skin in the three groups after irritation administration(X±s,n=10)
组别H组F组G组激发后反应平均值(分)6 h 4.20±1.13 0 0 24 h 2.10±1.10 0 0 48 h 0.90±0.74 0 0 72 h 0.5±0.53极强、中度0 0致敏强度弱 弱
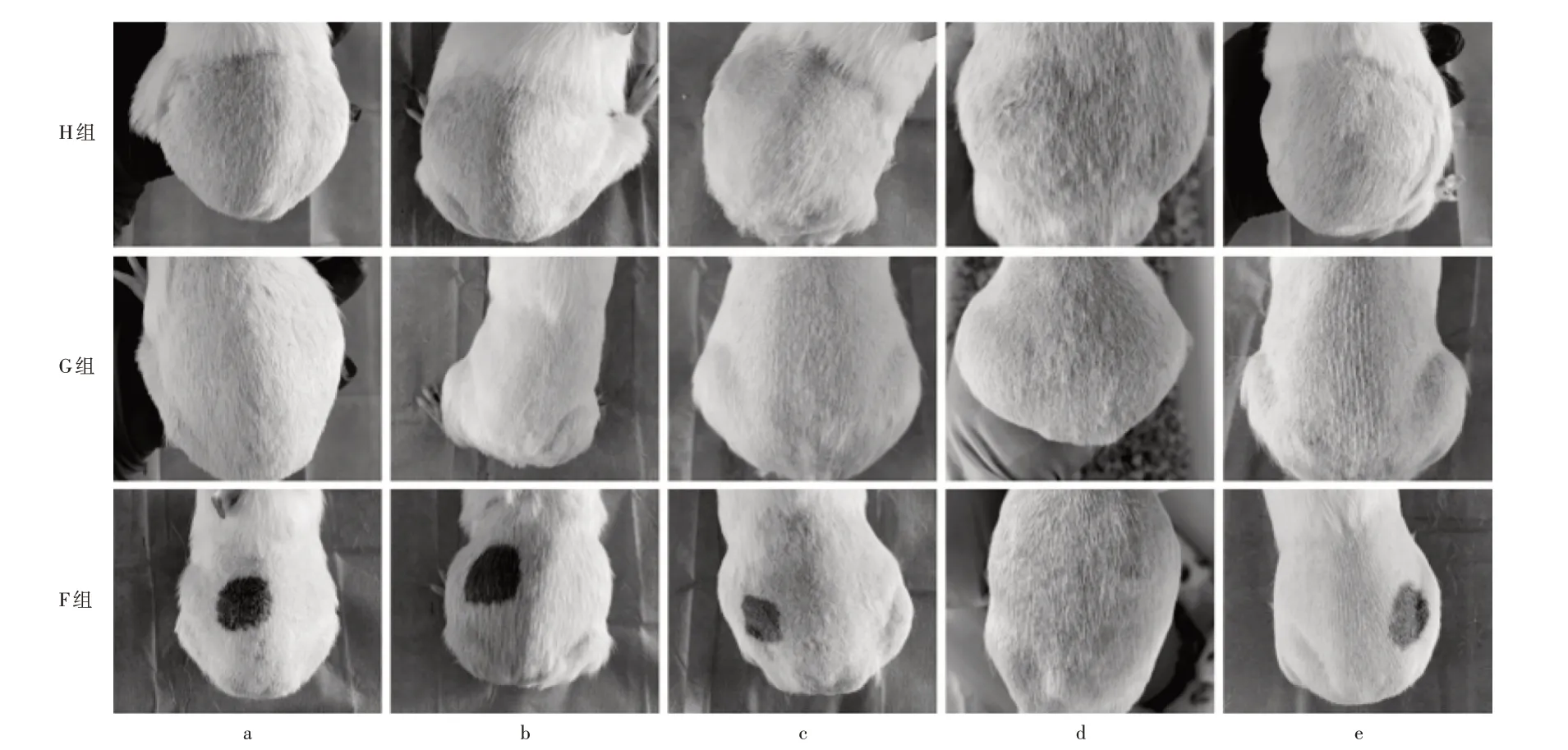
a.致敏给药后0 d b.致敏给药后7 d c.致敏给药后14 d d.致敏后 e.激发给药图3 3组豚鼠给药前后皮肤变化a.0 d after sensitization administration b.7 d after sensitization administration c.14 d after sensitization administration d.After sensitizatione.Irritation administrationFig.3 Changes of guinea pigs′ skin in the three groups before and after administration
3 讨论
吴氏侗药烧伤油是由贵州省黎平县侗族吴氏第5代传承人传承而来,用于治疗烧烫伤的外用制剂,属暴露干燥疗法。吴氏侗药烧伤油主要由茶树籽、地榆、虎杖、紫草4味药材组成,该制剂以茶籽的茶树籽油为溶剂调配而成,其中地榆、虎杖、紫草药材均为临床治疗烧烫伤常用中药,对烧烫伤具有独特疗效。
吴氏侗药烧伤油组方中,茶树籽中的茶树籽油具有较好的亲和性[2],可将药物长时间固定于皮肤受伤部位。茶树籽油中的维生素E具有抗氧化作用[3],茶碱、茶多酚等活性成分能抗氧化、调节免疫功能、消除自由基、促进新陈代谢,茶皂素具有镇痛和抗炎等功效且能抑制白色念珠菌、大肠杆菌的滋生等,角鲨烯可提高免疫力、抗菌、抗紫外线[4];地榆鞣质可在体外发挥抗菌[5]、抗炎、抗氧化作用[6],作为鞣质保护黏膜剂止血效果明显[7],还具有增强免疫[8]、抗肿瘤[9]等药理作用,同时地榆中含有丰富的钾和钙,能凉血止血、解毒敛疮[10];虎杖中含有蒽醌类、二苯乙烯类、黄酮类、香豆素类及脂肪酸类化合物,具有抗病毒、抗菌、调节免疫[11]、抗炎、促进创面愈合[12]等作用;紫草中的紫草素、乙酰紫草素具有抗病毒、促进伤口愈合、增强免疫、抗炎[13]、抑菌[14]、抗肿瘤[15]等作用。
吴氏侗药烧伤油具有使用操作简单、适用范围广、对医疗环境无特殊要求等优势。但目前多在民间使用,推广前必须对其进行安全性及有效性评价。本研究中通过建立实验动物模型进行安全性初步探讨,皮肤急性毒性、皮肤刺激性及皮肤过敏性实验结果表明,吴氏侗药烧伤油外用于皮肤完整组大鼠和皮肤破损组大鼠均未见明显的皮肤急性毒性和刺激性反应,对豚鼠完整皮肤无致敏反应,表明其对皮肤无毒性、刺激性、致敏性。

