不同营养方式下藻蓝蛋白对莱茵衣藻光合作用与生长的影响研究
章 峰,臧晓南*,徐晓婷
(1.中国海洋大学 海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
引 言
海洋红藻与蓝藻具有复杂的捕光系统,该系统由锚定到类囊体膜外侧的藻胆体(Phycobilisome)结构组成。藻胆体能吸收叶绿素捕光波长范围以外的光,并将光能转移至叶绿素和光合反应中心以进行光合作用,这使得藻类植物的光吸收范围几乎遍布了整个可见光区域[1]。藻蓝蛋白(Phycocyanin)是藻胆体的重要组成部分,它能吸收550至650 nm范围内不同波长的光,并将之输入光合作用系统[2]。而以叶绿素和载体蛋白构成捕光复合物的绿色光合生物(green-lineage photosynthetic organisms)只能利用可见光中的蓝紫光(430~450 nm)和橙红光(640~660 nm),而难以利用450~640 nm区域内的光[3]。所以如果能够利用藻蓝蛋白拓宽绿色光合生物的捕光光谱,将有可能增强其光合作用,促进其生长。
莱茵衣藻(Chlamydomonasreinhardtii)是现代微藻研究中的模式生物之一。这种单细胞光合绿藻有着简单的生命周期和易于获得的突变体[4]。研究者们在莱茵衣藻的分子遗传研究中开发出了大量成熟的工具和技术[5]。甚至有学者将莱茵衣藻称为光合酵母[6]。在对光合作用的分析上,莱茵衣藻具有独特的优势:在单细胞衣藻中更容易研究在不同环境条件下基因表达的整体调控;在含乙酸盐的培养基中,莱茵衣藻的细胞数会在5~7 h内翻一番,并在不到两周的时间内完成其生长周期,因此其遗传分析很快[7]。因此,莱茵衣藻是研究异源捕光蛋白表达与光能传递的理想对象。
有光学活性的藻胆蛋白的异源重组表达已经比较成熟。如,Tooley等人在大肠杆菌中表达了具有荧光活性的C-藻蓝蛋白α亚基[8]。Jin等人成功异源表达了具有荧光活性的藻红蛋白[9]。此外,藻胆蛋白在莱茵衣藻表达系统中也成功获得了表达:Su等人在莱茵衣藻中成功表达了别藻蓝蛋白β亚基和别藻蓝蛋白双亚基[10, 11]。但是目前关于在莱茵衣藻的中表达有光学活性的藻胆蛋白的报道很少见,而关于藻胆蛋白对莱茵衣藻光合作用的影响的研究更是罕见。
本研究中我们探究了具有光学活性的藻蓝蛋白对莱茵衣藻光合作用与生长的影响,并比较了在光合自养和混合营养两种营养方式下藻蓝蛋白对莱茵衣藻的影响。而考虑到藻蓝蛋白的光学活性与藻蓝胆素息息相关,而藻蓝胆素的生物合成基于血红素,通过血红素氧化酶和铁氧还蛋白氧化还原酶催化的还原和异构化步骤而产生[12],血红素氧化酶和铁氧还蛋白氧化还原酶在合成具有光学活性的藻蓝蛋白中至关重要。因此本研究在对藻蓝蛋白进行研究的同时,也对血红素氧化酶和铁氧还蛋白氧化还原酶进行了研究。本研究为探索异源藻胆蛋白与类囊体膜间的光能传递奠定了基础,并对以此为基础构建新型光合系统进行了尝试。
1 材料和方法
1.1 实验材料
莱茵衣藻(C.reinhardtii)细胞壁缺失突变株cc849,购自衣藻资源中心(University of Minnesota);基于莱茵衣藻cc849而制备的可稳定表达钝顶节旋藻FACHB 314藻蓝蛋白的转基因莱茵衣藻藻株Cr-PC和可稳定表达钝顶节旋藻FACHB 314藻蓝蛋白、血红素氧化酶与铁氧还蛋白氧化还原酶的转基因莱茵衣藻藻株Cr-PCHP,均获于中国海洋大学海洋生命学院藻类遗传技术与育种研究室。其中转基因藻株Cr-PC和Cr-PCHP具有对潮霉素B的抗性,而对照cc849没有。
所有莱茵衣藻藻株均在TAP培养基(pH 6.8)中混合营养培养,在HS培养基(pH 6.8)中光合自养培养,TAP培养基和HS培养基的配方如表1和表2所示。培养的温度为23oC。光照强度为50 μmol·m-2s-1,光/暗周期为12:12 h。

表1 TAP培养基配方
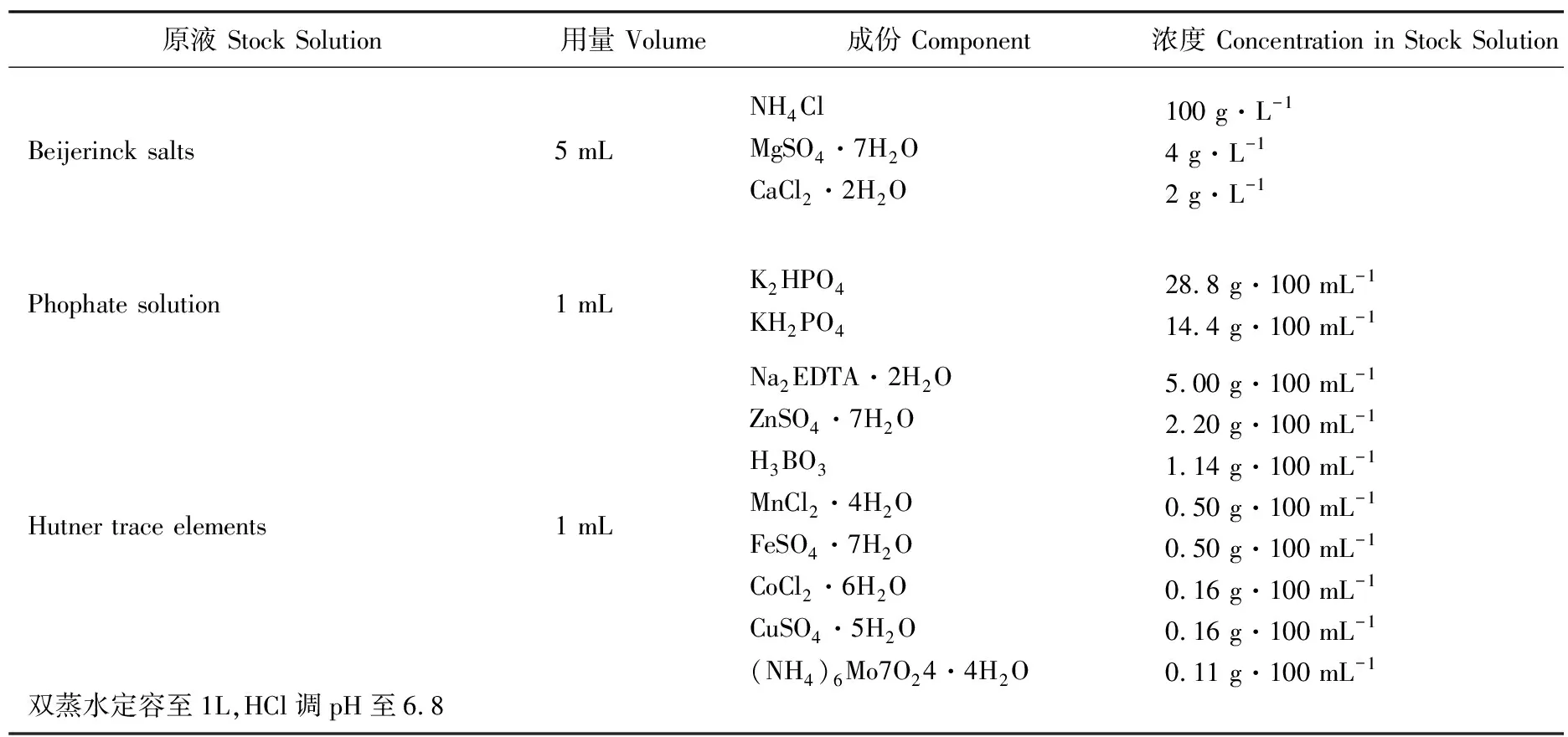
表2 HS培养基配方Table 2 Formula of HS medium
1.2 77K低温荧光发射光谱测定
将分别在HS培养基和TAP培养基中进行光合自养培养与混合营养培养的藻株cc849、Cr-PC和Cr-PCHP在50μmol·m-2s-1的光照强度中培养。
3000×g离心10 min以收获细胞。根据Akio的方法,将细胞重悬于含有15%PEG4000的新鲜TAP培养基中[13],将样品稀释至总叶绿素浓度为50μg/mL(总叶绿素浓度按照Porra等人的方法测得[14])。将样品置于黑暗环境中暗适应15 min,然后装入玻璃管中并在液氮中充分冷冻。将其装入F-4600荧光光谱仪(Hitachi,日本),测量样品从600 nm至800 nm的荧光发射光谱,其中缝隙宽度为5 nm,激发波长为435 nm(叶绿素a的最大激发波长)和580 nm(藻蓝蛋白的特征激发波长)。每个藻株的数据均来自于3个不同的生物学重复,且仅在p<0.05时具有显著差异。
1.3 莱茵衣藻光合参数的测定
取分别在HS培养基和TAP培养基中进行光合自养培养与混合营养培养的藻株cc849、Cr-PC和Cr-PCHP,通过Dual-PAM-100测量系统(Heinz Walz GmbH,德国)测量其PS II和PS I的光合作用的表观电子传递速率[15]。3000×g离心10 min以收集细胞,将获得的细胞均匀重悬于新鲜的TAP培养基中,使得其总叶绿素浓度达到50 μg/mL。将样品在黑暗环境中暗适应3 min,然后测定样品的快速光响应曲线,光化光光强设置为16、39、71、132、204、286、408、578、802、1087、1434和1857 μmol·m-2s-1,每次激发持续30 s。将转基因藻株Cr-PC、Cr-PCHP和对照cc849培养到第8天以进行测量。每个藻株均设有3个生物学重复,且仅在p<0.05时具有显著差异。
1.4 生长曲线与干重积累测定
测量了在HS培养基中光合自养生长和在TAP培养基中混合营养生长的转基因藻株Cr-PC、Cr-PCHP和对照cc849的生长速率和干重积累。每个样品都设有3个生物学重复,且仅在p<0.05时具有显著差异。
实验前先在含有10 μg/mL潮霉素B的新鲜培养基中活化所需藻株。再将之接种到不含潮霉素B的300 mL培养基中。接种后的初始细胞浓度为6×105cells/mL。每天测量各样品在750 nm处的吸光值,并绘制成生长曲线。在接种后的第10天取9 mL培养物,3800×g离心15 min收集细胞,并用双蒸水洗涤2次,在冷冻干燥机中干燥至恒重后测定干重。
1.5 统计与分析
本研究中生物学重复的设置情况和数据的分析方法如下所示。在2种培养条件下,本研究中所有的藻株皆设有3个生物学重复。在数据分析中,对每个藻株的每个数据点都根据生物学重复取其平均值。本研究使用Microsoft Excel计算了每个数据点平均值的标准差,并显示于图中。本文使用Microsoft Excel的T-Test函数计算2组数据间的p值,并且仅在p<0.05时认为各数据点间具有显著差异,在p>0.05时我们认为各数据点间没有显著的差异。
2 结果
2.1 转基因莱茵衣藻藻株的77K低温荧光发射光谱分析
将在HS培养基和TAP培养基中培养的藻株Cr-PC,Cr-PCHP和对照cc849,用435 nm(叶绿素a的特征激发波长)和580 nm(藻蓝蛋白的特征激发波长)的激发光激发并测量其低温荧光发射光谱,据此确定转基因莱茵衣藻中重组藻蓝蛋白的光学活性以及藻蓝蛋白对莱茵衣藻光合系统的影响。
如图1-A和图1-C所示,当激发光波长为435 nm时,无论是培养在HS培养基中的还是在TAP培养基中的转基因藻株Cr-PC、Cr-PCHP,其在670 nm处都有一个对照中没有的荧光发射峰,且Cr-PCHP的峰值高于Cr-PC(p= 3.83×10-6和4.92×10-4)。此时转基因藻株和对照中代表着PS II和PS I的荧光发射峰(685 nm和715 nm)[16]峰值大小相当(p>0.05)。当激发光波长为580 nm时,如图1-B所示,培养在HS培养基中的Cr-PCHP在685 nm和715 nm处的荧光发射峰峰值高于Cr-PC(p=6.78×10-7和4.92×10-13),且两者峰值都高于对照(p= 2.43×10-9、1.03×10-17和7.55×10-3、8.97×10-15)。此时Cr-PCHP在藻蓝蛋白的特征峰620 nm处的峰值亦高于Cr-PC(p=1.03×10-4),且两者都高于对照(p=4.66×10-9和8.52×10-6)(天然条件下藻蓝蛋白的荧光特征发射峰在640 nm处[17],但蛋白质的重组表达可能使其荧光发射峰产生迁移)。而对于培养在TAP培养基中的藻株,如图1-D所示,685 nm处Cr-PCHP和Cr-PC的荧光峰峰值相差无几(p=1.64×10-1),且都显著高于对照(p=5.46×10-3和2.00×10-4),715 nm处Cr-PCHP和Cr-PC的峰值则略低于对照,但不显著(p>0.05)。总的来看,Cr-PCHP和Cr-PC的光合系统有所提升。与此同时,Cr-PCHP和Cr-PC在620 nm处的藻蓝蛋白的特征峰峰值差不多(p= 5.56×10-2),但它们都高于对照(p=1.46×10-4和4.09×10-5)。

图1 HS培养基和TAP培养基中的cc849,Cr-PC和Cr-PCHP藻株的低温荧光发射光谱。Fig.1 Low-temperature fluorescence emission spectra of cc849, Cr-PC and Cr-PCHP in HS medium and TAP medium.A:435 nm激发时,HS培养基中各藻株的荧光发射光谱;B:580 nm激发时,HS培养基中各藻株的荧光发射光谱;C:435 nm激发时,TAP培养基中各藻株的荧光发射光谱;D:580 nm激发时,TAP培养基中各藻株的荧光发射光谱
以上结果表明,在表达了藻蓝蛋白的转基因莱茵衣藻中存在着从藻蓝蛋白到光合作用系统的光能传递,相比于对照cc849,转基因藻株Cr-PCHP和Cr-PC的光合作用都受到了促进。当培养在HS培养基中时,Cr-PCHP中藻蓝蛋白的光学活性高于Cr-PC,此时Cr-PCHP的光合作用受到的促进也更大;当培养在TAP培养基中时,Cr-PCHP中藻蓝蛋白的光学活性与Cr-PC相差无几,两者光合作用所受到的促进也相当。
2.2 重组藻蓝蛋白表达对莱茵衣藻光合作用影响的分析
测定了在HS培养基和TAP培养基中培养的转基因藻株Cr-PC,Cr-PCHP和对照cc849光合作用的表观电子传递速率(ETRPS I和ETRPS II)。对于培养在HS培养基中的样品,如图2-A和2-B,转基因藻株的ETRPS I和ETRPS II值都高于对照(p=4.55×10-2、4.64×10-2、5.75×10-3和1.46×10-2),且藻株Cr-PCHP的ETRPS I和ETRPS II都高于Cr-PC(p=8.54×10-3和4.22×10-2)。即在HS培养基中光合自养生长时,Cr-PCHP和Cr-PC的光合作用比之对照都增强了,且Cr-PCHP增强得更多。而对于在TAP培养基中混合营养生长的样品,如图2-C和2-D所示,对照、Cr-PCHP和Cr-PC的ETRPS I依次递增(p=1.27×10-2、3.85×10-2和4.95×10-2);对照、Cr-PC和Cr-PCHP的ETRPS II大小相当,差异不显著(p =2.12×10-1、2.61×10-1和2.12×10-1)。所以在TAP培养基中,Cr-PCHP和Cr-PC的光合作用比之对照也得到了增强,但其增强幅度低于HS培养基中的相同藻株。

图2 HS培养基和TAP培养基中cc849,Cr-PC和Cr-PCHP藻株PS I和PS II的表观电子传递速率。Fig.2 Apparent electron transfer rates of PS I and PS II of cc849, Cr-PC and Cr-PCHP in HS medium and TAP medium.A:HS培养基中各藻株的ETRPS I曲线;B:HS培养基中各藻株的ETRPS II曲线;C:TAP培养基中各藻株的ETRPS I曲线;D:TAP培养基中各藻株的ETRPS II曲线
2.3 重组藻蓝蛋白的表达对莱茵衣藻生长和生物量积累的影响
分析各藻株的生长曲线和干重积累情况,以研究转基因藻株是否可以比对照cc849更快地生长和/或积累更多的生物质。对于培养在HS培养基中的样品,在光合自养生长时,Cr-PCHP的生长速率和最终细胞密度都高于对照(p=3.66×10-2),而Cr-PC的生长速率和最终细胞密度则与对照相当(p=6.71×10-1)(图3-A)。分析各藻株的干重积累情况,对照、Cr-PC和Cr-PCHP的干重依次递增(p=2.82×10-2、3.26×10-2和9.32×10-3)(图3-B)。即光合自养生长时,胞内藻蓝蛋白光学活性更强的Cr-PCHP能够生长的更迅速并积累更多的生物质。对于培养在TAP培养基中的样品,在混合营养生长中,3个藻株在指数期的生长速率大小相当,藻株Cr-PC的最终细胞密度与对照相当(p=3.18×10-1),但Cr-PCHP的最终细胞密度显著低于Cr-PC和对照(p=1.93×10-2和5.20×10-3)(图3-C)。分析各藻株的干重积累情况,Cr-PC的干重高于对照,而Cr-PCHP的干重则显著低于对照(p=1.12×10-2)。即尽管胞内藻蓝蛋白光学活性相当,但是相比于对照,Cr-PC能够积累更多的生物质,而Cr-PCHP的生长则受到了显著的抑制。

图3 HS培养基和TAP培养基中cc849,Cr-PC和Cr-PCHP藻株的生长曲线和生物量积累。Fig.3 Growth curves and biomass accumulation of cc849, Cr-PC and Cr-PCHP in HS medium and TAP media.A:HS培养基中各藻株的生长曲线;B:HS培养基中各藻株的干重积累;C:TAP培养基中各藻株的生长曲线;D:TAP培养基中各藻株的干重积累
3 讨论
本研究基于能稳定表达钝顶节旋藻FACHB 314藻蓝蛋白的转基因莱茵衣藻藻株Cr-PC和能稳定表达钝顶节旋藻FACHB 314藻蓝蛋白、血红素氧化酶与铁氧还蛋白氧化还原酶的转基因莱茵衣藻藻株Cr-PCHP,探究了光合自养和混合营养条件下藻蓝蛋白对莱茵衣藻光合作用和生长的影响。
77K低温荧光发射光谱结果显示,当激发光波长为435 nm时,转基因莱茵衣藻在670 nm处有着对照中没有的峰。在天然藻胆体中,能量的传递涉及3种携有发色团的蛋白——LCM、β16和αB,它们的最大荧光发射峰为680 nm,负责将藻胆体捕获的光能传递给类囊体膜上的叶绿素[18]。转基因藻株中重组藻蓝蛋白可能能够直接或通过某些中介将能量传递给莱茵衣藻自身的光合系统核心,而此处位于670 nm处的荧光发射峰可能意味着转基因莱茵衣藻正处于这种能量传递的过程中。当激发光波长为580 nm时,相比于对照,Cr-PCHP和 Cr-PC的光合系统都得到了促进。HS培养基中的Cr-PCHP中的藻蓝蛋白的荧光活性高于Cr-PC,Cr-PCHP的光合系统所受到的促进也大于 Cr-PC。而在TAP培养基中,Cr-PCHP和 Cr-PC中藻蓝蛋白的荧光活性相近,Cr-PCHP和 Cr-PC所受到的促进也相当,且此时转基因藻株的光合系统的提升幅度要低于HS培养基中的藻株。值得一提的是,由于血红素氧化酶与铁氧化蛋白氧化还原酶的缺失,Cr-PC中理应没有藻蓝胆素合成,其藻蓝蛋白应当没有光学活性[19]。但在Cr-PC中也检测到了荧光藻蓝蛋白的特征峰,这可能是因为莱茵衣藻中可能存在与藻蓝胆素相似的色基,可以结合藻蓝蛋白并赋予其光学活性。鉴于有学者从莱茵衣藻中分离出了结构与胆色素相似的色素[20],所以这是可能发生的。
对各藻株光合作用表观电子传递速率的分析也证实了以上推断,该结果表明:HS培养基中,Cr-PCHP和Cr-PC的光合作用比之对照都增强了,且Cr-PCHP增强得更多;而TAP培养基中,Cr-PCHP和Cr-PC的光合作用比之对照也得到了增强,但增强幅度低于HS培养基中的相同藻株。线性电子传输中的ATP和NAD(P)H在卡尔文循环中被消耗,而环式光磷酸化产生的ATP可用于其他代谢过程,因此对细胞生长具有积极作用[21],所以此处莱茵衣藻光合作用电子传递速率的上升利于其生长与生物质的积累。
对各藻株生长曲线与干重积累的分析表明,HS培养基中的Cr-PCHP的生长速率更快,干重更大,而Cr-PC虽然无法生长得更快,但它也能积累更多的生物质。而在TAP培养基中,Cr-PCHP的生长速度、最终细胞密度和干重都显著低于对照,这可能是因为当光照强度仅为50 μmol·m-2s-1时,混合营养条件下莱茵衣藻主要依靠培养基中的营养生长,而多种外源蛋白的体内表达给莱茵衣藻带来了能量的负荷。有学者在莱茵衣藻中过表达了果糖1,6-二磷酸酶,并发现了高能负荷对细胞的生长有害[22]。混合营养条件下藻蓝蛋白对莱茵衣藻光合作用的提升并不能起到主导作用,且会被外源蛋白表达所带来的能量负荷抵消一部分,甚至外源蛋白的大量表达可能会拖慢莱茵衣藻的生长。所以TAP培养基中Cr-PCHP的生长受到抑制,而胞内外源蛋白表达更少的Cr-PC虽然能积累更多的生物质,但其生长速率和最终细胞密度却也没有得到显著的提升。
HS培养基中不含任何碳源,莱茵衣藻在其中的生长完全依靠自身光合作用[23]。而TAP培养基中富含乙酸盐[24],乙酸盐是莱茵衣藻生长的优秀碳源,莱茵衣藻生长于其中时不仅能依靠光合作用生长,还能够依靠培养基中的碳源,所以其生长速率远大于在HS培养基中光合自养生长的相同藻株。相比于在TAP培养基中混合营养生长的莱茵衣藻,生长于HS培养基中的莱茵衣藻获得的全部能量都源自光合作用,此时莱茵衣藻因藻蓝蛋白对其光合作用促进而额外获得的能量在其获得的总能量中的占比可能更大,所以转基因莱茵衣藻相较于对照的生长优势也可能会更突出。
综上所述,表达了藻蓝蛋白的Cr-PC和表达了藻蓝蛋白、血红素氧化酶和铁氧还蛋白氧化还原酶的Cr-PCHP中存在着自藻蓝蛋白到光合反应中心的光能传递,这为研究蓝藻光合元件在其他绿色光合生物中的应用奠定了理论基础。本研究表明,藻蓝蛋白能够显著促进在HS培养基中光合自养生长的莱茵衣藻的光合作用与生长,且这种促进在藻蓝蛋白光学活性更强的Cr-PCHP中更显著。而对于在TAP培养基中混合营养生长的莱茵衣藻,藻蓝蛋白能够促进其光合作用,但效果不如光合自养条件下显著,且此时藻蓝蛋白不能显著促进莱茵衣藻的生长。

