马铃薯miR397的克隆及靶基因筛选
李文翔,王 芳,2,3,4,5,6,*,王 舰,2,3,4,5,6
(1.青海大学 农牧学院,青海 西宁 810016; 2.青海省农林科学院,青海 西宁 810016; 3.青藏高原生物技术教育部重点实验室,青海 西宁 810016; 4.青海省马铃薯育种重点实验室,青海 西宁 810099; 5.青海大学 西北马铃薯教育部工程研究中心,青海 西宁 810016; 6.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016)
miRNA(microRNAs)是长度为20~24 nt的内源性非编码单链RNA,是一种在进化上高度保守的小RNA,广泛存在于植物体中,参与转录后基因表达调控。植物中最早在拟南芥中发现miRNA,之后在多种植物中报道了上百个miRNA家族。近年来,对miRNA的不断深入研究发现,miRNA在植物生长发育、形态建成、信号转导、抗逆胁迫等多种生理过程中发挥着十分重要的调节作用。在调控网络中既可以通过一个miRNA来调控多个基因的表达,也可通过几个miRNA的组合来精细地调控某个基因的表达。miRNA不仅在基因位置上保守,在序列上也呈现高度的相似性,高度的保守性与其功能的重要性密切相关。
低温是限制植物生长和发育的重要因素,作物产量受到低温的严重制约。低温胁迫可以诱导miRNA的响应,miRNA的上下调变化、翻译抑制或正向激活等方式可以使下游靶基因的表达发生变化,进而对植物逆境胁迫作出应答响应。李世鹏对玉米自交系苗期冷胁迫处理后miRNA表达谱分析发现了11个上调表达miRNA,26个下调表达miRNA。周玉飞研究表明,木薯中7个miRNA在不同材料中受低温诱导差异表达。miR397是植物中相对保守的miRNA。王健飞用脱落酸(ABA)处理小麦后,发现miR397在4 ℃处理下上调表达。刘彦英等研究推断香蕉漆酶家族基因受miR397和miR408的调控参与低温响应。低温胁迫处理下miR397在香蕉、豌豆中上调表达,在毛竹中下调表达。番茄中过表达miR397a会降低漆酶基因表达量。
随着主粮化进程的深入,马铃薯种植范围越来越大,尤其是南方冬作区休闲田用来种植马铃薯的面积逐年扩大,但马铃薯在生长过程中时常会受到低温冷害,造成马铃薯产业的大量损失。马铃薯低温抗性过程受一套复杂的基因网络调控,Yan等在马铃薯叶片中筛选出miR530、miR167b等低温响应相关保守miRNA。Ou等发现,马铃薯miR393和miR160分别参与1和10的响应过程,从而应答冷诱导甜味现象。谢洁等研究表明,马铃薯miR390-5p通过抑制1的表达参与低温胁迫响应的调控,同时该调控方式在盐胁迫、渗透胁迫和6-BA反应中也发挥了重要作用。
虽然已有报道的低温相关miRNA,但在马铃薯叶片响应低温胁迫中的作用知之甚少。因此,本研究以马铃薯miR397为研究对象,通过克隆分析,并预测潜在靶基因,分析397及其靶基因在不同组织中的表达模式,初步筛选目标靶基因,以期为进一步研究其功能及调控机理提供参考依据。
1 材料与方法
1.1 材料
以马铃薯耐低温品种DR-2和低温敏感品种费乌瑞它组培苗为实验材料,由青海省农林科学院生物技术研究所提供。
1.2 实验处理
组培苗在MS培养基上培养15 d后,将长势基本一致的组培苗转入到新的MS培养基中,每瓶培养基中3株组培苗。对照组转入人工气候培养箱,培养箱温度白天20 ℃、晚上18 ℃,光照强度为10 000 lx,光照时间为12 h;处理组温度为4 ℃,其余条件与对照组相同,设置3次重复。分别处理5 d后,每个重复取18株,将完整的叶片混合样用液氮迅速冷冻,置于10 mL离心管中,存入-80 ℃超低温冰箱备用。
1.3 StmiR397的克隆
1.3.1 DNA提取及扩增
使用TaKaRa MiniBEST Plant Genomic DNA Extraction Kit提取完整功能叶片组织DNA,利用琼脂糖凝胶电泳检测完整性,-20 ℃保存备用。利用Primer设计克隆引物,由上海生物工程公司合成,引物序列如表1所示。利用高成功率PCR酶KOD FX(TOYOBO)进行扩增:2×PCR buffer for KOD Fx反应液10 μL,2 mmol·LdNTPs为4 μL,模板DNA 2 μL,正反向引物各1.2 μL,KOD Fx酶液0.4 μL,ddHO补足到20 μL。PCR反应程序为:94 ℃ 2 min;98 ℃ 10 s,59 ℃ 30 s,68 ℃ 10 s,35个循环;4 ℃ 10 min;4 ℃保存。PCR产物用4%琼脂糖凝胶电泳进行检测。由于PCR产物末端为平滑末端,故以上一步扩增产物为模板,加酶0.7 μL,72 ℃反应15 min。利用TIANgel Midi Purification Kit对目的片段进行胶回收纯化。

表1 本研究使用引物
1.3.2 连接转化
利用Lethal Based Fast Cloning Kit(天根)进行连接反应。加入目的片段2 μL,2×Reaction Solution 5 μL,Blunting Enzyme 0.5 μL,ddHO 0.5 μL,轻弹混匀反应液,短暂离心后20 ℃反应2 min,70 ℃反应5 min,冰置冷却后加入pLB Vector和T4 DNA Ligase各1 μL。将混合液置于室温反应5 min后置于冰上,进行转化反应。将连接后的10 μL反应物加入50 μL大肠埃希菌DH5α感受态细胞中,充分混匀,冰浴30 min,42 ℃水浴90 s,冰置2~3 min,在超净工作台中加入450 μL LB液体培养基。于37 ℃振荡培养箱中150 r·min振荡培养2 h后4 000 r·min室温离心5 min,吸取100 μL菌液均匀涂布于含有氨苄霉素(Amp)抗性的LB固体培养基平板上,于37 ℃恒温黑暗培养箱倒置培养12 h。挑取白色单菌落,使用目的基因特异性引物对菌落进行PCR扩增。检测筛选重组质粒阳性菌,送上海生物工程公司测序。
1.3.3 生物信息学分析
利用Mfold在线工具,参数默认不变,对397的核酸二级结构进行预测。利用miRBase数据库下载番茄、烟草、拟南芥等植物miR397成熟序列,使用Weblogo在线工具进行成熟序列碱基保守性的绘制。利用miRBase数据库下载番茄、烟草、拟南芥等植物miR397前体序列,使用MEGA软件进行前体序列系统发育进化树的绘制。利用在线平台Plant Care对397前体上游1 500 bp的序列分析所含作用元件。
1.4 StmiR397表达模式分析
1.4.1 miRNA的提取及反转录
使用miRcute miRNA Isolation Kit提取材料根、茎、叶组织的miRNA,利用Nanodrop超量分光光度计与琼脂糖凝胶电泳检测RNA纯度及完整性,使用Mir-XmiRNA First-Strand Synthesis(TaKaRa)对质量合格的miRNA反转录:mRQ buffer 5 μL,mRQ 酶液1.25 μL,RNA 3.75 μL;反应程序为:37 ℃ 60 min,85 ℃ 5 min,4 ℃保存;加入90 μL ddHO至总体积为100 μL,-20 ℃保存备用。
1.4.2 实时荧光定量PCR
以cDNA为模板,利用TB GreenTM Premix ExⅡ(TaKaRa)进行qRT-PCR,反应程序为:95 ℃ 10 s;95 ℃ 5 s,60 ℃ 20 s,40个循环;95 ℃ 60 s;55 ℃ 30 s;95 ℃ 30 s。3次重复,分析检测结果。根据2公式计算,利用SPSS软件进行显著性分析。
1.5 StmiR397靶基因预测与筛选
1.5.1 靶基因预测
利用TargetFinder 软件预测,软件参数设置:-c [预测分数截止值]:6;-t [用于搜索parae Smith-Waterman]:6;-p [small RNA靶基因输出格式]:表格;其他参数默认不变。397靶基因序列在马铃薯基因组数据库PGSC中下载获得,利用Primer设计靶基因荧光相对定量引物,引物序列如表1所示。
1.5.2 实时荧光定量PCR
使用TaKaRa MiniBEST Universal RNA Extraction Kit提取DR-2和费乌瑞它低温处理与对照组根、茎和叶片组织的RNA。利用Nanodrop核酸检测仪检测RNA/的比值,利用琼脂糖凝胶电泳分析RNA降解程度以及是否有污染。使用PrimeScriptⅡ1Strand cDNA Synthesis Kit将RNA反转录成为cDNA。反应程序为:37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。将浓度稀释至(200±2)ng·μL后进行qRT-PCR,方法同上。
2 结果与分析
2.1 miRNA同源克隆及结构预测
以叶片DNA为模板,利用特异性扩增引物进行PCR扩增且加A尾后,扩增产物用4%琼脂糖凝胶电泳检测,获得大小约100 bp的条带(图1),与预期一致。测序结果表明,前体序列特异性引物扩增产物为81 bp,且包含其成熟miRNA序列,为21 bp。
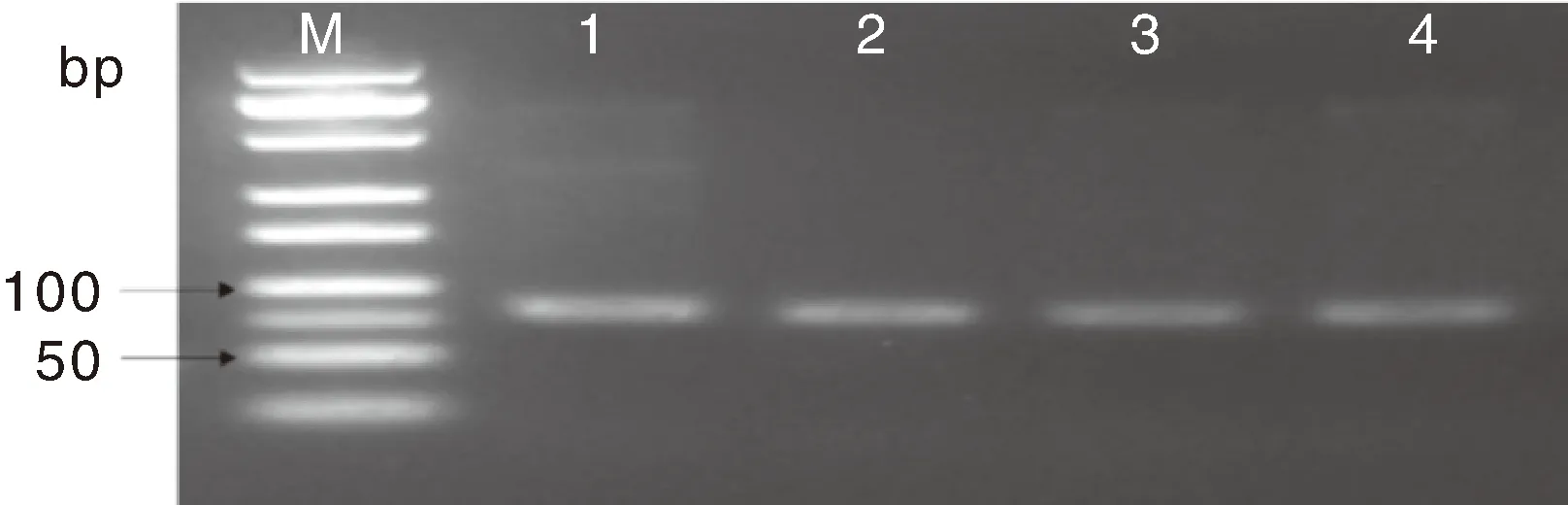
M,Marker A(25~500 bp);1、2、3、4,均为基因片段。
对前体序列进行二级结构预测,发现马铃薯miR397的前体序列(ATTGAGTGCAGCGTTGATGACATATTTGAGAATTTCTGTATTTTGGCCTTTC-TCATTTTTCATCAACGCTACACTCAATCA)能形成稳定的茎环结构,且成熟序列(ATTGAGTGCAGCGTTGATGAC)在前体茎环结构5′端臂上(图2),与其他植物miR397前体有着类似的结构。
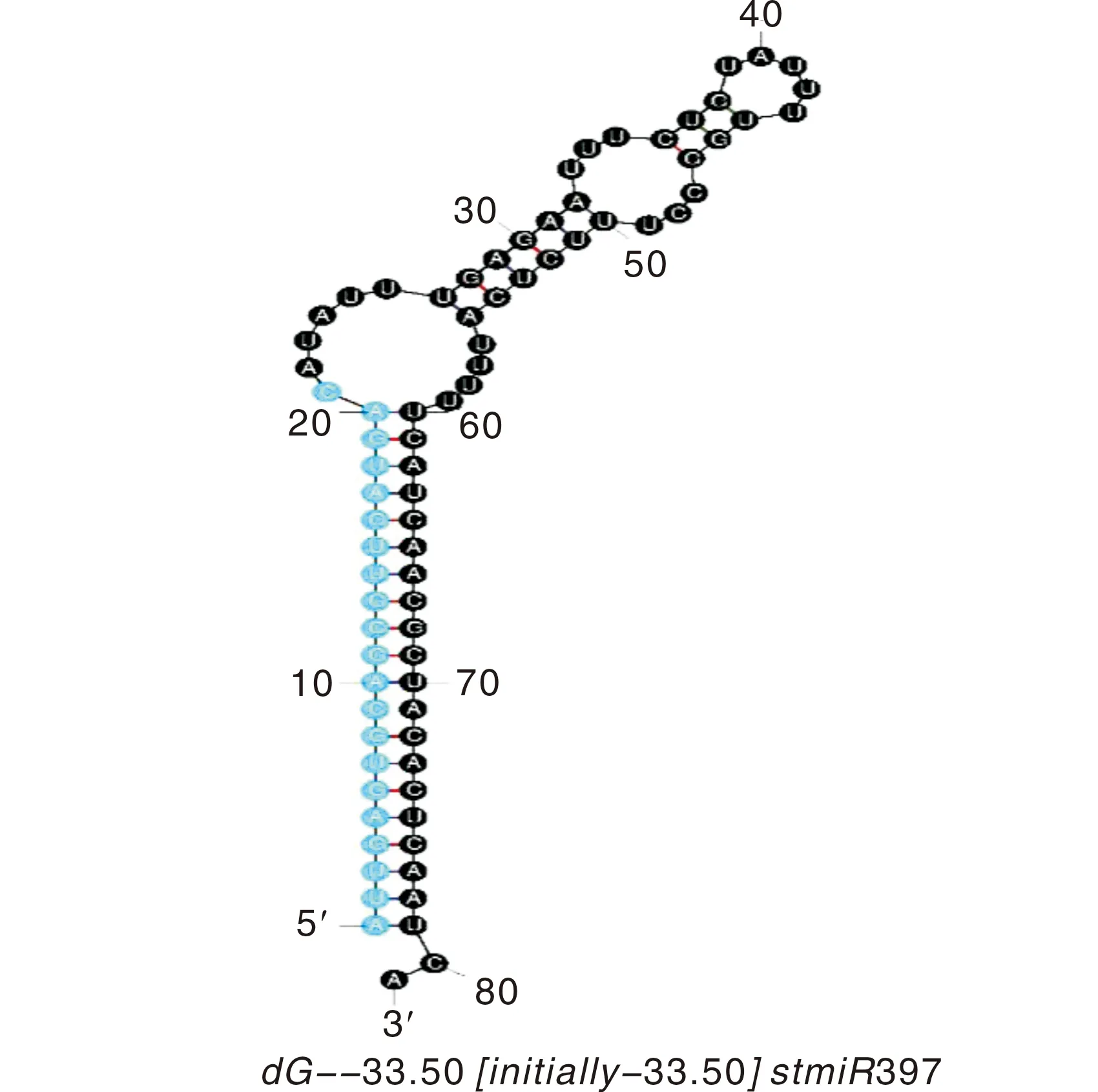
蓝色部分为StmiR397成熟序列。
2.2 StmiR397序列分析
马铃薯miR397与茄科植物、模式植物中miR397成熟序列碱基保守性分析结果表明,miR397具有较高的保守性。miR397家族在第6和8位上的碱基在不同物种中是相同的,397的成熟序列在第1、4、5、9、10、11、12、13、16、17、19、20位上的碱基保守性相对较强(图3)。

图3 miR397成熟序列碱基保守性分析
基于茎环结构序列系统进化树的结果表明,马铃薯miR397与番茄亲缘关系最近,与甜橙关系最远(图4)。植物miR397聚类分支数较多,表明植物miR397前体序列有较丰富的多样性。
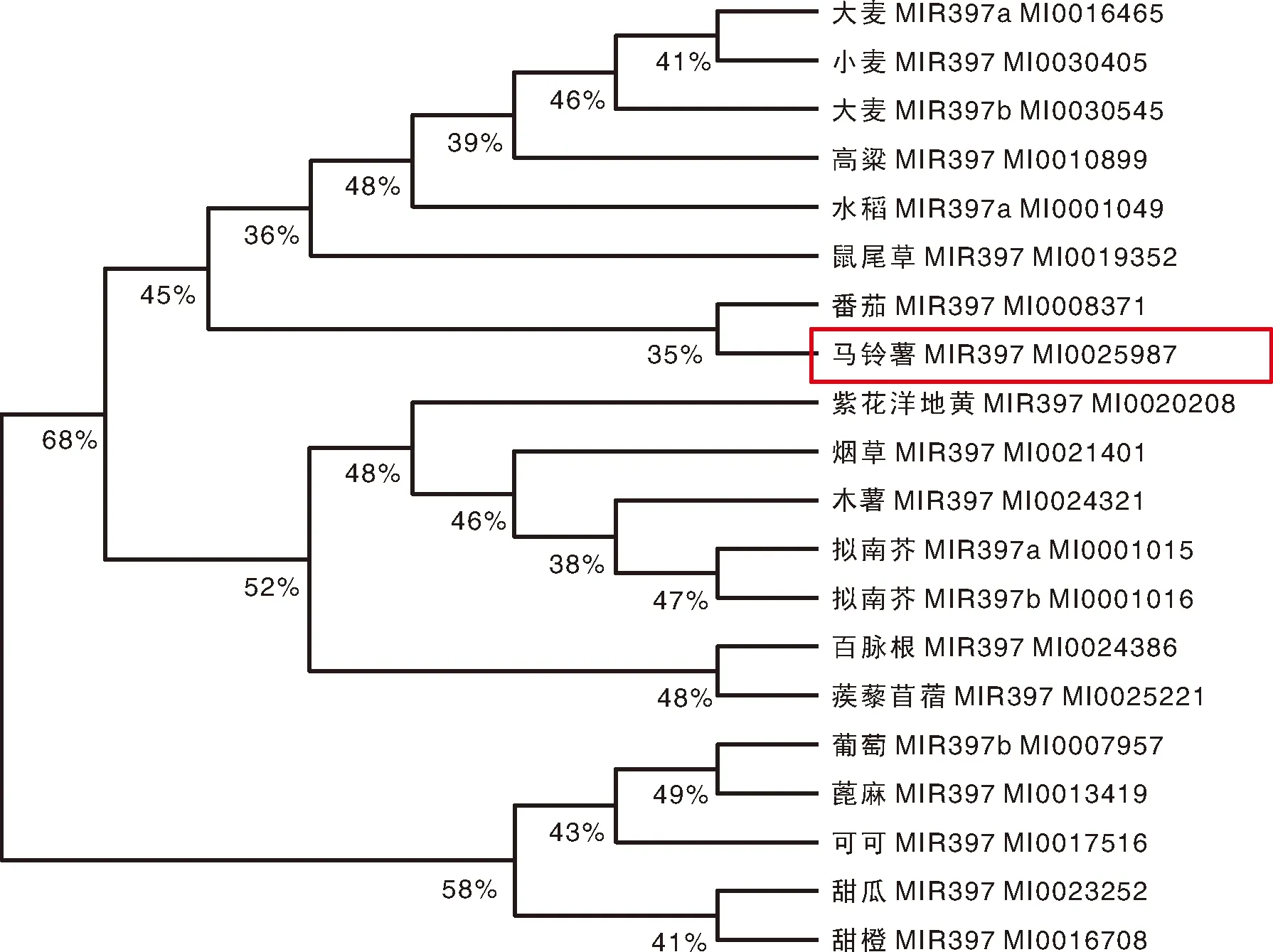
图4 miR397前体序列系统发育进化树分析
397前体上游1 500 bp大小的作用元件进行分析,发现具有启动子基本作用元件,如TATA-box、CAAT-box,同时存在非生物胁迫相关响应元件,如光响应元件G-box、温度响应元件HSE等,另外还包括一些其他调节元件,如脱落酸响应元件ABRE、赤霉素响应元件TATC-box等(表2)。这意味着397可能受到一些逆境胁迫的调节,其表达将会因逆境胁迫而发生变化。

表2 StmiR397前体上游启动子顺式作用元件分析
2.3 StmiR397组织特异性表达分析
提取DR-2和费乌瑞它低温处理与对照组的根、茎和叶片miRNA,利用2%琼脂糖凝胶进行电泳检测,凝胶成像显示一条带,在5S区。表明提取的miRNA没有发生降解,且条带较亮,说明浓度较高,可用于下一步实验。
实时荧光定量PCR结果如图5所示,397在DR-2和费乌瑞它的根、茎和叶组织中均有不同程度的表达。对照组中,DR-2和费乌瑞它两种材料均在茎中表达最高,在根中表达次之,在叶中表达最低。低温处理组中,DR-2和费乌瑞它两种材料均在根中表达最高,在茎中表达最低。在低温处理下的叶片组织中,DR-2表达量上升,是对照组的52.75倍;费乌瑞它表达量仅为对照组的1.75倍。

续表1 Continued Table 1
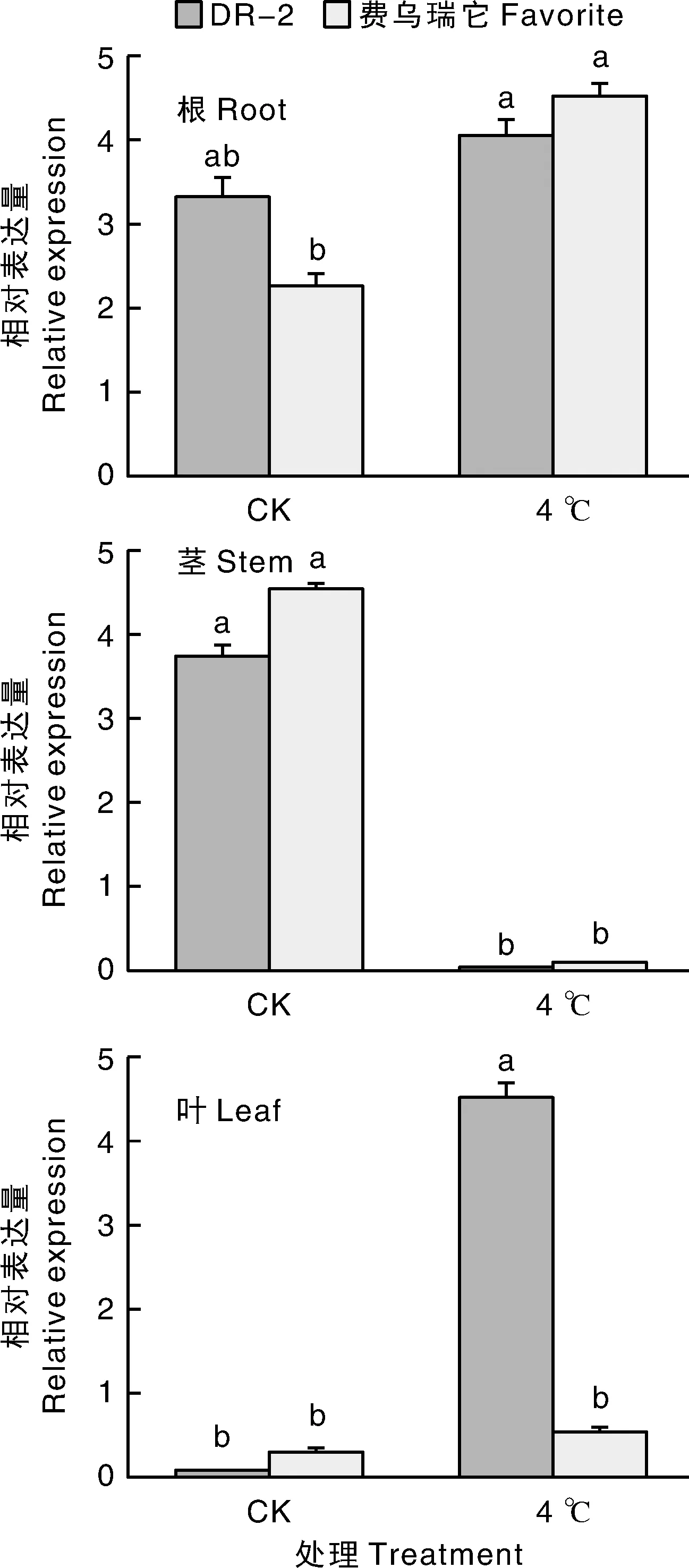
柱状图上不同小写字母表示差异显著(P <0.05)。下同。
2.4 StmiR397靶基因预测
根据植物miRNA与其靶基因结合位点间的碱基配对情况,对397靶基因进行预测及功能注释,结果如表3所示。

表3 StmiR397靶基因预测结果
2.5 StmiR397靶基因组织特异性表达分析
提取DR-2和费乌瑞它低温处理及对照组的根、茎和叶片RNA,利用2%琼脂糖凝胶进行电泳检测,显示两条带分别在28S区和18S区,条带清晰无杂带,且使用Nanodrop检测RNA的纯度(/比值)范围在2.0±0.15,表明样品提取合格,可用于下一步实验。
以DR-2和费乌瑞它低温处理和对照下的根、茎和叶RNA反转录的cDNA为模板,进行实时荧光定量PCR分析,对每个靶基因在根、茎和叶片中的相对表达量分别进行显著性差异分析(图6)。

a~j分别指示LAC7、LAC3、M1BIR1、MOZH35、MIBHR0、M0ZW04、M1AZQ5、M1C9X3、M1CV13、M1C3Q2。
靶基因相对表达量分析表明,低温处理下,预测靶基因在DR-2和费乌瑞它的根、茎和叶部位都有不同程度的表达,且存在一定差异。Beauclair等和Schwab等认为,Northern杂交、实时荧光定量PCR、基因芯片等技术可以验证 miRNA 与靶基因之间在表达上是否存在协同关系,本研究通过对靶基因组织表达量趋势与397的表达水平相比较,可以初步筛选出可能受397调控的潜在靶基因氧化还原酶结构域蛋白、锌指家族蛋白、磷酸果糖激酶家族蛋白和生长素诱导的β-葡萄糖苷酶。
3 讨论
低温是影响植物生长和发育的主要限制因素之一。实验室前期通过高通量测序得到了大量低温相关差异表达miRNA,本研究以miR397为目标,进行基因克隆与靶基因筛选,为后期研究提供一定参考依据。研究表明,miRNA在不同植物中均存在保守性。本研究发现,397的成熟序列保守性较强,碱基位置保守性表明miR397在物种进化过程中是相对保守的。基于茎环序列构建的系统进化树发现聚类分支较分散,表明植物miR397在进化中表现出多样性。本研究对397的启动子结构分析表明,该启动子含有多种逆境、激素相关响应元件,推测可能参与多种逆境胁迫及激素的响应途径。低温胁迫处理下miR397在拟南芥、毛果杨、短柄草中上调表达,但在小麦中抑制表达。本研究表明,低温处理下,397在耐低温材料DR-2根中表达量变化差异不显著,茎和叶中表达量差异显著,在茎中抑制表达,而叶中诱导表达;在低温敏感材料费乌瑞它叶中表达量变化差异不显著,根和茎中表达量变化差异显著,茎中抑制表达,在根中诱导表达。实验表明,miRNA不仅在不同植物中表现出组织特异性,在同种植物中也存在组织表达特异性。
在不同的植物中运作的miRNA通路是多样化的,miRNA通过调控靶基因的表达参与植物的逆境响应。本研究通过对预测到的10个靶基因进行表达量分析,发现靶基因004叶中表达量在DR-2中下调表达,费乌瑞它中上调表达,该基因与氧化还原酶活性相关。研究发现,17激活氧化还原酶类活性物质保护拟南芥免受温度胁迫,低温胁迫导致植物细胞活性氧迅速积累,破坏胞内氧化还原平衡,最终导致细胞损伤。该氧化还原酶结构域蛋白与397表达模式相反,推测是一种抑制调控作用。研究表明,在低温胁迫处理下,锌指家族蛋白(CCHC)在水稻中上调表达,在拟南芥低温敏感材料中敲除编码蛋白可以避免植物受冷害损伤;低温处理下玉米叶中锌指蛋白基因1表达受到抑制,而在根中诱导表达。本研究发现,马铃薯锌指蛋白基因10在两种材料的叶中与397表达模式相同,在根和茎中表达模式相反。该基因参与植物的mRNA结合与翻译调节活性等过程,推测是一个潜在反向抑制转录因子。
单个miRNA可以同时正向激活或者反向抑制几个靶基因共同调控应激反应,何炜等研究表明,甘蔗中磷酸果糖激酶家族蛋白转录产物2-在光合组织中调控蔗糖和淀粉的分配。赵建华等实验表明,果糖激酶基因7的表达存在组织特异性。本研究发现,磷酸果糖激酶家族蛋白基因113在两种材料的根茎叶中都有不同程度的高表达,该基因在 ATP结合、激酶活性和光合作用等途径中都起调控作用,推测在低温胁迫下,靶基因113的上调表达是作为一种糖信号感受器,致使胞内果糖等被快速磷酸化,进而促进了蔗糖的分解进程来调控植株的生长发育。谭照国等研究认为,小麦花药中β-葡萄糖苷酶TaBG表达量的升高增加了可溶性糖的含量,且推测TaBG可能受miR169、miR395a的调控。陈慧清预测拟南芥β-葡萄糖苷酶19参与低温胁迫响应过程。本研究发现,β-葡萄糖苷酶基因132在DR-2中的表达高于费乌瑞它,但是整体表达相对较低,可能在一定程度上影响了可溶性糖的含量导致胞内渗透压下降,与材料对低温的抗性相关,这与实验室前期结果相似。
植物miR397靶基因的研究主要集中在漆酶基因(LAC)、转录因子ICE和CBF基因中,其他靶基因的研究较少。本研究初步筛选的397靶基因氧化还原酶结构域蛋白、锌指家族蛋白、磷酸果糖激酶家族蛋白和生长素诱导的β-葡萄糖苷酶,为进一步开展miR397与靶基因的调控网络提供了一定参考,后续将进行其靶标功能及调控关系研究。

