花椰菜花球发育相关基因BoCAL的KASP标记开发和应用
盛小光,沈钰森,虞慧芳,王建升,赵振卿,顾宏辉
(浙江省农业科学院 蔬菜研究所,浙江 杭州 310021)
芸薹属甘蓝类蔬菜(, 2=18)在全世界被广泛种植和食用,包括表型截然不同的7个变种,如结球甘蓝(var.)、抱子甘蓝(var.)、羽衣甘蓝(var.)、球茎甘蓝(var.)、芥蓝(var.)、花椰菜(var.)和青花菜(var.)(图1)。众多研究表明,这些栽培种都是从同一个祖先物种——野生甘蓝(var.)驯化而来的。野生甘蓝起源于欧洲大西洋海岸,随后被带到地中海地区,在那里完成驯化,并开始产生不同表型的栽培变种(图1)。结球甘蓝和羽衣甘蓝的主茎较短,并且主茎上都长有大量叶片,但是叶片的呈现形式不同。卷心菜是多层叶片内卷形成紧实的叶球,而羽衣甘蓝是多层叶片外翻,形成外形如伞状的菜;抱子甘蓝虽然也形成叶球,但体积很小,并且都着生在主茎叶腋处;芥蓝和苤蓝的食用器官都是茎,但是芥蓝的茎细而长,似圆筒状,而苤蓝具有异常膨大的、似圆球的肉质茎;花椰菜和青花菜的商品器官是花球,分别由异常增生的花序分生组织与众多发育同步的小花蕾组成。

图1 甘蓝类蔬菜作物的不同变种
花球是花椰菜重要的商品器官,同时也是特异的生殖器官。花球的分化与发育属于一种开花逆转现象,是顶端花序分生组织异常分化的结果。在花球形成期,顶端花序分生组织暂时失去了分化成花分生组织的能力,但仍然不断分化次级花序分生组织,花梗增粗,但节间伸长受到抑制。直到合适外部环境条件如温度、光照时间等的诱导,并结合内部开花特征基因的上调表达,使花球重新获得了分化成花分生组织的能力,花梗节间迅速伸长,植株抽薹开花。那么,花椰菜特异的花球发育模式背后的分子机制是什么?众多科研工作者进行了广泛的探索和研究,但是一直进展缓慢,直到拟南芥1双突变体的获得和鉴定。在这一突变体中,本来产生花的花分生组织发生了逆转,形成花序分生组织,并且在其侧翼以叶序-反螺旋的方式产生类似于花椰菜花球的高阶花序分生组织,所以拟南芥1双突变体又称为花椰菜突变体。由此推测,花椰菜中和1的同源基因可能是控制花球形成的重要基因。于是,从不同的甘蓝类蔬菜作物中克隆了和1基因,发现花椰菜和青花菜的基因在第5个外显子的第16位碱基(Pe5+16)存在非同义突变(G-T),导致基因翻译的提前终止,从而使其编码的产物仅含有原来251个氨基酸残基中的150个。另外,从没有花球器官的结球甘蓝中分离并克隆到的基因的读码框是完整的,将功能完整的基因导入到花椰菜中,可以使花椰菜植株的花分生组织分化显著提前,不形成花球而直接产生正常的总状花序。以上结果表明,基因的提前终止突变可能是花椰菜花球产生的重要原因之一。但是,另外一些研究报道发现,基因这一非同义突变同样存在于少数甘蓝和羽衣甘蓝等不形成花球的作物基因组中,同时在极少数花椰菜中也发现了野生型的、未发生突变的基因。这些结果表明,花球表型背后的分子机制比预期的更为复杂。近年来,科研工作者又进行了更深入的探索。Cao等研究结果表明,花椰菜花球发育与基因不同剪切本的转录水平有关。2021年,Azpeitia等发表了一篇Science封面文章,该研究建立了拟南芥1双突变体似花球表型背后的主要基因调控网络,并将该网络嵌入植物发育的三维计算模型中,重现了拟南芥植株由野生型的正常花序逆转为花球的过程。
本研究收集了国内外甘蓝类蔬菜作物共计86份,克隆了所有试验材料基因组中基因的目标片段。利用酶切扩增多态性序列(cleaved amplification polymorphism sequence,CAPS)与竞争性等位基因特异性PCR(kompetitive allele specific PCR,KASP)两种标记手段,检测了基因第5个外显子中第16个碱基的单核苷酸多态性(SNP)等位变异,并分析这个SNP与花球形成的相关性,以期为进一步解析花球发育的分子机理提供宝贵材料与研究思路,同时也为高效、准确检测该位点基因型提供可靠的KASP标记。
1 材料与方法
1.1 试验材料
本研究的试验材料共86份(表 1),其中花椰菜材料30份,主要包括育种亲本与杂交种材料,种质编号为1~30;青花菜材料17份,主要包括育种亲本与世代材料,种质编号为31~47;结球甘蓝6份,全部为杂交种材料,种质编号为48~53;芥蓝5份,包括育种亲本和杂交种材料,种质编号为54~58;苤蓝3份,全部为杂交种材料,种质编号为59~61;羽衣甘蓝9份,全部为杂交种材料,种质编号为62~70;抱子甘蓝2份,全部为杂交种材料,种质编号为71~72;从意大利引进的花椰菜和青花菜地方种材料9份,种质编号为73~81;甘蓝野生种材料(CC,2=18)5份,种质编号为82~86。
1.2 DNA提取
利用CTAB法提取每份材料幼嫩叶片的基因组DNA,用1%琼脂糖凝胶电泳和NanoDrop One超微量紫外-可见光分光光度计(Thermo Scientific 公司,美国)检测DNA的质量和浓度,然后储存于-70 ℃备用。
1.3 引物设计
利用花椰菜和甘蓝全基因组测序信息(http://www.ocri-genomics.org/bolbase/),调取基因,在第5个外显子的第16位碱基的SNP位点(T/G)上下游约200 bp处设计CAPS标记-CAPS1,目标位点处的SNP存在Ⅰ酶切位点——CTAG。另外,在目标SNP位点开发了一个KASP标记(-KASP1),根据目的SNP位点上下游各约100 bp的DNA序列设计了3条引物,包括一条反向通用引物(-KASP1-R:GTCTCATATGAATGAATACAATT)和二条正向特异引物(-KASP1-FHEX:GAAGGTCGGAGTCAACGGATTTTCTTTGGAGGTGGTT-GAGGGACTC 和-KASP1-FFAM:GAAGGTGACCAAGTTCATGCTTTCTTTGGAGGTGGTTG A-GGGACTA),这两条正向引物分别添加HEX和FAM荧光序列标签。
1.4 CAPS标记检测
利用上述设计的普通PCR引物-CAPS1对所有供试材料的基因组DNA进行扩增。PCR反应体系为25 μL,包含10~50 ng基因组DNA,上、下游引物各10 ng,PCRmix 15 μL,其余用水补齐。PCR反应条件为:95 ℃变性 5 min;94 ℃ 35 s、58 ℃ 35 s、72 ℃ 30 s,32个循环;72 ℃延伸10 min,8 ℃保存。
25 μL PCR产物中添加Ⅰ内切酶(Takara,1095A)2 μL和10×K buffer 3 μL,37 ℃酶切2 h。目标位点如果是T,PCR产物就可以被Ⅰ内切酶识别并切开;而目标位点是G,PCR片段中不存在Ⅰ内切酶识别位点,无法切开目标片段。由此,可以通过酶切结果来判断目标位点的基因型。
1.5 KASP标记检测
KASP标记分析由英国LGC公司的KASP基因分型检测平台完成,这套平台集成了微量滴定板复制(repliKator)、试剂分配(Meridian)、滴定板密封(Fusion 3)、热循环PCR(Hydrocycler 2)、数据读取(PHERAstarPlus)和数据分析(Kraken)等仪器,实现了KASP基因分型检测的全自动化。
PCR反应体系10.14 μL,包括5 μL的浓度为10~30 ng·μL基因组DNA,5 μL的KASP master mix(2×),0.14 μL的引物混合物。反应条件为:第1阶段94 ℃变性15 min;第2阶段94 ℃变性20 s,61~55 ℃退火延伸60 s,共10个循环(从第2个循环开始,每个循环降低0.6 ℃);第3个阶段94 ℃变性20 s,55 ℃退火60 s,共26个循环。
KASP-PCR扩增产物用FRET平板探测器(Molecular Devices,Sunnyvale,CA,United States)进行终点法荧光信号读取。KASP反应使用Applied Biosystems 7500 Real-Time PCR System进行,并采用双通道终点法扫描和采集FAM和HEX荧光信号,根据荧光检测结果判断基因型。利用Kluster Caller TM Version 3.4.1.36 software(LGC Biosearch Technologies, United Kingdom)分析SNP分型结果:聚合在轴附近、显示红色的基因型为连接FAM荧光标签序列的纯合等位基因型,聚合在轴附近、显示蓝色的基因型为连接HEX荧光标签序列的纯合等位基因型,中间显示紫色的基因型为2种等位基因的杂合型,左下角靠近坐标轴交点位置并显示黑色的样本为空白对照。以上反应均在96孔PCR模块(Applied Biosystems)上进行。
2 结果与分析
2.1 CAPS标记的开发与验证
从已完成基因组重测序的核心育种材料中,选取目标位点(Ex5+16)基因型不一样的5份材料(2份花椰菜材料为T:T,2份青花菜材料为G:G,1份杂交种材料为G:T)。利用引物-CAPS,对这5份材料进行PCR扩增,均获得了262 bp的PCR产物,经Ⅰ酶切后进行琼脂糖凝胶电泳检测。结果显示,2份花椰菜材料的PCR产物均酶切出187、75 bp两个片段,目标基因型为T:T;2份青花菜的PCR产物没有被酶切开,依旧是262 bp,目标基因型为G:G;1份杂交种材料酶切出262、187和75 bp 3个条带,目标基因型为杂合的G:T(图2)。由此可见,酶切产物电泳显示的目标SNP的多态性与基因组重测序结果完全一致,说明-CAPS标记可准确地鉴定出目标位点的基因型。
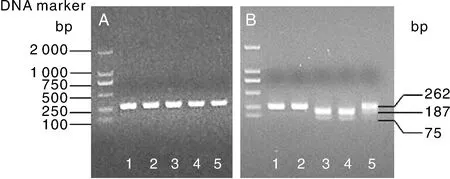
1和2,BoCAL基因Ex5+16位点基因型是G:G的青花菜材料;3和4,BoCAL基因Ex5+16位点基因型是T:T的花椰菜材料;5,BoCAL基因Ex5+16位点基因型是G:T的杂交种材料。
2.2 CAPS标记的检测
利用-CAPS标记对供试86份材料的叶片基因组DNA进行PCR扩增,PCR产物用Ⅰ内切酶进行酶切,酶切产物采用琼脂糖凝胶电泳和聚丙烯酰胺凝胶电泳2种方法进行检测。结果(图3,表1)显示,30份花椰菜材料的目标位点基因型均为纯合。其中,28份材料PCR产物酶切出187和75 bp两个片段,目标位点基因型为T:T;而剩下的2份材料的PCR产物没有被酶切开,依旧是262 bp,目标基因型为G:G。目标位点基因型为T即基因发生提前终止突变的28份花椰菜包含松散型花椰菜、紧花球型花椰菜和宝塔花椰菜,其生育期均小于130 d,是目前我国主栽花椰菜商品种的生育期类型。目标位点基因型为G:G即存在完整的基因编码区的2份花椰菜都是极晚熟材料,生育期均在160 d以上,是花椰菜商品种选育中极少用到的生育期类型。17份青花菜材料中,基因目标位点的3种基因型(G:G、T:T、G:T)都存在;其中,有6份和9份材料的目标基因型分别为T:T和G:G,还有2份高代自交系材料(F)的PCR产物酶切出262、187和75 bp3个条带,即这个位点为G:T杂合基因型。芥蓝、苤蓝和结球甘蓝共14份材料,其基因目标位点均为G:G。9份羽衣甘蓝中,7份材料目标位点基因型为G:G,2份材料显示杂合基因型G:T。从意大利引进的9份花椰菜和青花菜地方种材料,植株主茎普遍较长,都没有主花球,侧枝较多;其中,有4份材料的基因目标位点基因型为G:G,2份材料为T:T,还有3份材料显示杂合基因型G:T。5份甘蓝野生种材料,植株高大,主茎木质化程度较高,生长周期长(2 a开1次花),分支多且没有花球,其基因目标位点基因型均为G:G。

B图中1~86泳道号对应表1编号栏中“/”后面的数字。

表1 86份种质材料名称与BoCAL基因Ex5+16位点的基因型

续表1 Continued Table 1
2.3 KASP标记的开发和验证
针对花椰菜基因第5个外显子第16位碱基存在的G-T的SNP变异,设计了KASP标记-KASP1。选取上述完成基因组重测序的5份材料,目标位点碱基变异类型包括G:G、G:T和T:T(2份花椰菜材料为T:T,2份青花菜材料为G:G,1份杂交种材料为G:T)。 利用标记-KASP1对这5份材料进行基因型鉴定。结果(图4)显示,2份青花菜材料的信号点聚合在轴附近,5′末端连接FAM荧光标签序列的引物竞争性扩增,表明其基因型为G:G;2份花椰菜材料的信号点聚合在轴附近,5′末端连接HEX荧光标签序列的引物竞争性扩增,表明其基因型为T:T;1份杂交种材料的信号点聚合在轴和轴之间,5′末端连接FAM和HEX荧光标签序列的引物同时扩增,表明其基因型为G:T。综上,标记-KASP1对5份材料的基因型鉴定结果与重测序结果一致,-KASP1标记开发成功。

1~2为花椰菜DH系,目标位点为T:T;3~4为青花菜高代自交系,目标位点为G:G;5为2与3杂交的F1,目标位点为G:T。标尺为3 cm。
2.4 KASP标记的检测
为了验证标记-KASP1的准确性和适用性,利用该标记对上述86份甘蓝类作物材料进行目标位点的基因分型。结果(图4)显示,标记-KASP1可将86份材料划分为3组,其中36份材料的信号点为蓝色,聚合在轴附近,基因型为T:T,主要包括28份花椰菜、6份青花菜和2份意大利引进的地方种材料;43份材料的信号点为红色,聚合在轴附近,基因型为G:G,主要包括2份晚熟的花椰菜、9份青花菜、5份芥蓝、3份苤蓝、6份结球甘蓝、7份羽衣甘蓝、2份抱子甘蓝,以及从意大利引进的4份地方种和5份野生种材料;7份材料的信号点为紫色,聚合在轴和轴之间,基因型为G:T,主要包括2份青花菜高代自交系、2份羽衣甘蓝和3份意大利引进的地方种材料。
上述KASP标记对86份材料基因目标位点的基因分型结果与本研究中相应的CAPS标记的检测结果完全一致,但是KASP基因分型技术通量更高,时间更短,基因型读取方便高效。

A,BoCAL基因Ex5+16位点为G:G的2份晚熟花椰菜材料,1为CR01,2为极晚180。B,86份材料目标位点的基因分型结果。标尺为3 cm。
3 讨论
花椰菜的花球是由暂时失去花分化能力的花序分生组织异常分化的结果。花球发育是由花序分生组织基因(等)、花分生组织基因(、1、等)与激素信号途径基因等相互作用所形成的复杂的基因调控网络控制的。前人研究结果表明,花椰菜基因组中的基因第5个外显子上存在单碱基突变(CAG突变为TAG),导致该基因翻译的提前终止,并且这一突变基因型存在于大部分花椰菜材料中。本研究也获得了相似的结果,30份花椰菜材料中有28份材料的目标位点为突变基因型TAG,仅有2份材料的目标位点没有发生突变,含有完整的基因开放阅读框。值得注意的是,这2份没有发生突变的花椰菜花球紧实度介于松散型和紧实型花球之间,生育期均非常长,从植株移栽到花球成熟约180 d。目前,我国乃至印度、意大利等主要花椰菜生产国育成的品种,生育期主要分布在50~130 d,其中,60~100 d的品种最多。极长生育期花椰菜品种的农艺管理难度大,生产成本高,市场接受度低。因此,这一类型的育种材料在花椰菜商品种选育过程中一般不会被采用。由此,推测甘蓝野生种向花椰菜栽培种演化过程中,产生了2种训化途径:一是野生甘蓝受到了长期、强烈的人工选择,由于基因第5个外显子突变所形成的具有花球表型的单株,因为其具有更大的可食用部分和更好的口感,并且生育期相对较短、易于农艺操作,生产的单株被不断选择、固定和保存下来,从而形成了如今较为普遍的花椰菜栽培类型(生育期多为60~100 d);二是野生甘蓝受到了温度、光照等自然环境的选择而非人工选择,在不同于基因的其他某个或者某些位点发生了突变,导致了花序和花分生组织基因之间的调控平衡被打破,从而产生了花球表型,并且保留了对温度、光照相对不敏感的、类似于甘蓝野生种的极长生育周期。因此,这一类保留完整的基因编码区并同时具有典型花球表型的花椰菜材料非常珍贵,可以利用遗传定位并结合转录组数据挖掘控制花球表型的其他关键位点或基因。
青花菜作物虽然也形成花球,但与花椰菜的花球构成不同。青花菜花球是由众多发育成熟并且发育程度相对一致的小花蕾组成,每个花蕾中包含了发育完整的各个花器官,包括雄蕊、雌蕊、花瓣、花萼等。本研究中供试的17份青花菜材料中,基因目标位点纯合突变和未突变的基因型几乎各占一半。这与前人的研究结果一致。由此推测,青花菜花球形成与基因的突变没有直接的相关性,可能由其他基因或者包含基因在内的更为复杂的调控网络控制。
当前用于目标SNP检测的方法主要分为二类,一类是基于凝胶电泳的传统检测技术,包括酶切扩增多态性序列法(cleaved amplified polymorphic sequences,CAPS)、变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)、等位基因特异性PCR(allele specific-PCR,AS-PCR)等。另一类是近些年发展起来的,高通量和自动化程度较高的SNP检测方法,如高通量基因分型测序法(genotyping by sequencing,GBS)、DNA芯片法、TaqMan探针法和KASP技术等。KASP技术相比于基于凝胶电泳的技术具有自动化、高通量、准确性高的优点,同时比基因芯片和探针法技术成本低、操作更灵活、便捷。
本研究针对花椰菜基因第5个外显子上的单碱基突变(G-T),成功开发了KASP标记,该标记的基因型鉴定结果与基因组重测序和CASP标记鉴定结果完全一致,证明了-KASP1标记的准确性和可靠性,从而实现了目标基因型高效率、低成本的快速鉴定。

