良、恶性卵巢甲状腺肿的临床和病理特征分析
田 明 孔 秋 候晓晓 苗劲蔚*
(1.首都医科大学附属北京妇产医院/北京妇幼保健院妇科肿瘤科,北京 100006; 2.北京朝阳中西医结合急诊抢救中心妇科肿瘤科,北京 100022)
卵巢甲状腺肿(struma ovarii,SO)是一种罕见的高度成熟的单胚层卵巢畸胎瘤,主要由甲状腺组织组成,属于卵巢生殖细胞肿瘤。其发病率极低,占卵巢畸胎瘤的2%~3%[1],占全部卵巢肿瘤的0.1%~0.5%,仅不到5%为恶性[2]。临床及影像表现不典型,术前极易误诊。本文回顾性分析了12余年间共93例经手术病理证实为SO的患者的临床症状、超声特点、病理情况及治疗方法,以期提高临床医生对SO的认识及诊断能力,为选择合适的治疗方案提供帮助。
1 对象与方法
1.1 研究对象
选择2009年3月至2021年8月于首都医科大学附属北京妇产医院、北京朝阳中西医结合急诊抢救中心经手术病理证实的80例良性SO、13例恶性SO患者为研究对象。良性SO患者年龄16~82岁,平均年龄(45.19±15.38)岁,绝经患者占31.25%(25/80例)。恶性SO患者年龄27~70岁,平均年龄(50.78±11.75)岁,绝经患者占38.46%(5/13例)。恶性SO患者按FIGO分期标准[3]进行分期,13例恶性SO患者的手术病理分期均为Ⅰ期,其中IA期9例(69.23%),IC期4例(30.77%)。本研究通过首都医科大学附属北京妇产医院伦理委员会审批(审批号为2021-KY-030-01)。
1.2 研究方法
1)患者一般情况收集:记录SO患者年龄、月经状态、症状及体征等资料。
2)超声检查:术前应用GE公司的E8或E10型彩色超声检查仪对所有患者进行经腹或经阴道盆腔超声检查,详细记录盆腔肿物的部位、大小、形态、性质等信息。
3)生化指标检查:术前抽取患者静脉血检测血清糖类抗原125(carbohydrate antigen 125,CA125)、CA199、癌胚抗原(carcino embryonic antigen,CEA)及甲胎蛋白(alpha fetal protein,AFP)水平。具体检测方法:空腹采集静脉血5 mL,室温静置30 min,1 300 r/min离心10 min,吸取上清液,零下80℃冰箱保存。由本院免疫检验室采用德国罗氏试剂公司提供的试剂盒,应用电化学发光免疫法,严格按照操作说明进行检测。CA125参考值为0~35 U/mL,CA199参考值为0~39 U/mL,CEA与AFP参考值分别为0~4.7 ng/mL和0~7 ng/mL。
4)治疗方式:所有患者均行手术治疗,根据患者的年龄、月经、生育要求、肿物大小、性状等选择不同的手术入路及方式。恶性SO患者根据美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)指南[4]选择术后补充化学药物治疗(以下简称化疗)或观察。
5)病理检查:肿物切除后先肉眼观察大体及剖面性状,由术者决定是否进行快速冰冻病理检查。所有切除标本均石蜡包埋应用苏木精-伊红(hematoxylin-eosin,HE)染色后镜下观察,由高年资病理医生明确病理诊断,诊断困难的补充检测相关免疫组化指标。
1.3 统计学方法

2 结果
2.1 临床表现
绝大多数的SO患者无明显临床症状,仅为体检发现。80例良性SO患者中有1例出现明显胸、腹水等假性Meigs综合征的临床症状。所有患者均无甲状腺功能亢进症(以下简称甲亢)相关症状,详见表1。

表1 SO临床表现Tab.1 Clinical manifestation of SO n(%)
2.2 超声特点
SO的超声表现不特异,良、恶性区别亦不明显。多发生在单侧卵巢,边界清、囊实性占一半以上,少数呈不规则分叶状。良性SO以囊内分隔、多房常见(P<0.05),可见附壁结节、血流信号及盆腹腔游离液。而恶性SO可见钙化灶,却未见附壁结节及盆腹腔积液。
囊性肿物内可透声好,也可见密集细点状回声或网格样回声;囊实性肿物内可表现为团块样、短线状、片状、点状、索条样高回声;实性肿物一般回声混杂不均,详见表2。

表2 SO的超声特点Tab.2 Sonographic features of SO
2.3 血清肿瘤标志物
良、恶性SO患者中血清肿瘤标志物浓度差异无统计学意义(P>0.05)。良性SO患者中仅16例(20%)患者出现了肿瘤标志物的升高,其中1例假性Meigs综合征的患者CA125显著升高至1 154 U/mL,手术切除肿物后1个月CA125迅速降至正常。恶性SO患者中3例(23.08%)出现了CA199浓度的轻度升高,详见表3。

表3 SO肿瘤标志物升高情况Tab.3 Elevation of tumor markers n(%)
2.4 临床治疗
1)手术方式:80例良性SO患者中,61例(76.25%)患者进行了腹腔镜手术,41例(51.25%)患者行卵巢囊肿剥除术,仅13例(16.25%)绝经期患者行全子宫+双附件切除术,详见表4。

表4 良性SO手术方式Tab.4 Surgery of benign SO n(%)
13例恶性SO患者中,12例(92.31%)患者进行了开腹手术,5例(38.46%)患者行全子宫+双附件切除+大网膜及盆腹膜多点活检的分期术,详见表5。良性SO患者与恶性SO患者相比,手术入路多为腹腔镜(P<0.01),详见表6。

表5 恶性SO手术方式Tab.5 Surgery of malignant SO n(%)
表6 良、恶性SO手术入路比较Tab.6 Comparison of surgical approaches between benign and malignant SO n(%)
2)术后补充治疗:13例卵巢甲状腺肿类癌患者中,应用博来霉素+依托泊苷+顺铂(bleomycin+etoposide+cisplatin,BEP)方案化疗3例,紫杉醇+卡铂(paclitaxel+carboplatin,TC)方案化疗1例,其余9例门诊严密随访。
2.5 病理结果
大体病理显示,无论良性或者恶性,卵巢肿物可呈多房、囊性、囊实性或实性,内可见分隔,囊壁薄厚不均,质地均不糟脆。内容物可为黄色/灰褐色胶冻样、陈旧性出血病灶、脂肪、毛发或清亮液体(图1)。良性SO镜下可见成熟的甲状腺组织,可见大小不等的滤泡上皮,为单层立方或低柱状,腔内可见不等量的嗜伊红胶样物(图2)。1例良性SO合并假性Meigs综合征患者术前腹水穿刺细胞学提示部分细胞呈印戒样,而术中腹水细胞学仅提示少许急慢性炎细胞。

图1 SO典型的大体标本(A)及剖面所见(B)Fig.1 Typical general pathological appearance (A)and cross section(B)of SO
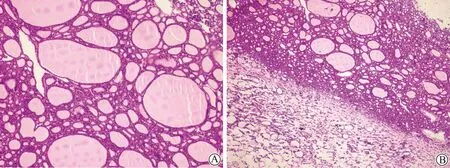
图2 良性SO镜下所见Fig.2 The microscopic performance of benign SO(HE staining)A:100×;B: 40×; Follicular epithelium and eosinophilic colloids are visible;SO:struma ovarii; HE:hematoxylin-eosin.
13例恶性SO病理均为卵巢甲状腺肿类癌。
术中冰冻病理情况:6例(46.15%)恶性SO患者行冰冻病理检测,其中:1例回报未见恶性,考虑畸胎瘤可能;1例回报低度恶性,sertoli细胞瘤?可见黏液腺体成分;4例回报SO合并甲状腺类癌。13例(16.25%)良性SO患者行冰冻病理检测,其中:12例为卵巢畸胎瘤,合并SO(2例存在局部上皮生长活跃);1例卵巢上皮生长活跃,局灶不除外交界。
93例良、恶性SO患者中,仅15例进行了免疫组化检测,甲状腺转录因子-1(thyroid transcription factor-1, TTF-1)、甲状腺球蛋白(thyroglobulin,TG)均为阳性。10例检测了Ki67,表达程度低:≤2% 5例(50.00%),≤5% 4例(40.00%),5%~10% 1例(10.00%)。
3 讨论
任何年龄女性均可发生SO,但绝大多数良性SO发生在育龄期,本文中良性SO患者年龄分布范围广(16~82岁),平均年龄(45.19±15.38)岁,绝经患者占31.25%,与杨倩等[5]报道的发病年龄相似。原发于卵巢的类癌占所有类癌的0.5%~1.7%,而卵巢甲状腺肿类癌是卵巢类癌的一种亚型,多见于围绝经期或绝经后的女性[6]。本文中恶性SO患者年龄27~70岁,平均年龄(50.78±11.75)岁,但绝经患者仅占38.46%。
良、恶性SO均无典型临床症状,多为体检发现,少数出现腹痛、腹胀等类似卵巢恶性肿瘤的表现,部分患者会出现甲亢等临床症状[7-9]。Chiang等[10]2021年报道了首例恶性SO合并Graves病且转移至腹膜的病例,但具体机制不详。假性Meigs综合征表现较为少见,而合并血清CA125异常升高更为罕见[11],常被认为是卵巢恶性肿瘤。部分卵巢甲状腺肿类癌患者可出现类癌综合征表现。本文中良、恶性SO患者均无甲亢表现,出现CA125、CA199等肿瘤标志物升高的患者分别占20%及30.77%,其中以CA199升高较为常见,仅1例(1.07%)良性SO患者出现了假性Meigs综合征同时CA125的异常升高。与卵巢恶性肿瘤合并腹水患者不同,SO合并腹水患者无消耗性表现,体质量减轻不明显,少有低蛋白血症[12]。
超声检查是简单易行的主要术前诊断手段,但SO超声下表现变化多端,诊断极具挑战性。有学者[5]认为SO的超声表现具有一定特征:单侧,边界清晰且规则的多房囊性或囊实性肿物,囊内见附壁结节同时伴血流信号。也有文献[8,13-15]报道SO可表现为轮廓光滑的实心圆形成分、串珠样、声学阴影及偶尔出现皮样征、面团征,散在点状强回声等,分隔,钙化,实性部分见/未见血流信号、甚至丰富血流信号。小部分实性伴丰富血流信号肿物被误诊为卵巢恶性肿瘤,但实性回声与甲状腺组织回声相近,血流信号虽丰富但走行尚规则;而卵巢上皮性恶性肿瘤常表现为边界不清、内杂乱不规则分隔和多发不规则低回声实性突起同时伴丰富不规则血流的特点。少数患者可见盆腹腔游离液,但这并非SO恶变的征象。本文中17例(21.25%)良性SO患者超声提示盆腹腔积液,而恶性SO却无盆腹腔积液的表现。超声对恶性SO的诊断能力有限,然而当观察到“彗星尾”征时需警惕局部癌变可能[5]。
SO术前诊断困难,术中冰冻病理检查有一定辅助诊断的作用,但一般仅在术者发现卵巢肿物呈实性或见附壁结节时进行。本文中仅6例(46.15%)恶性SO患者行冰冻病理检查,其中1例未回报恶性,即61.54%(8/13)的恶性SO依靠术后石蜡病理方能明确诊断。故笔者认为,术中冰冻病理的价值在于排除恶性。有文章[16]将SO定义为完全或主要由甲状腺组织(>50%)构成的肿物,也包括成熟畸胎瘤中少于50%的甲状腺组织却包含甲状腺恶性肿瘤的情况。恶性卵巢甲状腺肿较为罕见,诊断时必须排除甲状腺原发癌的转移。本文中良性SO肿物直径3.3~30.0 cm,卵巢甲状腺肿类癌的肿物直径3.0~12.6 cm。SO大体病理大部分类似成熟畸胎瘤的表现,内可含毛发、油脂,典型的表现为:多房,壁薄厚不均,黄色/灰红色胶冻样内容物,可见陈旧性出血灶或壁内见质硬乳头样结节。良性SO镜下可见成熟的甲状腺组织,至少>50%,可见大小不等低柱状、扁平上皮或单层立方滤泡上皮,腔内见不等量的嗜伊红胶样物[15]。恶性SO与原发性甲状腺癌的病理诊断标准相同,当镜下见SO内甲状腺组织细胞出现细胞核异型性、核分裂象增加、血管浸润等现象则提示为恶性SO[5,17],其中甲状腺乳头状癌是常见的病理类型,免疫组化中甲状腺相关指标TG及TTF-1在类癌区域中部分呈阳性。本文中13例恶性SO均为类癌,15例行免疫组化检测的患者中无论良、恶性,TG及TTF-1均呈阳性,提示TG及TTF-1可作为SO的特异性免疫组化指标。
SO发病率低,尚无明确的治疗指南。手术是治疗SO的主要治疗方案,手术方式的选择需综合评估术前查体、肿物大小、超声、肿瘤标志物等情况,并最好与应对过罕见卵巢肿瘤的多学科团队进行讨论[18]。如术前考虑良性肿物,可按成熟畸胎瘤制定手术方案;如考虑为恶性肿物,可选择剖腹探查或腹腔镜探查,根据术中所见、大体病理表现并可借助冰冻快速病理做出判断。对于Ⅰ期卵巢甲状腺肿类癌患者,并不提倡全面的卵巢癌分期术,可行全子宫+双附件切除术;需要保留生育功能的患者可行患侧附件切除;Ⅱ期以上患者需行卵巢肿瘤细胞减灭术并补充化疗[6]。本文中61例(76.25%)良性SO患者行腹腔镜手术,41例(51.25%)行卵巢囊肿剥除术。12例(92.31%)恶性SO患者行经腹手术,5例(38.46%)行全子宫+双附件切除术,5例(38.46%)行卵巢癌分期术,术中均无特殊情况。如确诊为恶性SO,需全面评估甲状腺以排除转移性恶性SO。本文中恶性SO行开腹手术患者比例极高,可能与年龄偏大及卵巢囊实性肿物较大有关(10例患者年龄≥47岁,1例36岁患者为双卵巢肿物,直径分别为12 cm、10 cm,另1例27岁患者单侧卵巢囊实性肿物9 cm),同时恶性SO例数较少,不除外偏倚现象。
良性SO预后好,切除后复发率低。而卵巢甲状腺肿类癌属于低度恶性肿瘤,几乎所有患者发病时为临床Ⅰ期(与本文报道一致),预后亦好:有学者[19]发现,Ⅰ期卵巢类癌患者10年生存率为100%,而Ⅲ期及以上5年生存率降至33%,中位生存期仅为1.2年。另有文献[6]报道5年、25年生存率分别为 92%、79%。卵巢甲状腺肿类癌偶可转移至骨骼或乳腺,需严密长期随访[20-21]。有研究[6,10]提出卵巢甲状腺类癌患者术后需辅以化疗和/或放射性131I治疗(合并甲亢患者),但也有文章[22]指出卵巢甲状腺肿类癌对放、化疗均不敏感,患者并不一定能从术后的补充化疗中受益,故建议严密随访。本文中4例甲状腺类癌患者术后进行了BEP方案或TC方案的补充化疗,化疗过程顺利。
综上所述,SO临床症状、相关辅助检查均无特异性,易与各类型卵巢肿瘤相混淆。但超声、大体病理尚有一定的特征,临床医生应对SO相关表现有所了解,以减少不必要的剖腹手术和广泛的外科手术。但因其低发病率,需要进行进一步大规模的研究,为SO的诊治提供具体依据。

