长链非编码RNA FOXC2-AS1在肿瘤中的研究进展
李 静,李里香
长链非编码RNA(long nocoding RNA, lncRNA)是一类长度大于200 nt的非编码RNA,lncRNA已被证实参与肿瘤多种复杂的生物学过程,如细胞生长、增殖、分化、侵袭、转移等[1-3]。FOXC2-AS1(又称ODRUL)是一种新发现的lncRNA,是由FOXC2负链转录的单条反义寡核苷酸RNA。研究表明,FOXC2-AS1在骨肉瘤、黑色素瘤、肺癌、前列腺癌等中的表达存在差异,其不仅促进肿瘤的发生、发展,还参与肿瘤的多种生物学过程。本文现对FOXC2-AS1在不同肿瘤中的研究进展进行综述,并对其研究前景进行展望。
1 FOXC2-AS1简述
多个研究结果显示反义寡核苷酸RNA可通过调节其内源基因的表达,参与细胞的生理和病理过程[4-5]。FOXC2-AS1定位于人类基因组16号染色体q24.1上,全长为319个核苷酸。现有研究表明,FOXC2-AS1在不同肿瘤中存在差异表达,其在骨肉瘤中通过FOXC2-AS1/miR-3182/MMP途径发挥致癌作用;在肺癌和黑色素瘤中通过p15发挥致癌作用;在前列腺癌中通过FOXC2-AS1/miR-1253/EZH2途径发挥致癌作用;在结直肠癌中通过Ca2+-FAK信号途径发挥致癌作用。因此,FOXC2-AS1被认为是未来肿瘤的治疗靶点标志物。
2 FOXC2-AS1与肿瘤的关系
随着lncRNA的研究不断深入,其与肿瘤的关系逐渐被认知。研究发现,FOXC2-AS1在一些肿瘤中表达上调,特别是在骨肉瘤、肺癌、黑色素瘤、前列腺癌、乳腺癌等中表达上调(表1)。
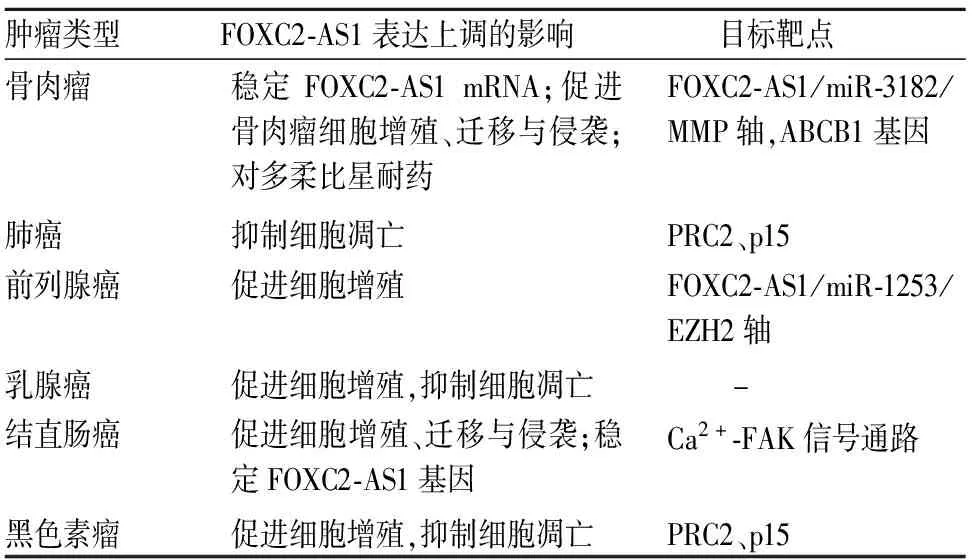
表1 不同肿瘤中FOXC2-AS1的作用
2.1 FOXC2-AS1与骨肉瘤骨肉瘤是儿童和青少年最常见的原发性恶性肿瘤[6]。新辅助化疗的标准化应用增加了患者保肢治疗的可能性。然而,化疗耐药性的出现极大地阻碍患者5年生存率的提高[7]。Zhang等[8]通过qRT-PCR检测骨肉瘤细胞系及组织中FOXC2-AS1的表达水平,发现在多柔比星耐药的骨肉瘤细胞系和组织中,FOXC2-AS1与FOXC2共同上调。与FOXC2-AS1相似,FOXC2也通过调节ABCB1的表达促进骨肉瘤对多柔比星的耐药性。Kaplan-Meier生存分析发现,骨肉瘤组织中FOXC2-AS1高表达与较低的疾病进展率和总生存期显著相关。CCK-8及集落分析实验表明FOXC2-AS1可以促进骨肉瘤对多柔比星的耐药。此外,作者还发现FOXC2-AS1与其编码有义配偶体FOXC2的外显子有重叠区域,进一步的生物信息学分析和FISH检测结果显示,这两种分子主要定位于细胞质,FOXC2-AS1敲除显著降低FOXC2的基因水平,Western blot法检测结果亦显示敲除FOXC2-AS1表达亦降低FOXC2蛋白水平。相比之下,敲除FOXC2后,FOXC2-AS1的表达水平未见明显下降。此外,进一步的机制研究表明,FOXC2-AS1通过其重叠区域的保护作用,形成一个防止FOXC2 mRNA被RNase降解的RNA-RNA双链结构,随后在转录和转录后水平稳定FOXC2表达,进而刺激ABCB1的表达,从而导致骨肉瘤对多柔比星的耐药。因此,作者推测FOXC2-AS1可能是一个候选的预后生物学标志物和逆转多柔比星耐药性的目标。Zhu等[9]研究发现FOXC2-AS1在骨肉瘤组织和细胞系中上调,并可以诱导MMP-2和MMP-9的表达进而促进骨肉瘤细胞迁移和侵袭。研究发现下调FOXC2-AS1表达水平可降低MMP的表达,体外和体内实验结果显示其抑制骨肉瘤细胞增殖、迁移、侵袭和肿瘤生长。微阵列筛选结合在线数据库分析显示,在表达sh-FOXC2-AS1的MG63细胞中,miR-3182上调、MMP-2下调,并且miR-3182具有FOXC2-AS1和MMP-2的mRNA 3’UTR潜在结合位点。此外,miR-3182的表达和功能与体外和体内的FOXC2-AS1表达呈负相关。荧光素酶报告基因实验结果进一步表明FOXC2-AS1直接与miR-3182竞争性结合,并上调MMP-2的表达。该研究首次阐明了FOXC2-AS1/miR-3182/MMP-2通路在骨肉瘤中的作用,并揭示FOXC2-AS1可能为骨肉瘤新的潜在治疗靶点。
2.2 FOXC2-AS1与非小细胞肺癌非小细胞肺癌是一种常见的恶性肿瘤,多数患者确诊时已为晚期,预后差。因此,探究非小细胞肺癌的分子机制及有价值的生物学标志物和肿瘤治疗靶点具有重要意义[10]。Sun等[11]的研究结果显示,非小细胞肺癌组织中FOXC2-AS1的表达水平明显高于癌旁正常组织,且FOXC2-AS1高表达与非小细胞肺癌患者的总生存期密切相关。CCK-8实验及细胞周期分析结果显示,敲除FOXC2-AS1可显著抑制非小细胞肺癌细胞系(A549、H460)的增殖,加速细胞凋亡,并诱导细胞周期停滞在G0/G1期。机制实验进一步表明,FOXC2-AS1通过将PRC2募集到p15的启动子上抑制p15的表达。PRC2是个多亚基复合物,包括EZH2、EED和SUZ12。回复实验验证了FOXC2-AS1和p15之间的相互作用。总之,此研究结果证实FOXC2-AS1可通过相互作用EZH2抑制p15的表达而加重非小细胞肺癌的发生,可为非小细胞肺癌的治疗策略提供新思路。
2.3 FOXC2-AS1与前列腺癌Chen等[12]研究发现FOXC2-AS1在前列腺癌组织和细胞中表达上调。CCK-8实验、集落形成实验、流式细胞术的周期分析及体内异种移植试验等结果表明,FOXC2-AS1在体外和体内均有促进前列腺癌细胞增殖和生长的作用。为研究FOXC2-AS1在前列腺癌中的分子作用机制,作者首先使用生物信息学分析,预测miR-1253与FOXC2-AS1的3’UTR具有共同的结合位点,此外,两者的相互作用通过荧光素酶报告分析得到证实。Pearson相关分析表明,FOXC2-AS1表达与miR-1253表达呈负相关,而miR-1253表达与EZH2表达呈正相关。随后Western blot、CCK-8和集落形成实验证实,FOXC2-AS1/miR-1253/EZH2轴对前列腺癌细胞增殖和进展的重要调节功能。因此,作者推断FOXC2-AS1可通过作为miR-1253的竞争性内源性RNA来调节增殖和肿瘤生长,与EZH2蛋白互补结合,从而加速前列腺癌细胞的致癌作用。
2.4 FOXC2-AS1与乳腺癌乳腺癌是女性常见的癌症之一,属于复杂的异质性疾病。近年发现lncRNA在乳腺癌的发生、发展中起重要作用,其在肿瘤免疫逃逸的调控作用也备受关注[13-14]。Yang等[15]首先通过qPCR实验对56例乳腺癌组织和相应正常组织进行分析,发现FOXC2-AS1在乳腺癌组织中表达明显增加,且乳腺癌细胞系中FOXC2-AS1的表达明显高于正常人乳腺细胞系。研究发现FOXC2-AS1表达与乳腺癌分化程度、淋巴结转移、HER-2/neu状态和TNM分期显著相关,与患者年龄、肿瘤大小、ER以及PR表达无关。Kaplan-Meier生存分析显示,FOXC2-AS1高表达与乳腺癌患者的不良预后有关。采用特定的siRNA沉默内源性水平的FOXC2-AS1后,MTT实验结果显示沉默FOXC2-AS1明显降低相对细胞活力,细胞增殖被明显抑制。集落形成实验结果表明,转染sh-FOXC2-AS1可降低乳腺癌细胞的增殖能力。流式细胞分析结果显示,沉默FOXC2-AS1引起细胞周期停滞并诱导凋亡。此外,敲除FOXC2-AS1还导致乳腺癌细胞在G1期停滞并诱导细胞凋亡。为更深入地了解FOXC2-AS1对乳腺癌的影响,我们需要进一步分析其在乳腺癌中的具体分子作用机制。
2.5 FOXC2-AS1与结直肠癌Pan等[16]研究发现FOXC2-AS1在结直肠癌组织中表达上调。同时,转移的结直肠癌组织中FOXC2-AS1表达高于非转移的肿瘤组织,且FOXC2-AS1高表达与TNM分期和转移显著相关。qPCR检测结肠癌细胞系(HCT116、HT-29、SW620和LoVo)和正常结肠细胞系NCM460中FOXC2-AS1的内源性表达,FOXC2-AS1在肿瘤细胞系中表达明显上调,其中SW620和LoVo细胞系的表达高于HCT116和HT-29细胞系。因此,选择SW620和LoVo进行功能丧失试验。实验结果证实,通过转染FOXC2-AS1 siRNA-1和siRNA-2,FOXC2-AS1表达被有效抑制。MTT和克隆形成实验结果显示,FOXC2-AS1的减少显著阻碍细胞的增殖和生长。值得注意的是,敲除FOXC2-AS1明显抑制裸鼠皮下异种移植物的肿瘤体积、生长率和重量。划痕实验和Transwell实验结果亦表明敲除FOXC2-AS1明显损害结直肠癌细胞的迁移和侵袭。上述结果证实:FOXC2-AS1在体内外均可促进结直肠癌细胞的生长、侵袭和转移。此外,FOXC2-AS1可与相邻基因FOXC2形成双链体,正向调节并稳定FOXC2基因。回复试验及系列功能实验结果表明,FOXC2-AS1可通过增强FOXC2基因的稳定性,在体内外促进结直肠癌细胞的增殖、侵袭和转移。为进一步探讨FOXC2-AS1/FOXC2介导的结直肠癌进展的分子机制,对TCGA数据集中的GSEA进行分析,发现FOXC2表达与钙信号通路和局部粘连呈正相关。敲除FOXC2-AS1可降低细胞内FOXC2的表达水平,细胞内Ca2+水平也进一步降低,最后抑制黏着斑形成和FAK信号传导。该结果进一步表明,FOXC2-AS1通过激活Ca2+-FAK信号增强FOXC2基因的稳定性,以促进结直肠癌的增殖、迁移和侵袭,作者推测FOXC2-AS1可能是结直肠癌进展的潜在有效治疗靶点。
2.6 FOXC2-AS1与其他肿癌Xu等[17]的研究结果显示,转移或II~IV期黑色素瘤组织中FOXC2-AS1表达异常升高,且FOXC2-AS1高表达的黑色素瘤患者比低表达患者生存率更低。敲除FOXC2-AS1可抑制A375和sk-mel-110细胞的活力,并刺激其凋亡。此外,转染si-FOXC2-AS1的黑色素瘤细胞中p15水平上调,主要分布于细胞质。RNA-RIP法分析验证了FOXC2-AS1与EZH2和SUZ12的相互作用。ChIP法分析结果亦证实FOXC2-AS1通过募集EZH2调节p15转录的作用。实验进一步发现FOXC2-AS1/p15轴对黑色素瘤细胞活力和凋亡具有调节作用。刘伟等[18]的研究结果显示,FOXC2-AS1在弥漫大B细胞淋巴瘤组织中呈高表达,其可能与弥漫大B细胞淋巴瘤恶性增殖、侵袭、治疗、预后有关。因此,作者猜测FOXC2-AS1可能作为肿瘤癌基因,参与肿瘤的发生,但仍需深入分析FOXC2-AS1在肿瘤中的分子机制。
3 结语
非编码RNA在生命调控过程中扮演重要角色,其可与蛋白质、DNA、RNA相互作用并调控相关基因的表达,参与原癌基因活化调节、免疫细胞分化和免疫系统调控等一系列重要过程。越来越多的证据表明lncRNA起着癌基因或抑癌基因的作用,它们在正常情况下保持平衡[19-20]。目前,FOXC2-AS1的重点肿瘤研究领域局限于骨肉瘤、黑色素瘤、肺癌、前列腺癌及乳腺癌,在其他肿瘤中的研究仍在起步阶段,随着对FOXC2-AS1的不断深入探究,其有望为肿瘤的诊断和靶点治疗带来新进展。

