生防细菌TB17的筛选、鉴定及其对苦瓜枯萎病的生防作用
张涵,赵莹,仲荣荣,文才艺,孟颢光
(河南农业大学植物保护学院 ,河南 郑州 450002)
苦瓜枯萎病是由尖孢镰孢菌苦瓜专化型(Fusariumoxysporumf.sp.momordicae)侵染引起的一种土传病害,具有发病快、危害严重以及防治困难等特点[1]。随着近年来苦瓜种植面积不断扩大,连作现象普遍,导致病害的发生日趋频繁,严重影响苦瓜的产量和质量,成为苦瓜种植业的重要限制因素[2-3]。目前,生产上对苦瓜枯萎病的防治主要是以化学防治为主[4]。但是,由于苦瓜枯萎病是典型的土传维管束病害,常用的化学农药和防治方法难以达到理想的效果,生产上一般利用化学农药进行灌根或者土壤处理,长期使用容易造成环境污染、农药残留等农业生产和食品安全等问题[5-6]。生物防治是植物病害综合防治的重要措施之一,可通过有益微生物及其代谢产物调控植物微生态环境,直接或间接抑制植物病原菌生长繁殖等途径以达到控制植物病害的目的,具有自然资源丰富、环境兼容性良好和改善土壤微生态环境等优点[7-8]。近年来,利用拮抗细菌来防治植物枯萎病的研究越来越多。孙正祥等[9]发现,经枯草芽孢杆菌(Bacillussubtilis)YZU-S149处理后,可显著降低西瓜枯萎病的病情指数,防治效果为75.87%。许帅等[10]研究表明,贝莱斯芽孢杆菌(B.velezensis)ZF128可以显著促进马铃薯植株生长,控制马铃薯枯萎病的流行,防治效果为82.46%。郭康迪[11]从河南省土壤样品中分离获得一株绿针假单孢菌(Pseudomonascholoeaphtis),对苦瓜枯萎病具有良好的防治效果。本研究从河南省南阳桐柏山景区土壤样品中分离获得一株可用于苦瓜枯萎病菌生物防治的生防细菌,并对其分类鉴定、抑菌活性、促生和生防效果进行了系统的研究,以期为苦瓜枯萎病的生物防治提供更多优质的菌种资源。
1 材料与方法
1.1 试验材料
1.1.1 土壤样品 2019年9月,从河南省南阳桐柏山景区采集土壤样品,并将所得样品用自封袋封存于-20 ℃保存备用。
1.1.2 供试病原菌 试验所需的植物病原真菌包括苦瓜枯萎病菌(F.oxysporumf.sp.momordicae)、玉米大斑病菌(Setosphaeriaturcica)、苹果轮纹病菌(Botryosphaeriadothidea)、小麦全蚀病菌(Gaeumannnomycesgraminisvar.tritici)、小麦纹枯病菌(Rhizoctoniacerealis)、小麦赤霉病菌(F.graminearum)和小麦根腐病菌(Bipolarissorokiniana),由河南农业大学植物病害生物防治实验室分离保存。
1.1.3 供试培养基 试验所需培养基包括马铃薯葡萄糖琼脂(PDA)培养基、马铃薯葡萄糖(PDB)培养基、LB培养基。
1.1.4 供试苦瓜 试验所需苦瓜品种为“如玉33号”,购置于福建农科农业良种开发有限公司。
1.2 土壤细菌的分离、纯化
试验参考郭康迪[11]所述的方法对采集的土壤样品进行处理,利用无菌水对土壤样品进行梯度稀释后,分别吸取100 μL稀释度为10-4和10-5的土壤悬浮液涂布平板,各处理重复3次,将涂布后的平板置于28 ℃生化培养箱中倒置培养。培养1~2 d后,观察菌落生长情况,用接种环挑取形状、大小、颜色相异的单菌落在LB平板上划线分离、纯化,将纯化后的细菌分离物用25%甘油在-20 ℃保存备用[12]。
1.3 拮抗菌株的筛选
1.3.1 拮抗菌株的初筛 试验选择苦瓜枯萎病菌为靶标菌进行拮抗菌筛选,将靶标菌菌饼(d=5 mm)置于PDA平板中央,在距离菌饼约3 cm处划线接种不同的土壤细菌分离物,将接种后的培养皿在28 ℃生化培养箱中倒置培养,以仅接种靶标菌为空白对照。培养5~7 d后,观察并记录不同细菌分离物的抑菌效果。
1.3.2 拮抗菌株的复筛 将靶标菌菌饼(d=5 mm)接种于平板中央,在距离菌饼两边约3 cm处划线接种相同菌株,以仅接种靶标菌为空白对照,每个处理设置3个重复。7 d后,观察并记录不同细菌分离物的抑菌效果,从中挑出拮抗效果最佳的菌株进行下一步研究。
菌丝生长抑制率=(对照菌落半径-处理菌落半径)/对照菌落半径×100%
1.3.3 菌株TB17发酵滤液活性测定 菌株TB17的无菌发酵液制备参考习慧君等[12]的方法,振荡培养48 h后,发酵液在12 000 r·min-1条件下离心,上清液过滤后即为无菌发酵液。将无菌发酵液分别按1∶4和1∶9的体积比与PDA混合制作平板培养基,在平板培养基的中央接种苦瓜枯萎病菌菌饼(d=5 mm),以未添加发酵液的培养基为对照。培养5~7 d后,观察并记录不同处理的苦瓜枯萎病菌菌落生长情况,菌丝生长抑制率计算公式同1.3.2所述。
1.3.4 菌株TB17拮抗谱测定 试验方法同1.3.2,分别以玉米大斑病菌、苹果轮纹病菌、小麦全蚀病菌、小麦纹枯病菌、小麦赤霉病菌和小麦根腐病菌为靶标菌进行菌株TB17拮抗谱的测定。
1.4 拮抗菌株TB17对苦瓜促生效果测定
将菌株TB17接种于LB培养液中,在28 ℃、180 r·min-1的摇床上培养24 h后得到TB17发酵液(107cfu·mL-1)。待苦瓜幼苗长出2片真叶时,将制备好的TB17发酵液按每株10 mL进行灌根接种,以接种LB液体培养基为对照,处理后的苦瓜苗在28~30 ℃温室中培养,25 d后调查统计苦瓜株高、地上部分鲜质量、根长和根鲜质量等生理指标。
1.5 拮抗菌株TB17室内盆栽防效测定
将苦瓜种子催芽后在室温内播种,待苦瓜幼苗长出两片真叶时进行生防效果测定。菌株TB17发酵液的制备按1.4所述。试验设置处理组和对照组。处理组:将苦瓜幼苗置于浓度为107cfu·mL-1的苦瓜枯萎病菌孢子悬浮液中浸根处理30 min,定植后在苦瓜根部灌根接种60 mL的TB17发酵液;对照组:用相同浓度的苦瓜枯萎病菌孢子悬浮液浸根处理30 min,定植后以未接菌的液体发酵培养基进行灌根。所有处理后的苦瓜幼苗在28~30 ℃的温室中培养,试验重复3次,每次各处理5株。根据苦瓜枯萎病发病等级分级标准,计算并统计病情指数和防治效果[13]。
病情指数=Σ(病株数×相应级数)/总株数×最高级数×100%。
防治效果=(对照病情指数-处理病情指数)/对照病情指数×100%。
1.6 菌株TB17的分类鉴定
1.6.1 形态特征观察 将菌株TB17在LB平板上划线培养,待培养1~2 d后,观察记录菌落形态特征,然后挑取少许菌落进行革兰氏染色,观察菌体形态。
1.6.2 生理生化特征测定 试验参考《常见细菌系统鉴定手册》中描述的方法[14],测定菌株TB17的碳源、氮源利用情况、硝酸盐还原能力、分解淀粉、纤维素、有机磷和无机磷的能力、明胶液化和产嗜铁素的情况等。
1.6.3 16S rRNA基因序列分析 菌株TB17发酵液制备同1.4所述,试验利用Ezup柱式细菌基因组DNA抽提试剂盒进行菌株TB17 DNA提取,该试剂盒购自生工生物工程(上海)股份有限公司。PCR扩增引物为27F(5′-AGAGTTTGATCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′);反应体系(25 μL):2×Easy Taq Master Mix 12.5 μL,DNA模板1 μL,27F和1492R各1 μL,ddH2O补足25 μL;扩增程序为95 ℃ 5 min;95 ℃ 1 min,59 ℃ 30 s,72 ℃ 90 s,循环35次;72 ℃ 10 min。PCR扩增结束后,扩增产物经1%的琼脂糖凝胶电泳进行特异性检测,切胶回收后送往北京擎科生物科技有限公司测序。将得到的序列在NCBI数据库进行BLAST比对分析,挑选与其亲缘关系较近的序列构建Neighbor-joining系统进化树。
2 结果与分析
2.1 拮抗菌株的筛选
结果表明,试验从南阳桐柏山景区采集的样品中共分离获得34株细菌分离物,经初筛和复筛后获得一株对苦瓜枯萎病菌具有较强抑菌活性的拮抗菌株,编号为TB17,其对苦瓜枯萎病菌的菌丝生长抑制率为59.03%(图1)。
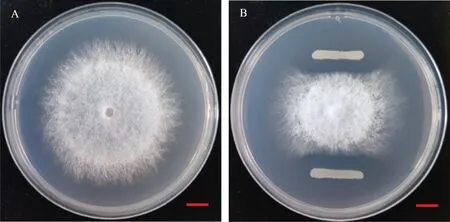
A:对照;B:菌株TB17和病原菌对峙培养。A:CK;B:Dual culture of strain TB17 and F.oxysporum f.sp.momordicae on PDA plate.图1 菌株TB17对苦瓜枯萎病菌的抑菌作用Fig.1 Inhibition effect of strain TB17 to F.oxysporum f.sp.momordicae
2.2 菌株TB17发酵液的抑菌活性
试验结果如图2所示,菌株TB17发酵滤液对苦瓜枯萎病菌的生长具有明显的抑制作用,其稀释5倍和10倍的发酵滤液对苦瓜枯萎病菌菌丝生长的抑制率分别为63.96%和54.95%。

A:对照;B:稀释5倍的发酵滤液;C:稀释10倍的发酵滤液。A:CK;B:Diluted fermentation filtrate by five-fold;C:Diluted fermentation filtrate by ten-fold.图2 菌株TB17发酵滤液对尖孢镰孢菌生长的抑制作用Fig.2 Inhibitory effect of fermentation filtrate of strain TB17 on the growth of F.oxysporum f.sp.momordicae
2.3 菌株TB17的抑菌谱
试验结果如图3所示,菌株TB17不仅对苦瓜枯萎病菌具有较强的拮抗效果,对供试的玉米大斑病菌、苹果轮纹病菌、小麦全蚀病菌等6株靶标病原真菌也具有一定的拮抗效果,表明该菌株具有广谱的抗植物病原真菌活性。

1:玉米大斑病菌;2:苹果轮纹病菌;3:小麦全蚀病菌;4:小麦纹枯病菌;5:小麦赤霉病菌;6:小麦根腐病菌。1:S.turcica;2:B.dothidea;3:G.graminis var.tritici;4:R.cerealis;5:F.graminearum;6:B.sorokiniana.图3 菌株TB17的拮抗谱Fig.3 Antagonistic spectrum of strain TB17
2.4 菌株TB17对苦瓜的促生作用
试验结果如表1所示,菌株TB17对苦瓜具有显著的促生作用。菌株TB17处理后,其株高和根长与对照组相比分别增加了32.33%和24.39%,地上部分鲜质量和根鲜质量分别增加了61.54%和122.76%。

表1 菌株TB17对苦瓜的促生作用Table 1 Plant growth promoting effect of strain TB17 on bitter gourd
2.5 菌株TB17对苦瓜枯萎病的盆栽生防效果
试验结果如图4所示,在苦瓜接种处理第14 d时,仅接种苦瓜枯萎病菌的对照组苦瓜出现叶脉发黄、整株萎蔫茎基部缢缩变褐、整株萎蔫甚至枯死等症状,平均病情指数高达86.67;经菌株TB17处理后,苦瓜的平均病情指数为20,显著降于对照组,防治效果为76.92%。

图4 菌株TB17的盆栽生防效果Fig.4 Biocontrol effect of strainTB17 in pot experiments
2.6 菌株TB17的分类鉴定结果
2.6.1 菌株TB17形态学特征 在LB培养基上观察到的菌株TB17形态特征如图5-a所示,菌落形态呈不规则状,淡黄色,不透明,有光泽;试验对菌株TB17进行革兰氏染色,结果如图5-b(放大400倍),菌株TB17革兰氏染色后呈阳性,在显微镜下呈杆状。

a:菌株TB17的菌落形态;b:菌株TB17的革兰氏染色。a:Colony morphology of strain TB17;b:Gram staining of strain TB17.图5 菌株TB17的形态特征Fig.5 Morphological characteristics of strain TB17
2.6.2 菌株TB17的生理生化特征 生防菌株TB17的生理生化测定结果如表2所示,菌株TB17可以利用蔗糖、葡萄糖、半乳糖、麦芽糖和甘露醇为碳源,可利用精氨酸为氮源,分解有机磷、无机磷,还原硝酸盐以及产H2S等。

表2 菌株TB17的生理特征测定结果Table 2 Physiological and biochemical characteristics of strain TB17
2.6.3 菌株TB17的分子生物学鉴定 PCR产物的电泳结果如图6所示,菌株TB17的16S rRNA基因序列长度为1 430 bp(GenBank登录号:MZ950653),NCBI比对分析结果表明,菌株TB17与短短芽孢杆菌B.brevis(HQ317191)的亲缘关系最近,其同源性达到99.79%。结合形态学、生理生化特征,将菌株TB17鉴定为短短芽孢杆菌(如图7)。

泳道1:16S rRNA基因片段;泳道2:阴性对照;泳道M:DL2000 Marker。 Lane 1:16S rRNA gene fragment;Lane 2:Negative control;Lane M:DNA marker DL2000.图6 菌株TB17的16S rRNA基因PCR扩增结果 Fig.6 PCR amplification of 16S rRNA gene from strain TB17
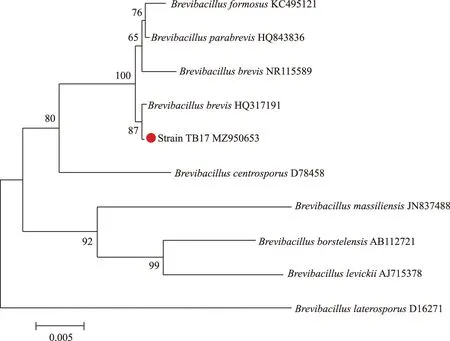
图7 基于16S rRNA基因序列构建的Neighbor-joining系统进化树Fig.7 Neighbor-joining phylogenetic tree of strain TB17 based on 16S rRNA gene sequences
3 讨论
近年来,生防微生物及其制剂因具有安全、无污染和环境兼容性良好等优点而广泛应用于植物病害生物防治[15-16]。目前研究并应用较多的生防细菌主要有芽孢杆菌属(Bacillus)[17],如枯草芽孢杆菌(B.subtilis)[18]、贝莱斯芽孢杆菌(B.velezensis)[19]和解淀粉芽孢杆菌(B.amyloliquefaciens)[20]等。虽然土壤是生防细菌分离的主要来源,但随着大量生防菌资源的不断挖掘,从一般的土壤生境中筛选获得微生物新物种越来越困难。因此,越来越多的学者开始从湿地[21]、赤泥地[22]和高寒草地[23]
等特殊土壤生境进行微生物资源挖掘。河南省南阳桐柏山地处暖温带向亚热带过渡的地区,拥有完整的过渡带森林生态系统和良好的自然生态[24],是发掘新型微生物资源的适宜生境。我们从河南省南阳桐柏山景区的山地土壤样品分离出34株具有拮抗活性的细菌纯培养,经初筛和复筛后,获得1株对苦瓜枯萎病菌具有稳定拮抗活性的生防菌株TB17,并将其鉴定为短短芽孢杆菌。该菌株对苦瓜枯萎病的盆栽防治效果达76.92%,同时可以有效促进苦瓜的生长,具有研发防治苦瓜枯萎病微生物菌剂的潜力。
研究表明,短短芽孢杆菌作为一种具有广谱抗真菌活性的生防微生物,在其生长代谢过程中能够产生不同的抗菌活性物质来抑制病原菌的正常生长,进而达到控制病害的目的[25-28]。王洁等[29]从短短芽孢杆菌发酵液中分离纯化获得一种相对分子量为32 kD的鞭毛蛋白,对小麦赤霉病菌和番茄灰霉病菌等具有显著抑菌效果;WAFAAG[30]从草莓植株叶际分离得到一株抗草莓灰霉病的短短芽孢杆菌,其产生的活性物质短杆菌肽S(gramicidin S)可显著降低草莓灰霉病的发生。本研究中,我们发现菌株TB17的发酵液对苦瓜枯萎病菌的菌丝生长表现出明显的抑制作用,表明菌株TB17可以产生抗植物病原真菌的抑菌活性物质,有关拮抗活性物质的分离纯化以及活性物质对苦瓜枯萎病菌的抑制作用机制等问题尚有待于进一步深入研究。此外,在测定短短芽孢杆菌TB17的生防效果的同时,发现该菌株对苦瓜植株的促生效果显著,该试验结果是否与菌株TB17具有解磷作用和产嗜铁素的功能有直接关系还有待于进一步研究。

