miR-139-5p靶向SLC39A7基因通过Wnt/β-catenin信号抑制肾癌细胞周期和增殖
石涛 高艳 凡磊 周本正 丁志勇 张大虎
(湖北医药学院附属襄阳医院 (襄阳市第一人民医院) 1泌尿外科,湖北 襄阳 441000;2综合内科)
肾癌(RC)是常见的泌尿系统恶性肿瘤,占成人恶性肿瘤的2%~3%,Ⅲ期RC患者5年平均生存率为53%,转移性RC患者5年平均生存率为8%〔1〕。肾切除术是局部肾癌的重要干预措施,但对于术后复发或有转移的患者主要采用个性化靶向治疗〔2〕。
研究表明,Micro RNA(miRNA)参与RC的转移和进展,并与患者早期转移的侵袭性肿瘤特征相关,可能是患者预后和疾病进展的标志物〔3〕。肾透明细胞癌中,miR-139-5p低表达,并与患者高复发风险相关〔4〕。本研究通过StarBase预测发现,miR-139-5p与SLC39A7可能存在靶向关系。SLC39A7在前列腺癌细胞中高表达,miR-15a-3p下调SLC39A7通过Wnt/β-catenin信号通路抑制癌细胞的增殖和侵袭〔5〕。在宫颈癌〔6〕和结肠癌〔7〕中敲减SLC39A7可抑制癌细胞增殖、迁移、侵袭或诱导细胞凋亡。SLC39A7在RC中表达和作用尚不清楚。根据预测结果和上述研究结果,本研究以RC细胞系为主要研究对象,假设miR-139-5p靶向SLC39A7基因通过Wnt/β-catenin信号通路调节RC细胞周期和增殖,并对其进行验证。以期为RC的治疗提供新的靶点。
1 材料与方法
1.1材料 人正常肾小管上皮细胞HK-2及RC细胞系A498、786-O和SN12C-PM6购自美国ATCC;RPMI1640培养基、DMEM高糖培养基和胎牛血清(FBS)购自美国Gibco公司;胰蛋白酶购自Sigma-Aldrich公司;细胞培养板购自美国Corning公司;CCK-8试剂盒和细胞周期检测试剂盒购自上海碧云天生物技术有限公司;引物、miR-139-5p模拟物(miR-139-5p)、miR-139-5p抑制剂(anti-miR-139-5p)、SLC39A7过表达载体(pcDNA-SLC39A7)、SLC39A7抑制剂(si-SLC39A7)和对照(miR-con、anti-miR-con、si-con和pcDNA-con)及SLC39A7野生型和突变型双荧光载体购自上海吉玛制药有限公司;SLC39A7抗体、细胞周期蛋白(Cyclin)D1抗体、CyclinE抗体、β-catenin抗体和β-actin抗体购自美国Abcam;双荧光素酶报告系统购自美国Promega公司;Lipofectamine 2000转染试剂、总RNA提取试剂盒、实时荧光定量-聚合酶链反应(qRT-PCR)试剂盒、反转录试剂盒购自美国Invitrogen公司;流式细胞仪购自美国BD公司;光学显微镜、全自动酶标仪、发光仪和qRT-PCR仪购自美国Bio-Rad公司。
1.2方法
1.2.1细胞培养 在DMEM高糖培养液中培养人正常肾小管上皮细胞HK-2,在RPMI1640培养液中分别培养RC细胞A498、786-O和SN12C-PM6,培养液中均含10%FBS、100 U/ml青霉素和100 μg/ml链霉素,培养条件:在湿度95%,37℃ 5%CO2培养箱中培养细胞,消化传代。
1.2.2细胞转染 将786-O细胞培养至对数生长期,收集细胞,胰蛋白酶消化,以1×106个/ml接种于6孔板培养,当细胞融合度达到90%时根据Lipofectamine 2000转染试剂说明书进行转染。转染分组:miR-139-5p高表达组(转染miR-con和miR-139-5p);SLC39A7敲减组(转染si-con和si-SLC39A7);miR-139-5p抑制组(转染anti-miR-con和anti-miR-139-5p);miR-139-5p和SLC39A7高表达组(转染miR-139-5p+pcDNA-con和miR-139-5p+pcDNA-SLC39A7);SLC39A7突变型(MUT,转染miR-con+MUT、miR-139-5p+MUT)和野生型(WT,转染miR-con+WT、miR-139-5p+WT)双荧光素酶报告载体组。将载体转染培养好的786-O细胞,转染48 h,收集细胞,验证转染,进行后续实验。
1.2.3qRT-PCR检测RNA的表达 用Trizol试剂从HK-2、A498、786-O和SN12C-PM6细胞中提取总RNA,然后反转录合成cDNA并检测,然后以cDNA 为模板,按照qRT-PCR试剂盒说明书进行反应,合成miR-139-5p和SLC39A7 mRNA,反应程序为:95℃ 1 min;95℃ 30 s、59℃ 40 s、72℃ 45 s,40个循环;72℃ 5 min。运用2-ΔΔCt法进行数据分析。
1.2.4CCK-8实验测定细胞存活率 将转染后的786-O培养至对数生长期,胰蛋白酶消化细胞,培养基重悬并稀释细胞,以浓度2×103个细胞/孔(200 μl细胞)接种于96孔板,NC组加入未转染的786-O细胞,加入20 μl CCK-8溶液,培养4 h,酶标仪检测450 nm处的吸光度(A)值。细胞存活率=实验组A值/对照组A值×100%。
1.2.5流式细胞术检测细胞周期 将转染后的786-O培养至对数生长期,用胰蛋白消化细胞,收集细胞,清洗细胞,用70%冷乙醇固定细胞4℃过夜,离心收集细胞,加入500 μl配制好的碘化丙啶(PI)染色液,37℃避光孵育30 min,然后上流式细胞仪488 nm波长处检测红色荧光,计算各组G0/G1期、S期、G2/M期细胞百分比。
1.2.6Western印迹 收集各组转染的786-O细胞,室温用放射免疫沉淀试验(RIPA)裂解液裂解细胞30 min,超声破碎细胞,收集蛋白,检测蛋白浓度。将蛋白样本进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转聚偏氟乙烯(PVDF)膜,脱脂奶粉室温封闭2 h,分别加入一抗,SLC39A7抗体(1∶1 000)、CyclinD1抗体(1∶3 000)、CyclinE抗体(1∶1 500)、β-catenin抗体(1∶6 000)和抗β-actin抗体(1∶2 000),4℃孵育过夜。洗膜3次,然后加入稀释的辣根过氧化物酶标二抗,室温孵育2 h。以β-actin为内参照,分析蛋白水平。
1.2.7双荧光素酶报告系统实验 根据1.2.2方法培养786-O至细胞融和度为90%,进行转染,将构建SLC39A7的WT和MUT双荧光素酶报告载体,分别与miR-con或miR-139-5p共转染786-O细胞,转染48 h,收集细胞,裂解细胞,离心收集上清,-20℃保存或直接检测荧光素酶活性。以海肾荧光素酶活性为内参,计算相对萤火虫荧光素酶活性。
1.3统计学方法 采用SPSS17.0软件进行t检验、单因素方差分析。
2 结 果
2.1RC细胞系SLC39A7和miR-139-5p水平 与正常肾小管上皮细胞HK-2组相比,RC细胞系A498、786-O和SN12C-PM6组细胞中SLC39A7的mRNA和蛋白表达量均显著上升(P<0.05),miR-139-5p表达量均显著下降(P<0.05),见图1和表1。SLC39A7和miR-139-5p在A498、786-O和SN12C-PM6肾癌细胞系中表达情况一致,采用786-O进行后续实验。

图1 Western印迹检测SLC39A7表达

表1 RC细胞系miR-139-5p和SLC39A7 水平
2.2高表达miR-139-5p抑制RC细胞786-O细胞周期和增殖 与NC组和miR-con组相比,miR-139-5p组miR-139-5p表达量显著上升(P<0.05),细胞存活率显著降低(P<0.05),CyclinD1和CyclinE表达量均显著降低(P<0.05),G0/G1期和G2/M期细胞百分比显著升高(P<0.05),S期细胞百分比显著降低(P<0.05),见图2和表2。说明过表达miR-139-5p可降低RC 786-O细胞的存活率,抑制细胞周期。
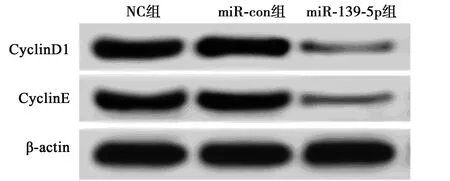
图2 Western印迹检测CyclinD1和CyclinE蛋白

表2 高表达miR-139-5p抑制RC细胞786-O细胞周期和增殖
2.3敲减SLC39A7抑制RC细胞786-O细胞周期和增殖 与NC组和si-con组相比,si-SLC39A7组786-O细胞中SLC39A7、CyclinD1和CyclinE表达量显著下降(P<0.05),细胞存活率显著降低(P<0.05),G0/G1期和G2/M期细胞百分比显著升高(P<0.05),S期细胞百分比显著降低(P<0.05),见表3和图3。说明敲减SLC39A7表达可抑制RC 786-O细胞周期和增殖。
2.4miR-139-5p靶向调控SLC39A7的表达 StarBase预测结果显示,SLC39A7的3′UTR序列中含有与miR-139-5p互补的核苷酸序列。见图4A。构建含有miR-139-5p结合位点的SLC39A7-3′UTR WT及MUT报告基因载体,在786-O细胞中转染miR-139-5p mimics和SLC39A7 WT及MUT报告基因载体,结果如表4所示,与miR-con组相比,miR-139-5p组WT-SLC39A7的萤火虫荧光素酶相对活性显著下降(P<0.05);而MUT-SLC39A7的荧光素酶相对活性无明显变化(P>0.05)。Western印迹结果发现,与miR-con组SLC39A7蛋白表达量(0.80±0.09)相比,过表达miR-139-5p组(0.36±0.04)显著下降(P<0.05);与anti-miR-con组SLC39A7表达量(0.81±0.10)相比,anti-miR-139-5p表达组(1.10±0.15)显著上升(P<0.05)。见图4B。说明miR-139-5p靶向负向调控SLC39A7的表达。

表3 敲减SLC39A7抑制肾癌细胞786-O细胞周期和增殖
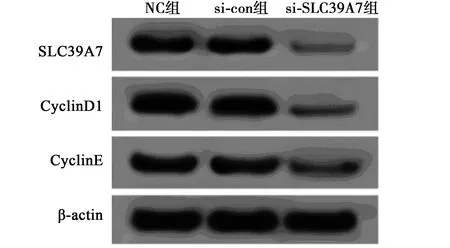
图3 Western印迹检测SLC39A7、 CyclinD1、CyclinE蛋白表达

1~4:miR-con组,miR-139-5p组,anti-miR-con组,anti-miR-139-5p组图4 miR-139-5p靶向调控SLC39A7表达

表4 双荧光素酶活性检测
2.5高表达SLC39A7可部分逆转miR-139-5p对786-O细胞周期和增殖的影响 与miR-con组SLC39A7水平(0.82±0.13)相比,过表达miR-139-5p可抑制786-O细胞中SLC39A7表达(0.35±0.05,P<0.05)。与miR-139-5p+pcDNA-con组相比,miR-139-5p+pcDNA-SLC39A7组的SLC39A7、CyclinD1和CyclinE表达量显著升高(P<0.05),细胞存活率显著升高(P<0.05),G0/G1期和G2/M期细胞百分比显著降低(P<0.05),S期细胞百分比显著升高(P<0.05),见图5和表5。说明过表达SLC39A7部分逆转了上调miR-139-5p表达对786-O细胞周期和增殖的影响。

1~4:miR-con组,miR-139-5p组,miR-139-5p+pcDNA-con组,miR-139-5p+pcDNA-SLC39A7组图5 Western印迹检测SLC39A7、 CyclinD1和CyclinE蛋白
2.6Wnt/β-catenin信号通路相关蛋白的表达 与miR-con组786-O细胞中β-catenin表达水平(1.00±0.12)相比,过表达miR-139-5p组(0.45±0.05)显著降低(P<0.05);与miR-139-5p+pcDNA-con组786-O细胞中β-catenin表达水平(0.40±0.07)相比,miR-139-5p+pcDNA-SLC39A7组(0.86±0.09)显著升高(P<0.05),见图6。说明过表达miR-139-5p可抑制Wnt/β-catenin信号通路,而过表达SLC39A7可激活Wnt/β-catenin信号通路并部分逆转上调miR-139-5p表达对786-O细胞周期和增殖的影响。

表5 高表达SLC39A7可部分逆转miR-139-5p对786-O细胞周期和增殖的影响

1~4:miR-con组,miR-139-5p组,miR-139-5p+pcDNA-con组,miR-139-5p+pcDNA-SLC39A7组图6 Western印迹检测β-catenin蛋白
3 讨 论
RC是一种多基因突变的复杂疾病,尽管酪氨酸激酶抑制剂(TKIs)是晚期RC的主要一线治疗选择,但最终所有患者都将对TKIs产生耐药性〔8〕。发现新的抑制靶点,对RC的个性化靶向治疗至关重要。miR-139-5p在多种癌症包括乳腺癌、胃癌、子宫内膜浆膜腺癌、膀胱癌、卵巢癌、食管鳞状细胞癌(ESCC)、甲状腺癌、胶质母细胞瘤等中均出现差异表达,在肿瘤发生、转移和复发中起着重要作用,提示它可能作为一种肿瘤诊断、预后和治疗的生物标志物〔9〕。在口腔鳞状细胞癌(OSCC)中,miR-139-5p表达下调〔10〕。miR-139-5p在肝癌细胞中也表达下调,抑制其表达可促进肝癌细胞的增殖〔11〕。miR-139-5p在转移性RC中表达下调,与miR-10b、miR-130b、和miR-199b-5p一起可作为RC标志物〔12〕。本研究结果表明,miR-139-5p在RC发展中具有重要作用。SLC39A7又称ZIP7,是锌转运蛋白溶质载体39家族第7成员,在细胞生物过程中控制锌的转运,SLC39A7定位在锌介导的酪氨酸激酶信号传导的关键节点上,从内质网释放锌,可能是酪氨酸激酶激活所必需的〔13〕,SLC39A7可能通过丝裂原活化蛋白激酶(MAPK)、雷帕霉素靶蛋白(mTOR)和磷脂酰肌醇-3-激酶(PI3K)-AKT等途径发挥作用,这些途径参与细胞存活和增殖,并且在癌症中经常被过度激活〔14〕。研究表明,SLC39家族中的14个基因包括SLC39A7在胃癌组织中均显著上调,SLC39A7与患者总生存率显著相关〔15〕。SLC39A7在结直肠癌中表达上调,主要是为了满足癌细胞对锌的需求〔16〕。SLC39A7在前列腺癌中也表达上调,下调其Wnt/β-Catenin信号通路抑制癌细胞的增殖和侵袭〔5〕。SLC39A7在RC中的表达尚不清楚。本研究结果说明SLC39A7在RC细胞的增殖中具有重要作用。Wnt/β-catenin信号通路是一种进化上保守的发育信号事件,在调节组织发育和维持体内平衡中起着关键作用,Wnt/β-catenin通路失调与癌症、肾脏疾病、神经退行性疾病和骨疾病等多种疾病的发病机制密切相关〔17〕。在人RC中,不同Wnt、Wnt受体(Fzds)和Wnt拮抗剂和β-catenin出现异常表达,Wnt受体Fzd5和Fzd8的mRNA水平升高,导致下游靶基因CyclinD1增加,胞质β-catenin高水平与患者具有肿瘤直径大、晚期和血管侵犯等特点相关〔18〕。综上,本研究阐述了在RC 786-O细胞中,miR-139-5p靶向SLC39A7可能通过Wnt/β-catenin信号通路调控RC细胞周期和增殖。miR-139-5p可能是RC的潜在分子靶点。

