自体脂肪间充质干细胞对带状疱疹大鼠JNK、PI3K、NGF表达及后遗疼痛的影响
张书力 冯丹 (武汉市第一医院疼痛科,湖北 武汉 430022)
带状疱疹(HZ)是神经系统中水痘-带状疱疹病毒侵犯皮肤及神经所致,可引起受累神经根支配的皮肤区域疱疹,同时可伴有疼痛〔1〕。带状疱疹后神经痛(PHN)可引起患者视觉、听觉等其他神经系统并发症,并导致患者失明、耳聋、面瘫、脏器功能异常,甚至死亡〔2,3〕。PHN属于神经病理性疼痛(NP),而背根神经节已成为NP的发病机制及其治疗重点〔4〕。PHN好发于老年人,但目前临床上的药物治疗、神经介入治疗及神经调控治疗等方法,治愈率效果不好,且患者疼痛长期难以控制〔5〕。近年,干细胞移植被用于多种NP的治疗〔6〕,取自骨髓、脂肪等组织的脂肪间充质干细胞(ASCs),具有高度增殖和自我更新能力〔7,8〕,能分泌生物活性因子,刺激患者体内残留的特异性干细胞再生,进而发挥治疗作用〔9〕。ASCs可为许多疾病提供新的治疗方案,已成为临床研究的热点,但其对PHN的治疗作用却鲜见报道。神经生长因子(NGF)广泛分布于神经系统和非神经系统中,能介导c-Jun氨基末端激酶(JNK)及磷脂酰肌醇-3激酶(PI3K)途径调控神经和轴突生长、凋亡和再生,并能调节免疫系统功能,促进皮肤成纤维细胞修复〔10〕。目前研究发现NGF注射可用于治疗PHN〔11〕,但具体分子生物学机制不甚明确。本研究结果探究ASCs对PHN大鼠疼痛及NGF、JNK、PI3K蛋白表达的影响。
1 材料和方法
1.1实验材料
1.1.1动物 清洁级同遗传背景SD雌性大鼠50 只,体重 200~220 g,由北京维通利华实验动物技术有限公司提供,许可证号为SYXK(京)2012-0001。分笼饲养于南京中医药大学实验动物中心,饲养条件:光照和黑暗各12 h交替进行,自由饮食、饮水,温度22~25℃,相对湿度40%~70%,噪音低于80 dB,保持动物房环境及鼠笼清洁、透气。
1.1.2主要试剂及仪器 CV-1非洲绿猴肾母纤维细胞(货号:XB-1192,购自上海奥陆生物科技有限公司)、肿瘤坏死因子(TNF)-α酶联免疫吸附试验(ELISA)试剂盒(货号:HT019,购自上海歌凡生物科技有限公司)、白细胞介素(IL)-1β ELISA试剂盒〔货号:JK-(a)-4956,购自上海晶抗生物工程有限公司〕、苏木素-伊红(HE)染色试剂盒(货号E677218-0200,购自上海生物公司)、mNGF抗体(货号:ab32888)、PI3K抗体(货号:ab139307)、蛋白激酶B(Akt)抗体(货号:ab/18785)、磷酸化(p)-Akt抗体(货号:ab38449)、T酪氨酸激酶受体(TrkA)抗体(货号:ab216626)、TNF受体p75(p75NTR)抗体(货号:ab25958)、JNK抗体(货号:ab4821)、p-JNK抗体(货号:ab47337)、蛋白提取试剂盒(批号:NXTRACT-1KT,购自西格玛Sigma-Aldrich公司)、二喹啉甲酸(BCA)试剂盒(货号:P0027,购自上海碧云天公司)。触觉测痛仪(型号:Von Frey Filament,购自Stoeling公司)、手动轮转式切片机(型号RM2125RTS,购自德国Leica公司)、光学显微镜(型号SMZ745,购自日本尼康公司)、蛋白电泳仪、半干转膜仪(型号1659001、Trans-Blot SD,购自美国Bio-Rad公司)、凝胶成像仪(型号:GIS-500,购自Miulab公司)等。
1.2方法
1.2.1大鼠自体ASCs的分离、培养、鉴定、诱导 参照文献〔12〕在无菌条件下,取SD大鼠腹股沟皮下脂肪组织少许,用无菌磷酸盐缓冲液(PBS)洗净残留血液并去除血管|后,用0.1% Ⅰ型胶原酶在37℃条件下消化1 h,再加入含10%胎牛血清(FBS)的DMEM培养液终止消化后,将消化液经孔径为100 μm和25 μm的尼龙膜过滤2次除去未消化的组织,离心收集细胞后。加入含10%FBS的DMEM培养液重悬细胞,置于37℃,5%CO2孵箱中培养24 h。72 h后移除悬浮细胞,待贴壁细胞生长融合至80%~90%时进行传代和纯化。取第3代ASCs加入异硫氰酸荧光素(FITC)-CD34抗体、FITC-CD45抗体、PE-CD29 抗体、FITC-CD90抗体和同型阴性对照鼠单克隆抗体振荡混匀,4℃避光孵育30 min。PBS洗涤后离心弃上清,加入200 μl含0.1%多聚甲醛的PBS溶液混匀固定,经流式细胞仪检测表型抗原。参照文献〔13〕取第3代ASCs分别加入成骨细胞和成脂细胞诱导培养基进行培养,待细胞分化稳定后经油红O染色观察脂质空泡,经茜素红染色鉴定钙结节。细胞传代培养14 d,每只大鼠可获得约4×106个ASCs,用生理盐水配制成1×106个/500 μl、2×106个/500 μl、4×106个/500 μl ASCs溶液。大鼠腹股沟缝合后1 w,伤口愈合,可用作后期试验。
1.2.2大鼠PHN模型建立及分组给药 参照文献〔12〕复制水痘带状疱疹病毒(VZV)和构建大鼠PHN模型,具体操作如下:DMEM/F12完全培养基培养非洲绿猴肾母纤维细胞(CV-1),并将悬浮细胞按照5×104个/cm2的细胞数接种于培养瓶,加入VZV感染CV-1细胞2 d(约有80%细胞发生感染),收集上述细胞,加入生理盐水重悬,即是病毒接种液。取1.2.1中50只SD大鼠,于左趾蹼注射50 μl病毒溶液,感染3 d后,大鼠出现机械痛敏阈值异常可判定制模成功。将造模成功的40只大鼠随机分为模型(PHN)组、ASCs〔13〕低(1×106个)、中(2×106个)、高(4×106个)剂量组;另取10只1.2.1中大鼠,于左趾蹼注射生理盐水作为空白对照(Control)组。造模成功后,参照文献〔14〕进行鞘内插管给药,插入管末端位于椎管L2节段,即脊髓L4~6节段,ASCs各组给予相应浓度的ASCs溶液500 μl,Control组和PHN组给予等剂量生理盐水500 μl,给药完成后轻轻取出插管,缝合肌肉和皮肤,苏醒后回笼正常饲养。
1.2.3各组大鼠机械缩足痛敏阈值(PWT)检测 各组大鼠行插管给药2 w后,参照文献〔15〕采用触觉测痛仪测定各组大鼠PWT。大鼠单次刺激时间≤1 s,每次刺激间隔10 s,当大鼠出现抬足或舔足行为或躲避时记录刺激强度,去掉最大及最小值,测定5次取平均值即为PWT。
1.2.4大鼠标本采集 测定完PWT后,3%戊巴比妥钠麻醉处死各组大鼠,立即切开背部皮肤组织及腰背筋膜,沿棘突两侧剥离骸棘肌并向两侧推开,放入自动牵开器撑开两侧肌肉组织,露双侧L4、L5、L6椎板,咬除L4、L5、L6棘突、椎板,关节突和部分椎弓根,小心显露双侧L4、L5、L6神经根及神经节,剪取0.5 g,匀浆后离心,取上清液于-20℃冰箱保存备用。迅速将剩余神经置于4%多聚甲醛中固定24 h。在鼠尾近段纵行切开皮肤、皮下组织至尾椎骨面,向两侧分离显露2个椎间盘,横向切开纤维环取出髓核组织,置于-80℃冰箱保存备用。
1.2.5各组大鼠背根神经节HE染色病理检查 取1.2.4中4%多聚甲醛中固定24 h后的L4、L5、L6神经根及神经节,进行常规透明、浸蜡、包埋后、切成厚度为5 μm的切片。按HE试剂盒说明书进行染色,置于显微镜下观察神经节神经细胞形态变化。
1.2.6各组大鼠髓核组织炎症因子TNF-α、IL-1β含量测定 取1.2.4中-80℃冰箱中冻存的髓核组织,制备匀浆,离心分离后,取匀浆上清液,按ELISA试剂盒说明书方法,分别检测组织TNF-α、IL-1β含量。
1.2.7Western印迹检测神经节组织mNGF、PI3K、Akt、p-Akt、TrkA、p75NTR、JNK、p-JNK、Caspase-3蛋白表达 取1.2.4中-20℃保存的组织匀浆液,于4℃冰箱中解冻后,取上清液,用轴蛋白试剂盒提取蛋白,BCA试剂盒说明书检测蛋白浓度后,取50 μg蛋白上样,进行电泳和转膜反应,TBST溶液清洗后,加入5%脱脂牛奶室温下封闭1 h,TBST溶液清洗3次后,加入一抗〔mNGF、PI3K、Akt、p-Akt、TrkA、p75NTR、JNK、p-JNK、Caspase-3、β-actin(内参)抗体,稀释倍数分别为1∶1 000,1∶1 000,1∶1 000,1∶1 000,1∶1 000,1∶1 000,1∶1 000,1∶1 000,1∶1 000,1∶2 000〕,4℃摇床室温孵育过夜,TBST振洗后加入辣根过氧化物酶(HRP)羊抗兔二抗(稀释倍数1∶2 000),37℃摇床室温孵育1 h,TBST清洗3次后,采用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以ImageJ软件分析各组蛋白相对表达。
1.3统计学分析 采用SPSS22.0软件进行方差分析,进一步两组间比较行SNK-q检验。
2 结 果
2.1大鼠自体ASCs体外培养、鉴定结果 体外培养的第3代大鼠ASCs形态均一、贴壁、呈成长梭行。经流式细胞仪检测,CD90和CD29表达均>95%,CD34和CD45表达呈阴性。体外成脂诱导液培养后,细胞能分化为成脂肪细胞,且红油O染色显示成脂质空泡阳性。体外成骨诱导液培养后,细胞能分化为成骨细胞,且茜素红染色显示有钙结节。见图1。
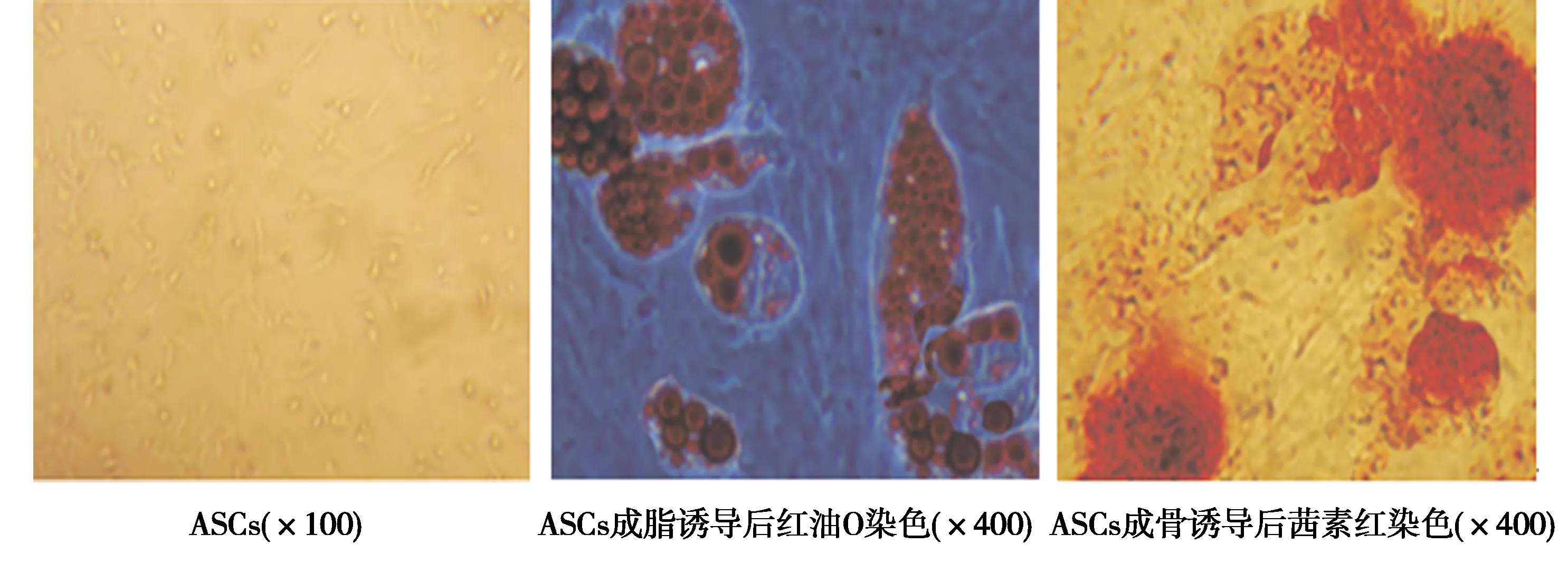
图1 大鼠ASCs体外培养、鉴定结果
2.2大鼠背根神经节HE染色结果 Control组大鼠背根神经节内神经元细胞形态完整,核仁清晰,分布均匀。与Control组相比,PHN组大鼠背根神经节内神经元细胞形态和大小不一、边界不清,可见细胞变形、溶解、坏死等病理损伤。与PHN组相比,ASCs低、中、高剂量组大鼠背根神经节病理损伤逐渐减轻,见图2。
2.3各组大鼠PWT检测结果 与Control组〔(42.56±4.25)s〕相比,PHN组PWT降低〔(16.86±2.93)s,P<0.05〕;与PHN组相比,ASCs低、中、高剂量组PWT依次明显增高〔(22.35±2.76)s、(29.26±2.82)s、(35.22±2.65)s,均P<0.05〕。

图2 各组背根神经节HE染色结果(×200)
2.4各组髓核组织炎症因子TNF-α、IL-1β含量检测结果 与Control组相比,PHN组、ASCs低、中、高剂量组髓核组织TNF-α、IL-1β含量升高(均P<0.05);与PHN组相比,ASCs低、中、高剂量组大鼠髓核组织炎症因子TNF-α、IL-1β含量依次明显降低(均P<0.05),见表1。
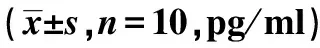
表1 各组髓核组织TNF-α、 IL-1β含量比较
2.5各组背根神经节组织mNGF、PI3K、Akt、p-Akt、TrkA、p75NTR、JNK、p-JNK、Caspase-3蛋白表达 与Control组,PHN组、ASCs低、中、高剂量组背根神经节组织mNGF、PI3K、p-Akt、TrkA p75NTR、p-JNK蛋白表达显著降低,Caspase-3蛋白表达明显升高(均P<0.05);与PHN组相比,ASCs低、中、高剂量组mNGF、PI3K、p-Akt、TrkA p75NTR、p-JNK蛋白表达依次明显升高,Caspase蛋白表达依次明显降低(均P<0.05)。见图3,表2。

1~5:Control组,PHN组,ASCs低剂量组,ASCs中剂量组,ASCs高剂量组图3 Western印迹检测各组mNGF、PI3K、Akt、p-Akt、 TrkA、p75NTR、JNK、p-JNK、Caspase-3蛋白表达
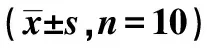
表2 大鼠背根神经节组织mNGF、PI3K、Akt、p-Akt、TrkA蛋白表达比较
3 讨 论
PHN可持续数周、数月甚至数年,导致患者出现情感障碍、焦虑、抑郁等,严重影响患者的生活质量〔4〕。皮损区的异常疼痛及痛觉过敏为PHN的主要表现,接种疱疹病毒,可造成外周神经纤维坏死,神经支配区皮肤出现疱疹和炎症反应,感觉神经节出现炎症、出血性坏死及神经元坏死或缺失〔16〕。钱黎等〔17〕用疱疹病毒复制大鼠PHN模型,发现大鼠存在严重的痛觉过敏,PWT减少;马洪涛等〔15〕通过接种VZV复制PHN模型,发现大鼠在接种后7 d痛觉达到高峰,并能持续14 d,脊髓炎症因子TNF-α、IL-1β等释放增加。本研究提示PHN模型大鼠出现痛觉过敏、炎症反应和背根神经节神经细胞坏死,表明造模成功。
PHN属于NP一种,当人体免疫力下降时,病毒在背根神经节内繁殖,引起感觉神经元受损,导致炎症介质释放,伤害感受器敏化,自发性疼痛增加,而随着病情增加,神经纤维持续性异常放电,最终形成PHN。干细胞移植可被用于多种NP的治疗,且自体ASCs移植具有安全性及有效性〔18〕。Elchim等〔19〕采用鞘内注射异体脐带干细胞方法治疗,可显著降低脊髓外伤诱发NP男性患者疼痛程度,改善运动功能及自主神经功能;Vickers等〔20〕将ASCs注入10位难治性三叉神经痛女性患者病变的三叉神经周围,发现半年内患者疼痛程度均显著降低,镇痛药物需求量显著减少;Franchi等〔21〕发现注射神经干细胞,可明显减轻神经损伤模型大鼠诱发痛及热痛觉过敏,且大鼠疼痛缓解程度与单次移植的干细胞数目呈正相关。本研究结果推测自体ASCs移植可能通过修复背根神经节神经元细胞损伤和坏死,降低髓核组织炎症损伤,缓解PHN大鼠疼痛,但其修复机制不清楚。
NGF可由神经元、神经支配的靶组织或胶质细胞产生,具有促进中枢和外周神经分化、再生、调控神经系统发育和维持神经系统正常等功能〔10〕。近年研究发现,体外注射NGF可改善PHN症状,蓝丽康等〔22〕发现肌内注射NGF可治疗老年PHN,且疼痛缓解有效率和安全性较高。但NGF缓解PHN症状的分子机制,还不甚明确。研究发现NGF可与TrkA受体结合,通过PI3K/Akt途径调控神经和轴突生长、凋亡和再生,且可与p75NTR受体结合,通过JNK途径促进细胞凋亡〔11〕。Sang等〔23〕发现姜黄素对坐骨神经损伤患者神经元的保护作用,可能与上调NGF表达和激活PI3K/Akt通路有关;Blom等〔24〕发现JNK通路参与神经细胞增殖;郑培兵等〔25〕发现NGF能通过上调JNK表达,促进神经元轴索的生长。本研究结果表明PHN模型大鼠中NGF表达减少,其介导的PI3K/Akt和JNK通路处于抑制状态,可能与PHN大鼠神经元变性、损伤、凋亡有关。本研究结果推测自体ASCs移植修复PHN大鼠背根神经节神经元细胞损伤及缓解疼痛的作用,可能通过激活NGF介导的PI3K/Akt和JNK通路实现。
综上,自体ASCs移植可能通过激活NGF介导的PI3K/Akt和JNK通路,修复背根神经节神经元细胞损伤和坏死,缓解PHN大鼠疼痛,初步为自体ASCs移植应用于临床治疗PHN提供了理论参考。但本研究还存在一定不足,自体ASCs移植改善PHN大鼠疼痛的机制和途径相当复杂,本研究未设置通路抑制剂进行验证,有待后续继续研究。

