AKT抑制剂对结肠癌细胞生物活性及β-catenin信号的影响
杜光红 余雪莲 陈韵 张彤彤 蔡玉婷
(1四川省医学科学院 四川省人民医院,四川 成都 610072;2重庆医科大学第一附属医院消化内科)
Effects of AKT inhibitors on the physiological activity of colon cancer cells and β-catenin signal
DU Guang-Hong,YU Xue-Lian,CHEN Yun,etal.
Sichuan Academy of Medical Sciences.Sichuan Provincial People's Hospital, Chengdu 610072, Sichuan,China
【Abstract】ObjectiveTo analyze the effects of AKT inhibitors on the physiological activity of colon cancer cells and β-catenin signal.Methods5×103SW480 cells grown logarithmically were taken and added 0.0,2.5,5.0,10.0 μmol/L MK2206 to intervene for 24 h, and observe the morphology of SW480 cells with a microscope;CCK-8 test was used to determine survival rate;cloning experiment was used to detect the number of cell clones; Hoechst fluorescence staining was used to detect the apoptosis rate; the protein and mRNA expressions of β-catenin and p-AKT were detected by Western blot and PCR, respectively.ResultsThe SW480 cells treated with 2.5,5.0,10.0 μmol/L were significantly different from the 0.0 μmol/L concentration group (P<0.05), and the survival rate of SW480 cells treated with 5.0 μmol/L was lower than that of 2.5 μmol/L(P<0.05), the survival rate of SW480 under 10.0 μmol/L treatment was the lowest, and it was time-dose-dependent.The number of SW480 cell clones under 2.5 μmol/L treatment was less than that of 0.0 μmol/L concentration (t=3.080,P<0.05), and the number of 5.0 μmol/L cell clones was less than that of 2.5 μmol/L(t=5.385,P<0.05). The number of clones in 10.0 μmol/L SW480 cells was significantly less than that of 5.0 μmol/L group (t=13.96,P<0.05); the apoptosis rate of SW480 cells under 2.5 μmol/L treatment was significantly higher than that of 0.0 μmol/L concentration (t=13.220,P<0.05), 5.0 μmol/L cell apoptosis rate was higher than that of 2.5 μmol/L group(t=6.029,P<0.05), 10.0 μmol/L SW480 cell apoptosis rate was significantly higher than that of 5.0 μmol/L group (t=8.402,P<0.05). The β-catenin and p-AKT protein levels of SW480 cells treated with 2.5 μmol/L were significantly lower than those in the 0.0 μmol/L concentration(tβ-catenin=3.184,tp-AKT=3.060, bothP<0.05), the β-catenin and p-AKT protein levels of SW480 cells treated with 5.0 μmol/L were lower than those in the 2.5 μmol/L group (tβ-catenin=3.275,tp-AKT=8.227, bothP<0.05),the β-catenin and p-AKT protein levels of SW480 cells treated with 10.0 μmol/L were significantly lower than those in the 5.0 μmol/L group(tβ-catenin= 5.039,tp-AKT=5.477,P<0.05). The β-catenin and p-AKT mRNA in SW480 cells treated with 2.5 μmol/L were significantly lower than those in the 0.0 μmol/L concentration (tβ-catenin=4.756,tp-AKT=3.132, bothP<0.05), β-catenin and p-AKT mRNA in SW480 cells treated with 5.0 μmol/L were significantly lower than those in the 2.5 μmol/L group (tβ-catenin=8.227,tp-AKT=3.811, bothP<0.05), β-catenin and p-AKT mRNA in SW480 cells treated with 10.0 μmol/L were significantly lower than those in the 5.0 μmol/L group (tβ-catenin=9.959,tp-AKT=6.235,P<0.05 ).ConclusionsThe AKT inhibitor MK2206 could reduce the physiological activity of human colon cancer cell line SW480, reduce the survival rate, and inhibit the activation of β-catenin and p-AKT. The above indicators decrease with the increase of MK2206 concentration.
【Keywords】 Colon cancer; AKT inhibitor; MK2206; Cell morphology; Survival rate; β-catenin;p-AKT
结肠癌属于消化系统高发病率恶性肿瘤。流行调查显示:全球发达国家结肠癌发病率极高,我国结肠癌患者发病率占消化道恶性肿瘤的第3位,并呈逐渐升高趋势〔1〕。结肠癌是多因素多环节导致,家族遗传占结肠癌发生因素的20%,外界环境及饮食因素占80%。病理性研究表示,结肠癌病灶部位是直肠与乙状结肠交界处恶性肿瘤细胞从表层组织向肌层浸润,逐渐累及淋巴结〔2〕。手术及放化疗能治疗结肠癌,50%患者会出现复发导致死亡,因此了解结肠癌细胞遏制机制对于临床治疗具有重要帮助。β连环素(catenin)是Wnt作用调控因子,是分子量约9 295 kD的蛋白质,有多个氨基酸残基组成〔3〕。β-catenin在结肠癌中能够通过联合多因致癌因子发挥功能,加快肿瘤细胞分泌及增殖,疾病的发生发展与β-catenin信号异常活化相关〔4〕。丝氨酸/苏氨酸激酶(PKB)又称AKT蛋白,包含多个下游因子,例如AKT1、AKT2等,均是PI3K/AKT信号发挥作用的中间产物,其生物活性广泛,可调节细胞代谢〔5〕。AKT激活时能减少抑癌基因合成,加快恶性肿瘤细胞逃脱免疫系统监视,AKT水平升高往往意味着患者预后较差。MK2206为AKT抑制剂,具有降低不同亚型AKT 因子活性的作用,在已经发表的文献中MK2206具有降低肺癌细胞、膀胱癌细胞增殖及侵袭的作用,但是在结肠癌中目前尚无类似研究〔6〕。因此,本文通过人结肠癌SW620细胞体外培养,外源性增加不同浓度的MK2206对其生物活动及β-catenin信号的影响。
1 材料与方法
1.1材料 人结肠癌细胞系SW480购自武汉普诺赛技。 MK2206(美国 Selleck 公司)、RPMI1640培养基(美国Gibco公司);GAPDH抗体(艾美捷科技);β-catenin、p-AKT抗体(中国MCE);CCK-8 试剂盒(北京沃比森);荧光定量-聚合酶链反应(RT-PCR)试剂(成都福际);蛋白垂直电泳系统(北京君意东方);倒置生物显微镜(中国苏州景通仪器)。
1.2方法
1.2.1SW480细胞培养 低温保存人结肠癌细胞系SW480,快速移入37℃水中溶解,离心后,加入新鲜RPMI1640培养基,5%CO2、37.5℃培养,贴壁生长,次日更换新的培养液,生长到90%时,加入蛋白液消化,传代37.5℃保存,以备后用。
1.2.2MK2206溶液制备 将25 mg/ml MK2206溶液溶于200 μl的二甲基亚砜溶液中,将终浓度分别配制成2.5、5.0、10.0 μmol/L备用。
1.2.3CCK-8检测INS-1细胞活力 SW480按照5×103接种到96孔板中,离去旧的培养基后,加入0.0、2.5、5.0、10.0 μmol/L的MK2206,每组设置6孔,培养24 h、48 h及72 h后,加入CCK-8培养基,剂量为100 μl 10%,37℃,模拟生理环境5%CO2,培养3 h,450 nm酶标仪检测细胞存活率,存活率计算参考文献〔7〕。
1.2.4克隆形成实验 数目为5×103的SW480细胞接种到96孔板中,加入0.0、2.5、5.0、10.0 μmol/L的MK2206,37℃,模拟生理环境5% CO2培养14 d,手机克隆复制的SW480细胞,加入4%多聚甲醛15 min固定后,用结晶紫染色液,30 min后。计算克隆细胞数,克隆形成率(%)=(形成的细胞克隆数/接种细胞数)×100%。
1.2.5Hoechst荧光染色检测细胞凋亡 0.0、2.5、5.0、10.0 μmol/L的MK2206处理后的SW480细胞,数目同上,采用40 g/L的多聚甲醛固定0.5 h,采用TrintonX-100透明处理,加入Hoechst荧光材料染色,常温下0.5 h后,细胞凋亡:INS-1细胞核固缩,呈现碎片状,凋亡率=凋亡细胞/细胞总数×100%。
1.2.6Western印迹检测β-catenin、p-AKT抗体蛋白表达 SW480细胞浓度干预及数目同上,高速离心后,保留血清样本样孔。进行电泳,聚偏氟乙烯(PVDF)膜TBS浸泡10 min,反复磷酸盐缓冲液(PBS)冲洗,5 min/次,分别加入兔抗人单克隆抗体β-catenin、p-AKT,GAPDH抗体(1∶500)、加入二抗(1∶2 000),分别杂交,PBS冲洗。浸入ECL工作液,获取图象。
1.2.7qRT-PCR检测β-catenin、p-AKT mRNA SW480细胞浓度干预及数目同上,冲洗后放于无菌试管管中,加入β-catenin、p-AKT试剂提取RNA。将RNA逆转录为DNA,将β-atin载体为模板进行RT-PCR扩增,PCR条件:98℃ 6 min,98℃ 28 s,75℃ 30 s,80℃ 4 min,总计55个循环。β-catenin:正义链:5′-CACTCTCGAGATGGCTACTCAAGCTG-3′,反义链:5′-CTGCGGATCCTTACAGGTCAGTATCAA-AC-3′;p-AKT:正义链:5′-AGTGACTCCTCCACGA-CTGAG-3′,反义链:5′-GGTGACTGTGTGAGCGACTTC-3′;β-actin:正义链:5′-TTGCCGACAGGATGCA-GAAGGA-3′,反义链:5′-AGGTGGACAGCGAGGCCAGGAT-3′。
1.2.8统计学方法 采用SPSS23.0软件进行t检验、F检验。
2 结 果
2.1MK2206对SW480细胞形态的影响 0.0、2.5、5.0、10.0 μmol/L的MK2206处理后的SW480细胞24 h后,显微镜观察结果显示:未经MK2206干预SW480细胞呈现梭形密集生长,癌细胞之间生长相互连接,经不同浓度的MK2206干预后的细胞数目降低,形态发生改变,细胞核固缩,10 μmol/L的MK2206细胞形成凋亡小体。见图1。
2.2MK2206对SW480细胞克隆数目影响 2.5 μmol/L组SW480细胞克隆数目〔(266.50±13.60)个〕显著低于0.0 μmol/L组〔(315.60±20.50)个,t=3.080,P<0.05〕,5.0 μmol/L组〔(184.20±14.02)个〕显著低于2.5 μmol/L组(t=5.385,P<0.05),10.0 μmol/L组〔(68.92±5.66)个〕显著低于5.0 μmol/L组(t=13.960,P<0.05);见图2。
2.3MK2206对SW480细胞存活率的影响 与0.0 μmol/L组细胞存活率相比,2.5、5.0、10.0 μmol/L组均显著下降,且呈剂量依赖性(均P<0.05)。见表1。

图1 MK2206对SW480细胞形态的影响(结晶紫染色,×200)
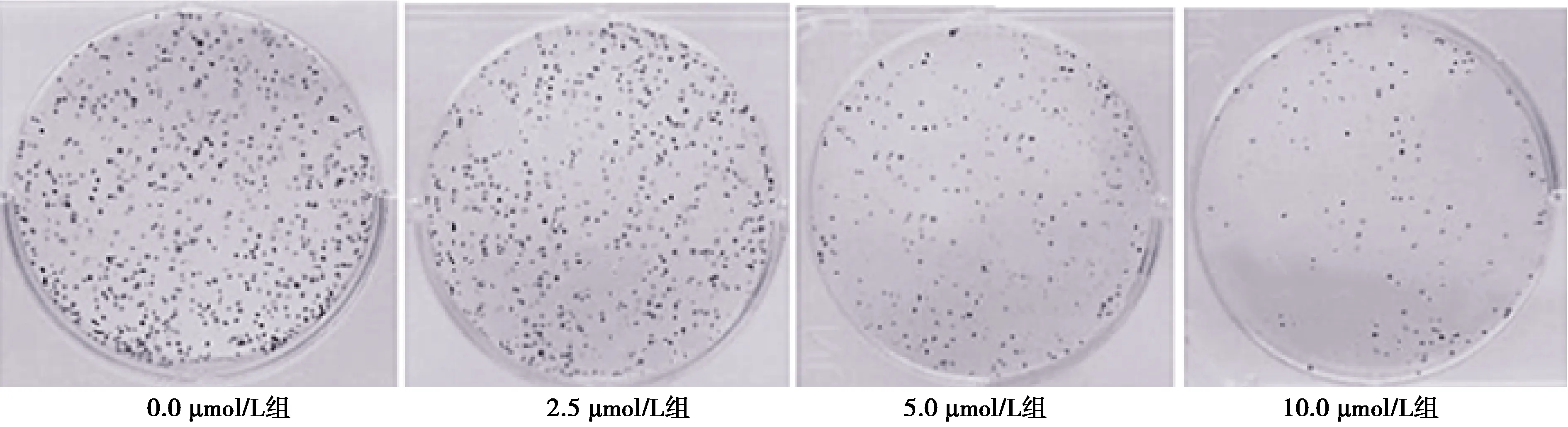
图2 各组SW480细胞克隆数目比较(结晶紫染色,×200)
表1 各组细胞存活率比较
2.4MK2206对SW480细胞凋亡率影响 2.5 μmol/L组SW480细胞凋亡率(8.50±1.69)%显著高于0.0 μmol/L组〔(4.22±0.80)%,t=13.220,P<0.05〕,5.0 μmol/L细胞凋亡率〔(14.22±2.30)%〕显著高于2.5 μmol/L组(t=6.029,P<0.05),10.0 μmol/L组SW480细胞凋亡率〔(28.65±3.02)%〕显著高于5.0 μmol/L组(t=8.402,P<0.05),见图3。

图3 各组SW480细胞凋亡率比较(Hoechst33258染色,×200)
2.5各组SW480细胞中β-catenin和p-AKT蛋白水平 2.5 μmol/L组SW480细胞β-catenin和p-AKT蛋白水平显著低于0.0 μmol/L组(tβ-catenin=3.184,tp-AKT=3.060,均P<0.05),5.0 μmol/L组β-catenin和p-AKT蛋白水平显著低于2.5 μmol/L组(tβ-catenin=3.275,tp-AKT=8.227,均P<0.05),10.0 μmol/L组β-catenin和p-AKT蛋白水平显著低于5.0 μmol/L组(tβ-catenin=5.039,tp-AKT=5.477,P<0.05),见表2、图4。
2.6qRT-PCR检测SW480细胞中β-catenin、AKTmRNA 2.5 μmol/L组SW480细胞β-catenin和AKT mRNA均显著低于0.0 μmol/L组(tβ-catenin=4.756,tAKT=3.132,均P<0.05),5.0 μmol/L组β-catenin和AKT mRNA显著低于2.5 μmol/L组(tβ-catenin=8.227,tAKT=3.811,P<0.05),10.0 μmol/L组β-catenin和AKT mRNA均显著低于5.0 μmol/L组(tβ-catenin=9.959,tAKT=6.235,P<0.05)。见表3。
表2 各组β-catenin和p-AKT蛋白水平比较
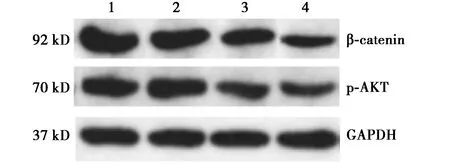
1~4:0.0 μmol/L组、2.5 μmol/L组、5.0 μmol/L组、10.0 μmol/L组图4 各组SW480细胞中β-catenin和p-AKT蛋白水平
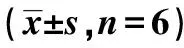
表3 各组β-catenin和AKT mRNA表达比较
3 讨 论
结肠癌是全球发病率前3的恶性肿瘤,对于结肠癌癌细胞发生远处转移的患者化疗是主要治疗方法,但是临床毒副作用较强,例如肿瘤药物浓度不足或全身毒副反应等。因此,临床研究热点在于特异性恶性癌细胞增殖,而对正常细胞无伤害,从分子治疗逐步走向靶向性基因治疗。AKT信号通路抑制剂MK-2206是一种新型治疗方式,已经证实在乳腺癌、膀胱癌等作用较好。
结肠癌细胞的形成是多环境多致癌因素大量表达,致癌物质发生免疫逃窜,导致结肠癌细胞生长失衡,大量分泌导致异常增生。SW480细胞增殖、复制能力较强,能够通过减少细胞凋亡,诱导DNA快速复制,加大癌细胞有丝分裂,加快新病灶形成及向旁癌组织扩散〔8〕。研究表明结肠癌的形成属于基因病变,与致癌信号、抑癌信号及基因修复损伤存在关联〔9〕。AKT信号通路是目前研究较多的信号通路,在细胞中有信号传导作用,在参与正常细胞的新陈代谢同时,在肿瘤中有促进作用。在结肠癌细胞中发现有磷酸化p-AKT表达升高,异常活动程度调节结肠癌细胞生物行为。AKT在结肠癌患者组织中呈现高表达在息肉或癌旁组织中表达降低。因此,临床针对恶性AKT表达的抑制剂不断增加,MK2206属于口服变构蛋白激酶,对AKT下游多个亚型进行抑制,例如AKT1、2等〔10〕。在子宫内膜癌细胞中,MK2206联合西药能减少癌细胞存活及再生,加快细胞凋亡明显优于单纯西药治疗。在膀胱癌细胞中,不同浓度的MK2206均对癌细胞存活率有抑制作用,作用机制在于降低PI3K/AKT介导 GSK-3β磷酸化的能力〔11〕。在结肠癌细胞中,MK2206能通过降解细胞外基质减少癌细胞中金属蛋白酶表达。Yang等〔12〕研究表示,AKT被激活能加快结肠癌细胞再生及血管生成,通过上调缺氧因子,而减少癌细胞凋亡,而MK2206能阻断AKT与P13K信号通路发生交叉,减少下游因子激活,从而改善病情。临床研究表示,在中晚期实体肿瘤患者中采用MK2206治疗效果较好,患者耐受性较好。本研究表明在结肠癌细胞中,外源性增殖AKT抑制物MK2206能有效降低细胞生理活动,减少复制及生存,加快细胞核固缩,形成凋亡小体,抑制剂的浓度越高作用越明显。
在正常机体中,β-catenin存在细胞浆内能通过多种泛素化依赖蛋白而抑制β-catenin水平,遏制其进入细胞核〔13〕。Fu等〔14〕研究表示,Wnt信号通过能够与Frz形成复合物,抑制β-catenin磷酸化形成。而当β-catenin信号发生突变时,能减少抑制其降解的物质形成,提高β-catenin在细胞表达。研究表明,多数癌症患者机体中β-catenin的表达都有提升,异常表达的β-catenin 可加剧机体免疫细胞的损伤,如在胶质瘤中β-catenin信号表达受到抑制后,癌细胞的放射敏感性就会降低,从而提高放疗和化疗的效果〔15〕。β-catenin通路在众多肿瘤中被发现,在胃癌和子宫内膜癌中的异常变化有重要参考价值。β-catenin通路信号被激活时,会加快结肠癌细胞的分化,导致肿瘤形成。赵雪等〔16〕研究表明β-catenin能快速进入细胞核中,与LEF等转录因子相互作用促使结肠癌细胞分化。唐秀娟等〔17〕研究表示,β-catenin能加快结肠癌细胞中GSK-3β磷酸化,诱导AKT水平升高。相关研究表示,磷酸化p-AKT能增加结肠癌细胞生长,并通过建立体外结肠癌大鼠模型发现p-AKT表达增加。p-AKT异常活化能增加核因子水平,能够上调血管生成因子加快癌细胞生成及复制〔18〕。已有研究表示,在胶质瘤细胞中通过外源性增加AKT抑制剂,减少p-AKT水平而改善肿瘤生长〔19〕。Choi等〔20〕研究表明在乙型肝炎中AKT抑制物能通过抑制ZEB1表达而降低β-catenin水平。结肠癌细胞中经AKT抑制物MK2206处理后,GSK-3β水平降低,导致对β-catenin异常表达的能力减弱,导致β-catenin蛋白降低。研究表明在结肠癌细胞经AKT抑制物MK2206处理后,细胞中β-catenin中下游因子cyclin D1基因表达,降低β-catenin。本研究结果说明MK2206能降低结肠癌中β-catenin和p-AKT水平并与抑制剂浓度呈现负相关。
本研究存在一定的不足,由于时间、成本等问题,未采取AKT激动剂进行试验,可能会存在局限性,在今后的研究中应加入更多的实验方法,为结肠癌的治疗提供更有利的实验依据。综上,AKT抑制剂MK2206能减少人结肠癌细胞株SW480生理活动,降低存活率,加快凋亡,能显著抑制β-catenin、p-AKT活性,随着MK2206浓度增加而降低。

