建立规律月经周期的青春期McCune-Albright综合征1例及文献复习
廉怡华,皮亚雷,张亚男,张会丰
(河北医科大学第二医院 儿科,河北 石家庄 050000)
在儿童,McCune-Albright综合征(MAS)多以外周性性早熟、皮肤牛奶咖啡斑、多发性骨纤维结构不良三联征为临床特点。以乳房发育或阴道出血为表现的外周性性早熟是患儿就诊的主要原因[1]。MAS尚无有效根治方法,多为对症治疗。针对性早熟以控制阴道出血、延缓骨龄进展、改善患儿成年终身高为主。曾经用于治疗MAS外周性性早熟的药物包括雌激素受体调节剂如他莫昔芬、雄激素类衍生物如达那唑和芳香化酶抑制剂如来曲唑等。本文就1例McCune-Albright综合征患儿从幼年阴道出血开始治疗到青春期月经周期建立终止治疗的全过程进行回顾分析。
1 临床资料
患儿女,3.5岁,2008-3-17出生,2011-9-14患儿以“服用他莫西芬3个月仍有少量阴道出血”首诊我院。患儿生后即可见右侧肢体(下颌部、颈后、臀部及下肢)多处牛奶咖啡斑,不过中线。2岁时无明显诱因阴道出血1次,量中等,持续2~3 d,未处理。3岁时乳房开始发育,不伴有触痛。3.3岁时因“再次出现阴道出血”就诊外院,出血量较少,持续1~2 d;否认外伤史、特殊药物及食物接触史;当时实验室检查:促黄体生成素(LH)为0.28 IU/L,促卵泡生成素(FSH)为0.54 IU/L,雌二醇(E2)为757.67 pg/ml,余未见异常;超声示子宫及右侧卵巢体积明显大于同龄儿,可见卵巢囊肿,符合外周性性早熟表现;X线片提示多发性骨纤维异常增殖;临床诊断为“McCune-Albright综合征”,给予他莫昔芬10 mg/d。
查体:身高102.5 cm(+0.8SD),牛奶咖啡斑如上述,乳房B2期不伴触痛,余未见异常。入我院后完善相关检查:LH<0.1 IU/L,FSH<0.1 IU/L,E2为76.95 pg/ml;超声示右侧卵巢可见较大囊肿。考虑他莫昔芬效果欠佳,更换为达那唑1/2片/d,后依据患儿临床表现及子宫卵巢超声情况调整剂量,至超声回报卵巢体积及囊肿明显减小,予以达那唑1/4片/d维持治疗。2014-3-17患儿自行停药8个月后再次出现阴道出血,持续7天,且分泌物多;双侧乳房伴触痛且乳晕颜色较前加深;LH:0.00 IU/L,FSH:0.07 IU/L,E2:82 pg/ml;结合超声示双侧卵巢体积较前增大,可见较大卵巢囊肿,给予来曲唑1/4片/d小剂量起始治疗,并根据患儿随诊情况调整剂量,直至来曲唑为1片/d时总体控制可。2016-7-8乳房发育较前明显增大,分泌物增多;超声示右侧卵巢体积明显增大,考虑患儿可能继发中枢性性早熟,进一步完善促性腺激素释放激素(GnRH)刺激试验:LH峰值>5.0 IU/L且LH/FSH峰值大于0.6;诊断“①McCune-Albright综合征,②继发性中枢性性早熟”,予以来曲唑1片/日联合促性腺激素释放激素类似物(GnRHa)----注射用醋酸亮丙瑞林(博恩诺康)3.75 mg 5周/次治疗。2018-1-5联合治疗18个月后,患儿9岁10个月,身高143.5 cm,已出现跛行近半年,右下肢短于左下肢约2~3 cm,且家属期望患儿发育,综合考虑后仅停用博恩诺康。2018-4-23患儿诉11天前月经来潮,持续4天,量较大,超声示仍有卵巢囊肿,维持来曲唑原治疗不变。2018-10-1复查超声及实验室检查均提示患儿处于青春期状态,考虑其目前已发育稳定,停止来曲唑治疗。至2020-3-26患儿身高147.2 cm,第二性征发育完全,月经周期规律7 d/30 d,经量正常。见表1。
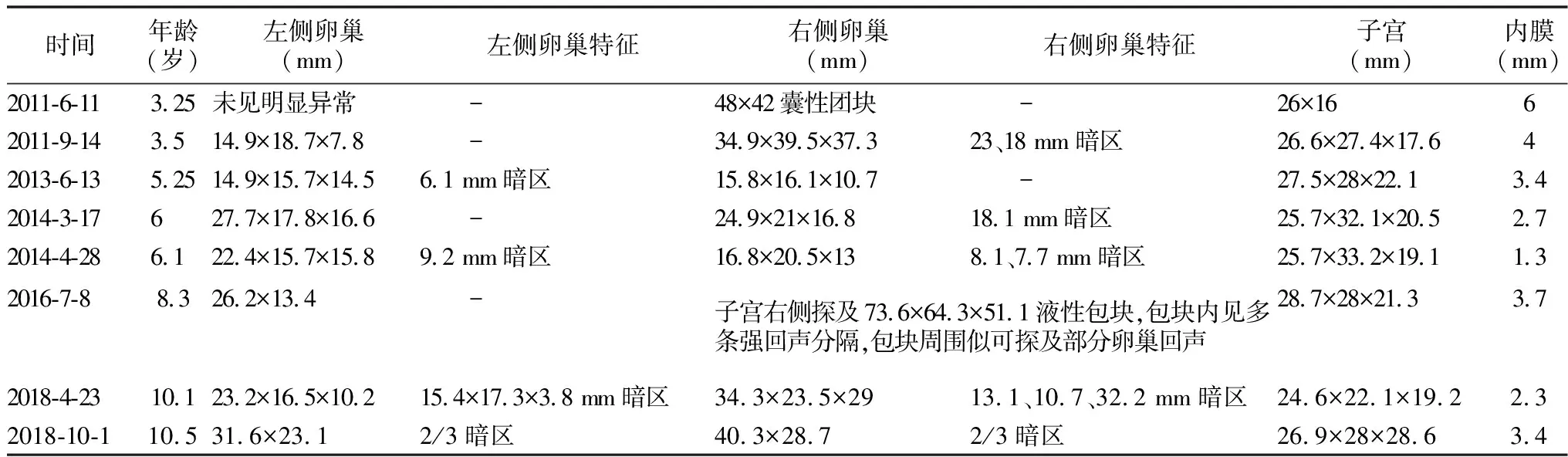
表1 患儿随访过程中子宫及卵巢超声结果
2 讨 论
在MAS常见的三联征中,皮肤牛奶咖啡斑、多发性骨纤维结构不良没有很好的治疗措施,而外周性性早熟可以采取药物治疗。通过药物控制阴道出血、延缓骨龄进展、改善患儿成年终身高。本例患儿自幼儿期以阴道出血为首发症状,随即给予他莫昔芬治疗,但效果不佳;进而改为达那唑,伴随芳香化酶抑制剂上市,采取来曲唑治疗取得良好效果。从雌激素受体调节剂,到雄激素类衍生物,直至芳香化酶抑制剂是治疗MAS的外周性性早熟的常见药物。该患儿用药过程反映了治疗外周性性早熟首选药物的发展历程。
雌激素受体调节剂最早用于MAS的外周性性早熟,代表药物为他莫昔芬。雌激素受体调节剂可竞争性地抑制雌激素与雌激素受体的结合,从而阻断雌激素对子宫内膜及生长板等靶器官的作用,但其并不能从根本上减少性腺异常分泌的雌激素。Eugster等[2]报道在MAS应用他莫昔芬治疗的过程中,阴道出血较前减少、生长速率及骨龄进展亦减慢,但子宫体积较前有增大。本例患儿应用他莫昔芬3个月,子宫未见明显变化,右侧卵巢较用药前减小,但仍有少量阴道出血;用药过程中未发生肝肾功能异常。易琴等[3]也报道1例MAS患儿应用他莫昔芬无效,且治疗剂量为本患儿3倍,但骨龄进展、第二性征及性腺未得有效抑制,提示他莫昔芬可能对治疗MAS外周性性早熟效果欠佳。在一项对MAS患儿应用他莫昔芬治疗的回顾性研究中发现,患儿用药后未见不良反应,骨密度及子宫内膜也未见变化[4]。但有体外研究报道,他莫昔芬可能有促雄激素作用。虽然从理论上讲,他莫昔芬不会引起雄激素效应增加,但确实有妇女在服用他莫昔芬后出现多毛现象[5];同时异常的毛发生长也发生在1例5岁的MAS女性患儿应用他莫昔芬2个月后,以腹部、背部、手臂及大腿居多[6]。考虑到其临床疗效及不良反应,应用于MAS时应慎重选择,并做好子宫卵巢超声的定期监测。
雄激素类衍生物具有弱雄激素作用和蛋白同化作用、抗孕激素作用,进而降低血雌孕激素水平;同时也可与子宫内膜的受体结合,抑制子宫内膜的生长,代表药物为达那唑。有动物实验显示大剂量达那唑可能对卵巢储备功能有抑制作用,而600 mg以下的剂量则是相对安全的,且临床应用剂量往往小于30 mg/d,提示达那唑可能对卵巢功能无毒副作用,但仍需更多临床资料支持[7]。汤蕊等[8]应用达那唑治疗遗传性血管水肿的疗效和安全性报道中,患者出现了肝酶升高、脱发、油脂分泌增多、体重增加,月经紊乱等不良反应,提示达那唑有潜在的肝脏毒性。高宇等[9]对40例特发性中枢性性早熟(ICPP)女童应用GnRHa联合达那唑治疗,发现联合达那唑可降低血清I型前胶原氨基端前肽、β-胶原降解产物及N端骨钙素并升高机体25-(OH)D3水平,提示达那唑可能有助于改善骨代谢水平。但由于应用达那唑后可能会出现疲劳、乏力及潜在肝脏毒性等不良反应,故目前临床已很少应用。该患儿既往应用达那唑治疗效果可,仅用1/4片/d即可控制良好,可能与其对子宫内膜有直接抑制作用有关;用药期间未诉不良反应,可能与药物剂量及个体敏感性有关。
芳香化酶抑制剂可以选择性阻断雄激素向雌激素转换,从根源上减少了雌激素产生,改善机体症状并延缓骨龄成熟,同时也不影响其他甾体激素的合成,代表药物为来曲唑。其在MAS的治疗中取得很好的临床疗效,且治疗期间安全性较好,但有多项研究发现部分MAS患儿应用来曲唑一段时间后,出现雌激素水平升高及卵巢容积增大,甚至有1例在治疗2年后出现卵巢囊肿破裂[10-13],但尚未发现其他不良反应。来曲唑治疗乳腺癌及矮身材男童等研究中则报道了包括高雄激素血症、骨质丢失甚至骨折、关节疼痛、精神及神经系统改变、肝肾功能异常、血脂代谢紊乱等不良反应,但对认知功能影响的报道甚少[14-18],且相关不良反应停药后可消失或减轻,虽然在MAS中尚未报道此类不良反应,但这也可能与相关研究较少有关,因此我们仍需密切关注各个系统的不良反应,尤其是骨代谢相关标志物和性腺超声。该患儿应用来曲唑后,阴道流血停止,卵巢囊肿逐渐缩小,且未发生不良反应。
笔者比较3种药物特点,来曲唑从根源上减少雌激素产生,且治疗期间安全性较好,目前似乎更适用于治疗MAS患儿的外周性性早熟,但用药过程中应定期监测性腺超声及性激素、骨代谢标志物水平,同时也应密切关注机体各个系统的变化及其他不良反应,做好长期随访,评估远期风险。2019版MAS专家共识也是建议将来曲唑作为一线用药,他莫昔芬为二线用药[19]。
部分MAS患儿后期可继发中枢性性早熟,一经诊断,应结合患儿情况决定是否联合GnRHa治疗。该患儿8岁时即继发中枢性性早熟,预测其成年终身高可能受损,给予联合治疗至9岁10个月,身高达143.5 cm后,结合患儿及家长意愿,停止GnRHa治疗;卵巢发育稳定后,停止来曲唑治疗;至今,患儿第二性征发育完全、月经来潮规律,生活质量可。目前患儿仍在定期随访,以监测其远期预后。

