聚乙二醇和细胞穿膜肽介导提高玉米花粉管通道法转化效率
李向龙 张中保 张春 郑登俞 王作平 吴忠义

摘要:为探讨花粉管通道法加聚乙二醇(PEG)介导、加细胞穿膜肽(CPPs)介导与直接导入外源基因3种方式间的转化率差异,对2种玉米自交系材料京2416和京92进行花粉管通道法转化并统计分析。结果表明,3种方式均能获得草甘膦抗性植株,在京2416受体中PEG介导较直接导入高0.45百分点,CPPs介导的较直接导入的高0.66百分点,三者间转化率差异达显著或极显著水平;对T0代草甘膦抗性植株PCR进行检测,发现因外源基因丢失或沉默,草甘膦抗性植株未必都含有目的基因,因此田间筛选应与PCR检测相结合;北京市农林科学院房山转基因基地转化验证结果发现3种导入方式其草甘膦抗性率和转化率高低顺序一致,均为CPPs介导>PEG介导>对照,与海南省三亚市崖城基地转化相同,且CPPs介导和PEG介导二者间差异极显著,京2416中二者相差0.26百分点,京92中相差0.36百分点。因此,在花粉管通道法转化玉米过程中加入介导物质有助于提高转化率,且加CPPs比加PEG更具有优势。
关键词:玉米;花粉管通道法;介导物质;转化率;比较分析
中图分类号:S513.032 文献标志码: A
文章编号:1002-1302(2022)12-0091-04
收稿日期:2021-08-19
基金项目:北京市农林科学院科技创新能力建设专项(编号:KJCX20200603、KJCX20200205、KJCX20200407)。
作者简介:李向龙(1981—),男,内蒙古磴口人,硕士,助理研究员,主要从事玉米遗传育种研究。E-mail:long8888380@126.com。
通信作者:吴忠义,研究员,博士生导师,主要从事玉米分子育种研究。E-mail:zwu22@126.com。
随着转基因技术的不断成熟,众多转化方法在玉米遗传转化中发挥了重要的作用。自周光宇报道花粉管通道法转基因技术以来[1],该技术在国内被广泛应用,目前已在水稻、小麦等多种作物中应用,并获得转基因阳性株系[2-5]。研究者在玉米中利用花粉管通道法进行转化时,多以在授粉后的玉米花丝上直接加外源基因为主,但转化效率不理想。随着研究的深入,该方法逐渐被优化,如在转化过程中添加聚乙二醇(polyethylene-glycol,PEG)或细胞穿膜肽(cell penetrating peptides,CPPs)作为介导物质,来提高其转化率。由于PEG作为一种细胞融合剂,可引起细胞膜表面电荷的紊乱并干扰细胞间的识别,从而介导细胞间融合或外源DNA分子进入原生质体[6],而CPPs作为小分子多肽,可携带疏水性大分子(如DNA)进行跨膜转运并将其带入细胞[7]。目前刘铜等用这2种方式进行介导转化,均获得了阳性植株[8-9],但二者与直接加外源基因进行导入的转化效率是否存在差异尚未见报道。本研究以直接滴入外源DNA溶液为对照,通过添加CPPs和PEG等2种方式与对照组进行转化率差异比较,确定花粉管通道法的最佳导入方法,以期为该方法在玉米遗传转化应用中获得较高转化率提供技术参考和指导。
1 材料与方法
1.1 材料和试剂
1.1.1 试验材料 用于转化的玉米自交系为京2416和京92,由笔者所在课题组的实验室保存。
1.1.2 试验时间及地点 018年初在海南省三亚市崖城基地(简称“崖城基地”)进行花粉管通道法转化,2018年6月在北京市农林科学院房山转基因基地(简称“房山基地”)播种T0代,喷施草甘膦除草剂,并对抗性植株自交授粉;为验证试验结果,2018年7月在北京基地再次进行转化,11月将转化种子在崖城基地进行筛选和检测。
1.1.3 外源DNA制备 60 ng/μL含抗草甘膦Epsps基因的外源DNA溶液由笔者所在实验室制备并保存。
1.1.4 试验试剂 1 mg/mL CPPs由笔者所在实验室构建并保存;PEG粉剂由生工生物工程(上海)股份有限公司提供;1 mol/L CaCl2溶液由上海金穗生物科技有限公司提供;除草剂选用美国孟山都公司研制的41%草甘膦异丙胺盐水剂(农达,Rroundup)。
1.2 转化流程及导入方式
花粉管通道法的转化流程为玉米雌穗未吐絲前先套袋,待花丝长至8~10 cm时进行自交授粉并套袋,依据前期对两受体材料转化时间经验,授粉18 h后将雌穗顶部苞叶和花丝同时剪去,为防止溶液外流,将切口处苞叶内花丝剪成凹口再进行滴入。
1.2.1 直接导入 以直接滴入外源DNA溶液为对照,转化时将溶液稀释至30 ng/μL,滴入360 μL,每个受体转化15穗,重复3次。
1.2.2 PEG介导 在50 mL离心管中先加入 4 g PEG、14.6 mL灭菌超纯水和0.4 mL的1 mol/L CaCl2,再和外源DNA溶液等体积混匀后进行导入。转化溶液终浓度、滴入量、转化穗数及重复次数同“1.2.1”节。
1.2.3 CPPs介导 将CPPs和外源DNA溶液等体积混合后进行导入。转化溶液终浓度、滴入量、转化穗数及重复次数同“1.2.1”节。
1.3 转化后代草甘膦筛选
转化获得的T0、T1代种子,人工开沟条播,行长4 m,行距30 cm,3次重复。待幼苗生长至3叶1心期喷施草甘膦除草剂,浓度为200 mg/L。喷药前统计出苗数,喷药后观察其药害反应及抗性,10 d后调查抗性株数,统计草甘膦抗性率。
抗性率=抗性植株数/出苗植株数×100%。
1.4 目的基因的PCR检测
采用CTAB法[10]提取3种方式获得的T0、T1代草甘膦抗性植株DNA进行PCR扩增,用于转基因抗性植株检测的PCR上游引物为5′-ACAGCACCTTCATCGGCGACGCCTC-3′,下游引物为5′-GCATCTTTCCGTATGATAGGGCATC-3′,目标片段长度为292 bp。PCR扩增体系为20 μL,扩增程序为:95 ℃ min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,30个循环;72 ℃延伸7 min,获得PCR产物。对PCR产物进行1%琼脂糖凝胶电泳检测Epsps基因,根据目的基因阳性条带的植株来统计3种导入方式的转化率。
转化率=阳性植株数/出苗植株数×100%。
1.5 数据处理
用Microsoft Excel 007软件和DPS软件进行数据处理和分析。
2 结果与分析
2.1 不同導入方式对幼苗草甘膦抗性表型
由图1可知,植株对草甘膦药害反应表现一致,抗性植株叶色及长势正常,不抗植株叶片先变紫,再变黄,最后整株干枯死亡。对比田间筛选结果,发现3种方式草甘膦抗性植株和无抗性植株差异特别明显,且PEG介导和CPPs介导等2种导入方式获得的抗性植株表现与对照没有差异;2个受体转化后代对草甘膦药害反应一致,抗性植株未出现药害,叶色鲜绿,植株生长未受影响。
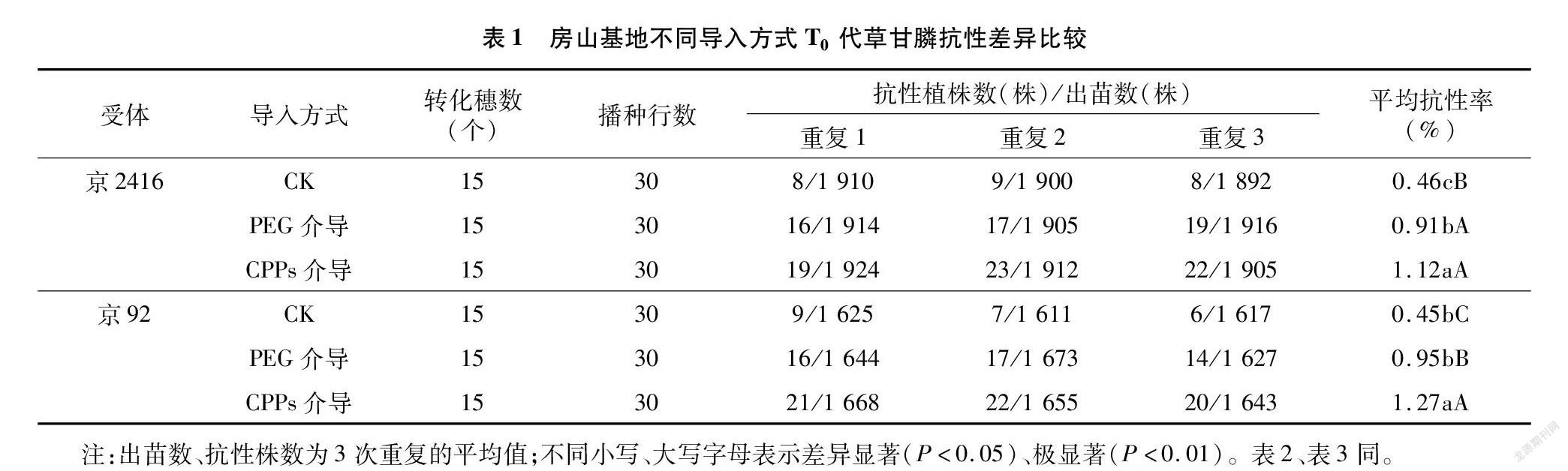
2.2 不同导入方式T0代草甘膦抗性差异比较
由表1可知,T0代2个受体材料间出苗数相差较大,主要是由二者间雌穗结实粒数不同造成的。3种方式在房山基地筛选,都获得了草甘膦抗性植株,它们在2个受体内的抗性率变化趋势表现一致,均以加CPPs介导最高,分别为1.12%、1.27%;PEG介导转化法次之,分别为0.91%、0.95%;对照最低,均不高于0.46%。经过方差分析可知,CPPs介导和PEG介导之间的抗性率在2个受体中分别相差0.21、0.32百分点,达显著和极显著水平;2种方式与对照间抗性率差异达极显著水平,在京2416受体中与对照相比分别高0.66、0.45百分点,在京92受体中分别高0.82、0.50百分点。可见,3种导入方式之间存在差异,且加入介导物质后有助于提升花粉管通道法的转化效率。
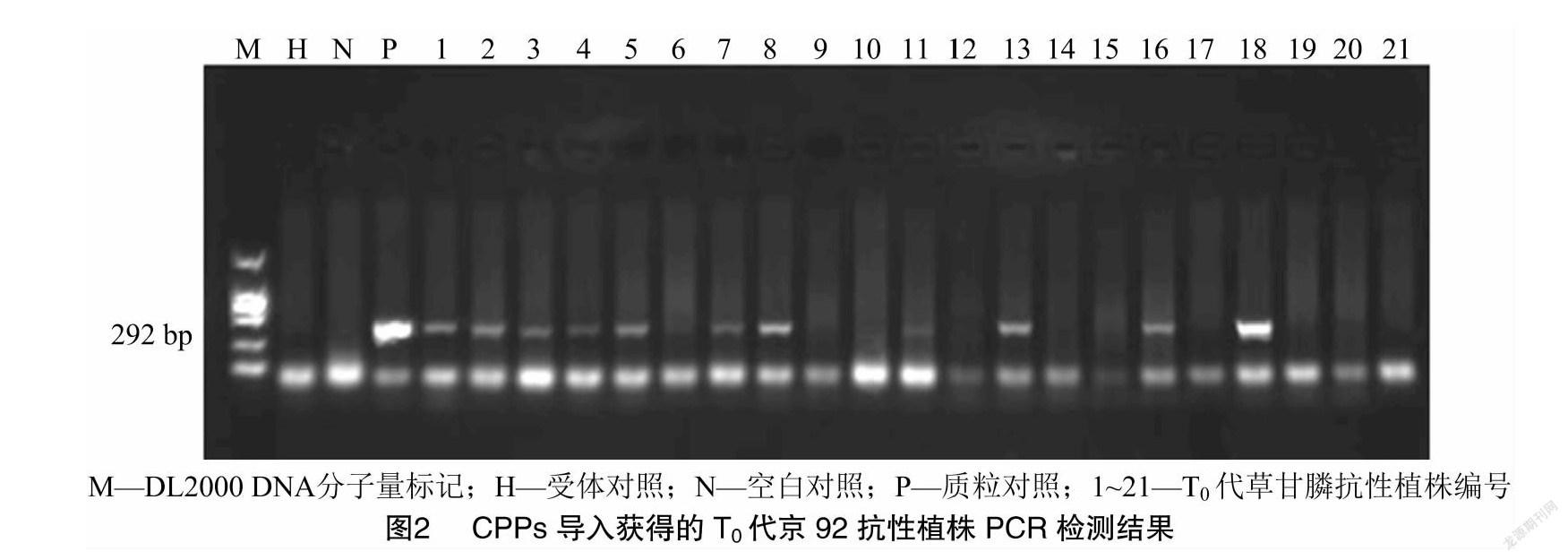
2.3 T0代草甘膦抗性植株Epsps基因的PCR检测
以受体基因组DNA和水为阴性对照,质粒为阳性对照,对房山基地筛选得到的T0代草甘膦抗性植株进行Epsps基因的PCR检测。由图2可知,阴性对照和水均未出现特异性条带,21株抗草甘膦植株得到的阳性片段中有11株约为292 bp的条带,与目的基因条带大小一致,初步证明外源目的基因已成功整合到京92转基因植株基因组中。
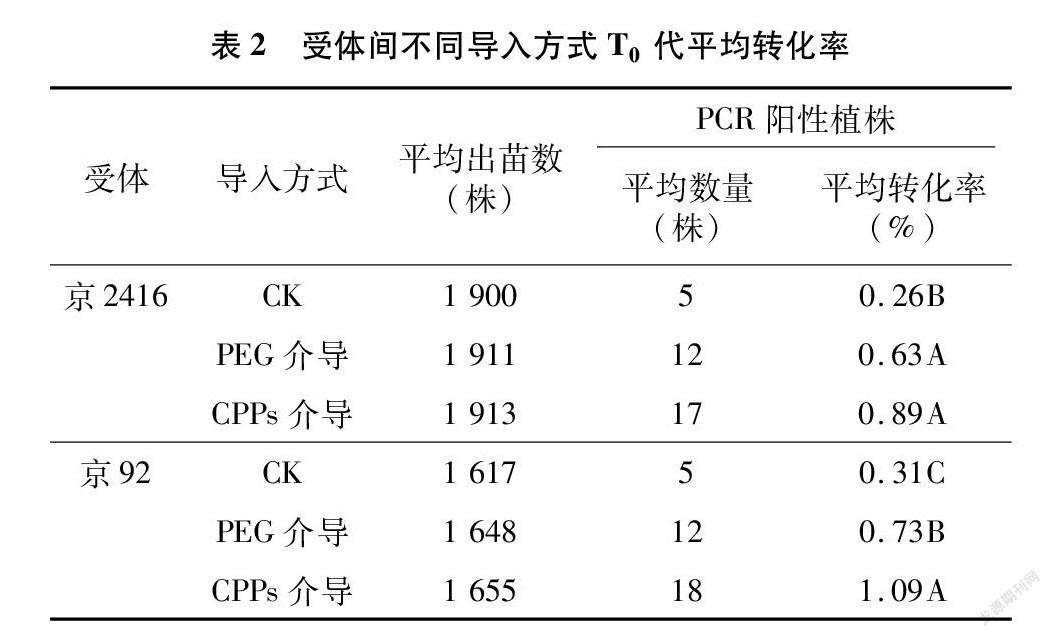
2.4 不同导入方式转化率差异比较
通过对3种导入方式获得的T0代草甘膦抗性植株进行PCR检测,平均转化率结果见表2。结合表1和表2可知,3种方式的草甘膦抗性株获得Epsps目的基因阳性条带数量略有减少,可能与基因的丢失或沉默有关,说明田间筛选应和室内筛选相结合,以增加结果的可靠性。通过方差分析可知,三者在受体间的转化率高低顺序一致,依次为CPPs介导>PEG介导>对照,CPPs、PEG分别比对照高0.63、0.37百分点;同时对PEG和CPPs等2种导入方式进行比较,发现京2416用CPPs介导的平均转化率为0.89%,较PEG介导显著高0.26百分点,京92用CPPs介导的转化率为1.09%,较PEG介导极显著高0.36百分点,进一步说明花粉管通道法转化中用CPPs介导的转化率高于PEG介导的转化率。
2.5 不同导入方式对受体转化率的验证
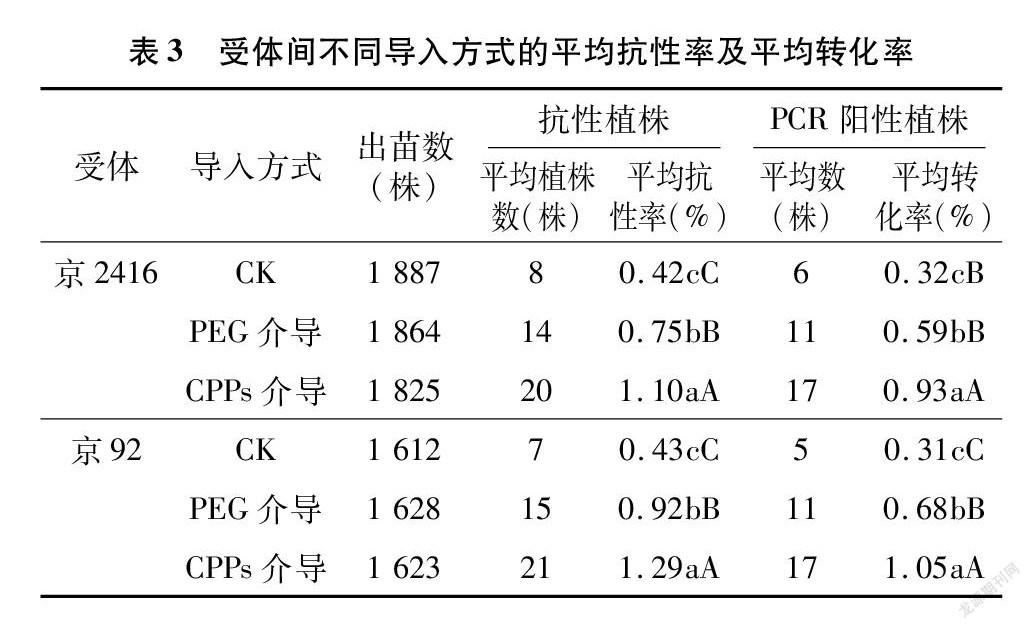
为进一步验证上述试验结果,2018年7月在北京基地继续以京2416和京92为受体,用3种导入方式对2种材料进行花粉管通道转化,获得的T0代种子在崖城基地播种后进行草甘膦筛选,取抗性植株的叶片在实验室内进行PCR检测(表3)。
由方差分析结果(表3)可知,3种导入方式在崖城基地获得的T0代植株草甘膦平均抗性率在受体间表现与在房山基地一致,由高到低依次为CPPs介导>PEG介导>对照,且三者间差异达极显著水平;平均转化率变化与之相似,CPPs介导和PEG介导等2种方法显著高于对照,京2416受体中分别高0.61、0.27百分点,京92受体中分别高0.74、0.37百分点,这进一步验证了花粉管通道法在进行玉米遗传转化时,加入介导物质可显著提高其转化效率,且CPPs介导转化率高于PEG介导。
3 结论与讨论
本研究在采用花粉管通道法转化的基础上,通过外加CPPs、PEG辅助和DNA溶液直接导入3种方式均获得了草甘膦抗性玉米植株,且三者之间存在显著或极显著差异,说明花粉管通道法在转化时加入CPPs或PEG介导物质有助于提高其转化效率。3种导入方式均有抗草甘膦除草剂的植株,但是PCR检测后含有目的基因的阳性植株有所减少,说明草甘膦除草剂筛选出的抗性植株还要结合PCR检测,这样才能确保转化筛选结果的可靠性。
PEG介导、CPPs介导和直接滴入3种导入方法最终都获得了含Epsps基因的抗性植株,但三者之间有差异,加介导物质的转化率要高于对照,CPPs介导和PEG介导相比,前者可以获得更高的转化率,京2416中二者相差0.26百分点,京92中则相差0.36百分点,说明花粉管通道法在进行玉米转化时要加入介导物质,且以CPPs介导最佳。
在崖城基地对房山基地转化的T0代材料进行筛选验证,发现3种导入方式的除草剂抗性及遗传转化率高低顺序未发生变化,三者间差异达极显著水平。本试验为2地2季的统计结果,3种方式在受体间的差异还有待进一步验证。
花粉管通道法利用植物授粉后所形成的花粉管通道将外源DNA携带入胚囊,其优点是不再依赖组培再生植株,操作简单,常规育种工作者易于掌握[11]。在玉米转化过程中,其转化率除受外界环境因素影响外,更主要的影响因素是转化方法本身,笔者所在课题组在多年的实际操作中发现加入介导物质可提高玉米的遗传转化效率。
本研究采用的3种导入方法都能获得草甘膦抗性植株,但PCR检测时仍存在无阳性条带的现象,可能是外源DNA进入受体细胞后,在遗传过程中会被细胞中的核酸酶逐渐降解,进而使得基因沉默或丢失,最终导致目的基因不能都在草甘膦抗性植株中表达,说明在进行转基因阳性植株检测时,除草剂筛选要和PCR检测相互结合起来,避免假阳性的出现。
参考文献:
[1]Zhou G Y,Weng J,Zeng Y,et al. Introduction of exogenous DNA into cotton embryos[J]. Methods in Enzymology,1983,101:433-481.
[2]王才林,赵 凌,宗寿余,等. 用花粉管通道法将bar基因导入水稻获得可遗传的转基因植株[J]. 江苏农业学报,2002,18(3):129-133.
[3]郭向萌,周晓君. 花粉管通道法介导辣椒总DNA获得转基因小麦[J]. 江苏农业科学,2018,46(8):36-38.
[4]邓德旺,郭三堆,杨志民. 棉花花粉管通道法转基因的分子细胞学机理研究[J]. 云南大学学报(自然科学版),1999,21(增刊3):124-125.
[5]黄俊轩,李建科,李双跃,等. 油葵基因转化体系的建立[J]. 北方园艺,2010(13):176-178.
[6]徐齐君,胡小平,陈 婷,等. PEG介导的棉花枯萎病菌原生质体转化体系的建立[J]. 棉花学报,2012,24(3):222-228.
[7]张兰馨,张书祥. 穿膜肽的内化机制及其应用[J]. 中国生物化学与分子生物学报,2008,24(12):1092-1096.
[8]刘 铜,侯巨梅,陈 捷,等. PEG介导的玉米弯孢叶斑病菌遗传转化[J]. 植物保护,2012,38(6):27-30.
[9]韩 猛,王霄汉,张中保,等. BADH基因转入玉米自交系的研究[J]. 作物杂志,2015(2):64-69.
[10]陈向明. 用CTAB法提取植物DNA的技术改进[J]. 合肥教育学院学报,2000,17(4):14-16,30.
[11]简纯平,李开绵,欧文军.花粉管通道法转基因育种研究进展[J]. 热带作物学报,2012,33(5):956-961.

