不同氮形态对盐胁迫下玉米生长及生理特性的影响
赵军 许泽宏
摘要:土壤盐渍化已成为制约农业生产的非生物因素之一,合理的调控措施可以减轻盐渍化对植物的危害。采用砂培试验,以德玉4号玉米为供试材料,设定3个盐分浓度(0、50、100 mmol/L NaCl)、4个硝铵水平[NO-3(%)/NH+4(%)=0/100、70/30、30/70、100/0],研究不同氮素形态配比对盐胁迫下玉米生长发育及生理特性的影响。研究表明,无论氮素形态如何,NaCl胁迫明显影响了玉米植株的生长发育。在0 mmol/L NaCl胁迫条件下,单施NH+4或硝銨混施处理比单施NO-3处理具有更高的干质量、叶面积及SPAD值。盐胁迫(50、100 mmol/L NaCl)条件下,存在NH+4供应情况下玉米植株叶片净光合速率、胞间CO2浓度等光合特征及最大光化学效率、实际光化学效率以及光化学猝灭系数等荧光参数均具有较大值,叶片非化学猝灭系数、水势、渗透压、膨压等参数存在较小值,表明供给NH+4可有效减轻盐胁迫带来的不利影响。此外,各处理的无机离子(Na+、K+、NH+4、Ca2+、Mg2+、Cl-、NO-3)数据表明,在根系养分吸收过程中,NO-3被Cl-取代造成养分运输受限是盐胁迫抑制玉米植株生长发育的重要原因之一,因此,NH+4比NO-3更有利于缓解玉米生长发育及生理代谢。综上,本研究结果诠释了通过培育耐盐性较高的玉米品种和施用NH+4肥料,对于开发利用中低度盐渍化土壤具有可行性。
关键词:氮素形态;盐胁迫;光合特征;水势;无机离子
中图分类号:S513.06 文献标志码:A
文章编号:1002-1302(2022)11-0082-09
收稿日期:2021-08-21
基金项目:四川省重大科技专项(编号:2019YFS503)。
作者简介:赵 军(1968—),女,四川宜宾人,硕士,讲师,主要从事植物生理生化研究。E-mail:1424596530@qq.com。
干旱半干旱灌溉区土壤盐渍化的形成与增加已成为制约农业可持续发展的重要瓶颈[1]。目前,我国盐渍土面积超过总耕地面积的20%,随着人类活动进行,盐渍化土地面积仍在不断扩大,盐渍化程度也在不断加剧[2]。盐胁迫对作物的影响可贯穿种子发芽到成熟各个生长发育环节,参与众多信号转导过程,包括光反应、暗反应、离子运输、渗透物质积累等生理生化反应;当盐分超过一定浓度时,作物发育代谢严重受阻,加速植株枯萎死亡[3]。氮作为植物生长的主要限制因子,对作物生长、产量及品质具有不可替代的作用[4]。一般认为,有机态氮只有经过微生物矿化作用转化为无机态氮才能被植物所吸收,然而研究发现,当植物与一些微生物共生时(如丛枝菌根真菌)[5],可以直接吸收有机态氮,但即便基于环境可控的室内条件,植物吸收的有机氮源数量也仅占氮总吸收量的10%~20%,无机态氮是植物吸收的主要氮源形态[6]。不同植物对氮形态的吸收偏好往往存在较大差异,大多数植物喜好吸收硝酸盐(NO-3),只有少数植物偏好于吸收铵(NH+4)[7],几乎所有的植物在硝铵混合氮源下生长发育最好、品质最佳[8]。植物对氮形态的喜好主要取决于植物种类,但干旱、盐渍、水涝以及大气CO2水平等环境因素也是影响植物吸收偏好的重要因素[9]。
研究表明,土壤盐渍化不会影响土壤环境氮素的有效性,而会影响根系表面对硝酸盐(NO-3)和氯离子(Cl-)、铵(NH+4)和钠(Na+)的竞争[2,10]。不同氮素形态具有不同的物理化学性质,对植物亦表现出明显的生长差异,同时合适的氮素形态供应可以调控植物对Cl-和Na+的摄取并且提高植株的渗透代谢,从而缓解盐胁迫对植物带来的损伤[11]。然而,目前关于铵态氮(NH+4)和硝态氮(NO-3)2种形态对盐胁迫下玉米植株生理代谢及无机离子吸收平衡的研究鲜有涉及。基于此,本研究基于盐胁迫探索了不同形态氮素供应对玉米生长及生理代谢的影响,以期为在盐胁迫环境玉米生产过程中合理施用氮肥提供理论依据。3EAFA25E-20A4-4A9A-8E10-ABB1D401EFA7
1 材料与方法
1.1 试验地点和供试材料
试验于2020年5—8月在宜宾职业技术学院盆栽大棚中进行。棚中日夜平均温度为28℃/18℃,相对湿度为65%~90%。
供试玉米品种为德玉4号,其母本D85是自交系8001的变异单株自交选育,父本D35是以 5237-196/Lx9801 为基础材料选株自交选育,种子来自四川省宜宾市种子管理站,德玉4号是典型的耐盐品种[12]。
试验采用氮肥类型为硝酸钙[Ca(NO3)2]和硫酸铵[(NH4)2SO4],兩者均为分析纯,产自Sigma化学试剂公司。
1.2 试验设计
试验所用氮肥形态为硝态氮(NO-3)、铵态氮(NH+4),设置4个不同水平的硝铵比例NO-3(%)/NH+4(%)=0/100、70/30、30/70、100/0,各处理总氮用量皆为9 mmol/L,同时加入8 μmol/L二氰胺(C2H4N4),防止NH+4向NO-3转化。此外,设置3种盐浓度(0、50、100 mmol/L NaCl),为了避免盐过度带来的冲击效应,采用NaCl逐步递增处理的办法,即每天递增50 mmol/L,直至升至100 mmol/L。因此,本研究共设置4种氮素形态水平及3个盐胁迫水平的组合试验,共12个处理。各处理重复5次。
盆栽器具为塑料圆盆,高28 cm,直径20 cm,试验栽培基质为石英砂与蛭石(体积比3∶1)的混合物,用量10 kg/盆。5月5日将玉米种子用1%次氯酸钠溶液消毒5 min并采用蒸馏水冲洗干净后,直接播种于装满沙石的塑料盆中,出苗后,根据幼苗的长势和表观叶片活力,将其减至2株/盆。此后采用Hoagland 营养液作为养分加入,其中营养液中的氮分别为上述氮素形态处理的氮源(9 mmol/L),每5 d加入1次100 mL的营养液,幼苗培养30 d后,分别在不同处理的营养液中加入盐溶液(0、50、100 mmol/L)进行胁迫处理,盐胁迫60 d后,收获植株,即盆栽培养周期为90 d。
1.3 样品采集及测定分析
1.3.1 植株生物量、叶面积指数、脯氨酸含量以及可溶性糖含量测定
试验结束时,在10:00—12:00收获植株。用便携式叶面积计(LI-3000A,Li-Cor Nebraska,USA)测量玉米植株叶片表面积后,用日本美能达公司产手持式SPAD-502型叶绿素计(SPAD 502 Plus,Konicaminolta,JAPAN)测定叶绿素相对含量(SPAD值)。之后植株地上、下部分离,杀青30min置于60℃环境下烘干样品至恒定质量并称量记录。将测定完干物质的样本粉碎后装于自封袋中待测。用3%磺基水杨酸提取新鲜植株的脯氨酸,可溶性糖含量采用分光光度法测定,其具体过程参照高俊凤的方法[13]进行分析。
1.3.2 光合气体交换参数及叶绿素荧光参数测定
利用便携式光合测定仪(Li-Cor 6400,Li-Cor Nebraska,USA)测定光合气体交换参数[CO2净同化速率(Ci)、蒸腾速率(Tr)、气孔导度(Gs)];测定时光源选择、叶室温度、光量子通量密度、CO2浓度参数皆参照孙云飞等的方法[14]设置。气体交换测量是在NaCl处理开始59 d(晴天)进行。各处理重复3次。
叶绿素荧光测定选定晴朗的10:30采用MINI-PAM便携式式叶绿素荧光仪(MINI-PAM-Ⅱ,WALZ,Germany),荧光参数参考孙云飞等的方法[14]。测定经过25min暗处理,测定植株生长点以下第3张完全展开叶暗适应的初始荧光(Fo)、饱和最大荧光(Fm)及正常光照下的初始荧光(Fo′)、荧光上升到能化类囊体的最大荧光(Fm′)及稳态荧光(Fs),各处理重复3次。叶绿素荧光参数中,PSⅡ的最大光化学效率(Fv/Fm)=(Fm-Fo)/Fm;实际光化学效率(ΦPSⅡ)=(Fm′-Fs)/Fm′;光化学荧光猝灭系数(qP)=(Fm′-Fs)/(Fm′-Fo′);非光化学荧光猝灭系数(NPQ)=(Fm-Fm′)/Fm。
1.3.3 水势及渗透压的测定
在光照开始后6~8 h,温度控制为28℃、湿度为75%条件下,用水势仪测定每个处理的5张完全膨胀叶片的叶片水势(Ψw)。
将新鲜收获的叶片避开主脉打孔快速研磨放入离心管中,然后在4℃下以15 000 r/min离心 15 min,收集上清液,使用蒸气压渗透压计测量叶液的渗透压(L)。根据Vant Haff方程,将该值转换为溶质势(Ψs)。Ψs=-L×(Mosmoles/kg)×2.58×10-3,MPa;叶内膨压(Ψp)=(Ψw-Ψs)×0.753 6,MPa。3EAFA25E-20A4-4A9A-8E10-ABB1D401EFA7
1.3.4 无机离子测定
将0.50 g待测样品溶于 5 mL 蒸馏水中,以2-苯基苯酚水合物为显色化合物测定水提取物中的硝酸盐(NO-3)浓度。将测定完干物质的粉碎样品用0.5%硝酸处理后,用电感耦合等离子体原子发射光谱仪测定样品中的Ca2+、Mg2+、Cl-含量;用原子吸收分光光度计测定样品中的Na+、K+含量;根据鲍士旦的方法[15]测定样品铵(NH+4)含量。
1.4 数据处理与统计分析
采用Microsoft Excel 2016进行数据整理,采用SPSS 22.0在0.05显著性水平上进行单因素方差分析,采用Origin 2019 proC进行图形绘制。
2 结果与分析
2.1 不同氮形态对盐胁迫下玉米干物质累积的影响
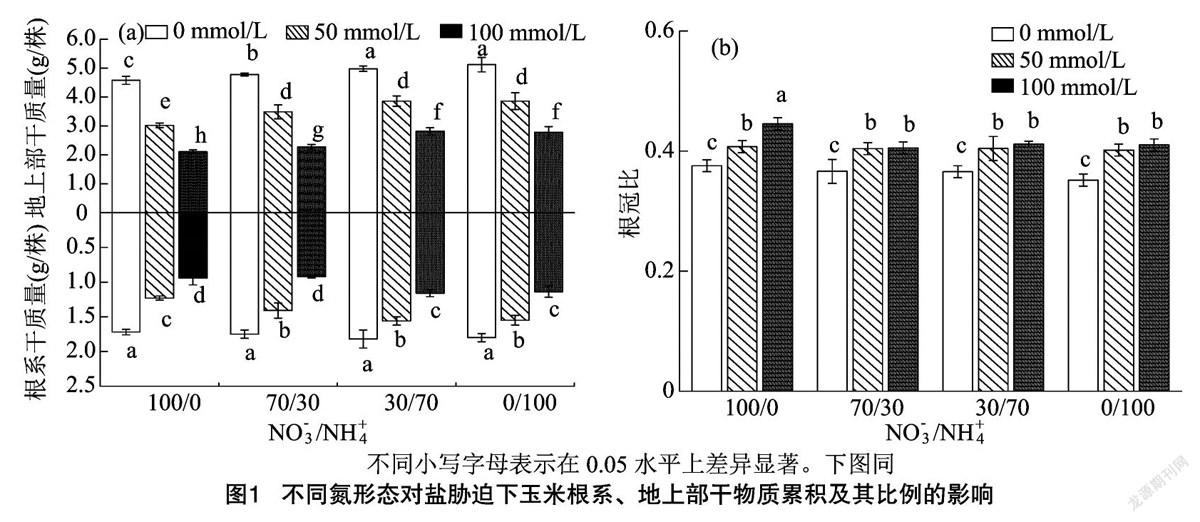
由图1-a可知,无论是地上部或根系中,且无论是否存在NaCl情况下,含有NH+4和NO-3这2种氮形态处理的植株干质量较高,施用硝酸盐(NO-3)的处理植株干质量最低,同一NaCl浓度下明显低于其他氮素形态处理。就任一氮素形态处理而言,与0 mmol/L NaCl处理相比,添加 50 mmol/L NaCl显著降低了地上部、根系的干质量(P<0.05);随着NaCl浓度升高,其干质量降低;在100 mmol/L NaCl胁迫程度下,地上部、根系干质量均最低。由图1-b可知,就各NaCl处理而言,根冠比皆呈0 mmol/L NaCl处理>50 mmol/L NaCl处理>100 mmol/L NaCl处理,其中50、100 mmol/L NaCl处理均显著大于0 mmol/L NaCl处理,且在NO-3/NH+4=100/0时,100 mmol/L NaCl处理显著大于50 mmol/L NaCl处理。就氮素形态而言,以NO-3/NH+4=100/0时根冠比值整体较高,但各处理根冠比波动较小。
2.2 不同氮形态对盐胁迫下玉米叶片相关指标的影响
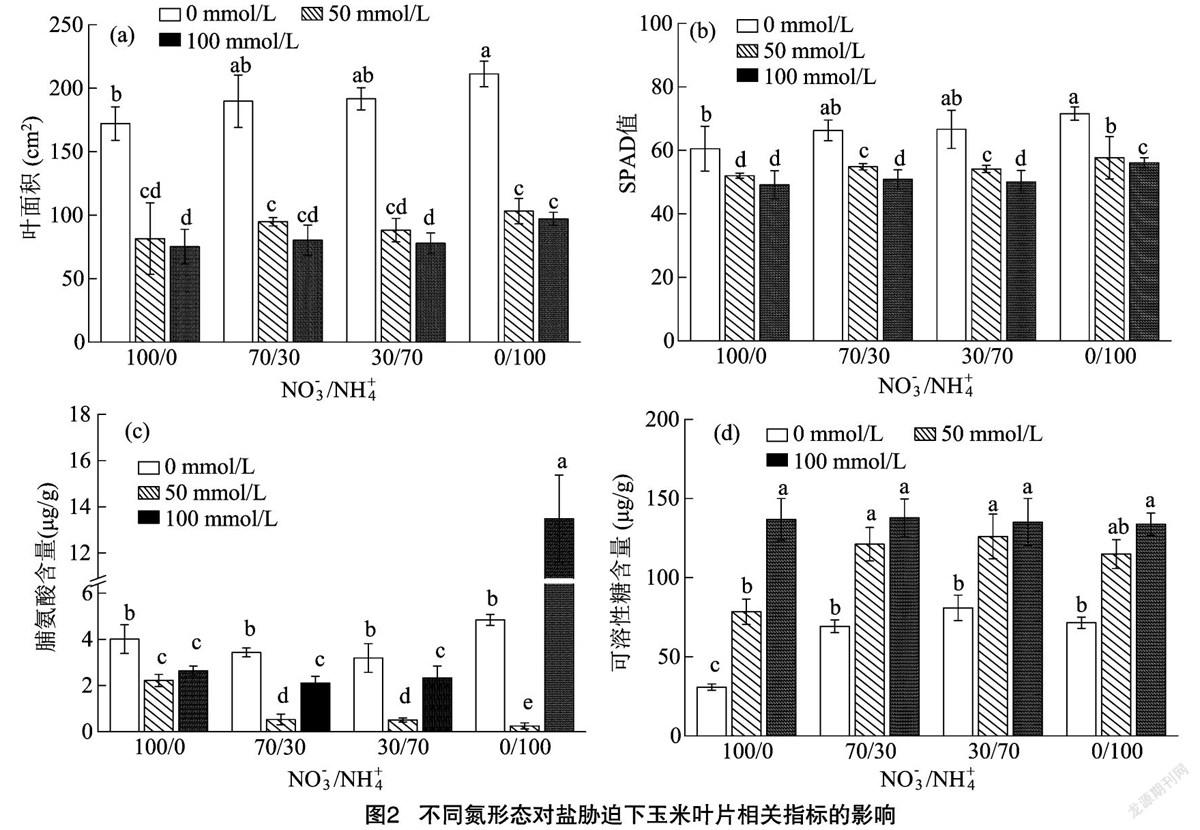
由图2-a可知,就氮素形态处理而言,以单施NH+4(NO-3/NH+4=0/100)处理的叶面积整体最高,2种氮素合施处理次之,单施NO-3处理最低。就NaCl浓度处理的数据来看,以0 mmol/L NaCl处理的叶面积最高,50 mmol/L NaCl处理次之,100 mmol/L NaCl处理最低。在0 mmol/L NaCl条件下,NO-3/NH+4=0/100处理的叶面积最高(211.25 cm2),较其他3个氮素形态处理提高10.22%~22.71%,其中与NO-3/NH+4=100/0处理差异显著;而在50、100 mmol/L NaCl浓度中,各处理皆以100 mmol/L NaCl较小,但各氮素形态处理在50、100 mmol/L NaCl浓度间均无显著差异。由图2-b可知,各处理的SPAD值与叶面积趋势趋于一致,仅NO-3/NH+4=100/0氮素形态处理中50、100 mmol/L NaCl浓度处理间SPAD值差异不显著。
由图2-c可知,在NaCl浓度为50 mmol/L条件下,各氮素形态处理的叶片脯氨酸浓度均最低,在NaCl浓度为0、100 mmol/L条件下,单一NH+4处理植株脯氨酸含量高于其他氮素形态处理;在高盐度(100 mmol/L)下,单一NH+4氮素处理植物叶片脯氨酸浓度比单一NO-3处理植物高4.88倍。此外,在NaCl浓度为0、50 mmol/L条件下,单一NO-3氮素处理植物叶片中可溶性糖的浓度最低;就NaCl浓度而言,各氮素形态处理的可溶性糖浓度表现为0 mmol/L NaCl处理<50 mmol/L NaCl處理< 100 mmol/L NaCl处理(图2-d)。
2.3 不同氮形态对盐胁迫下玉米叶片光合气体交换参数的影响
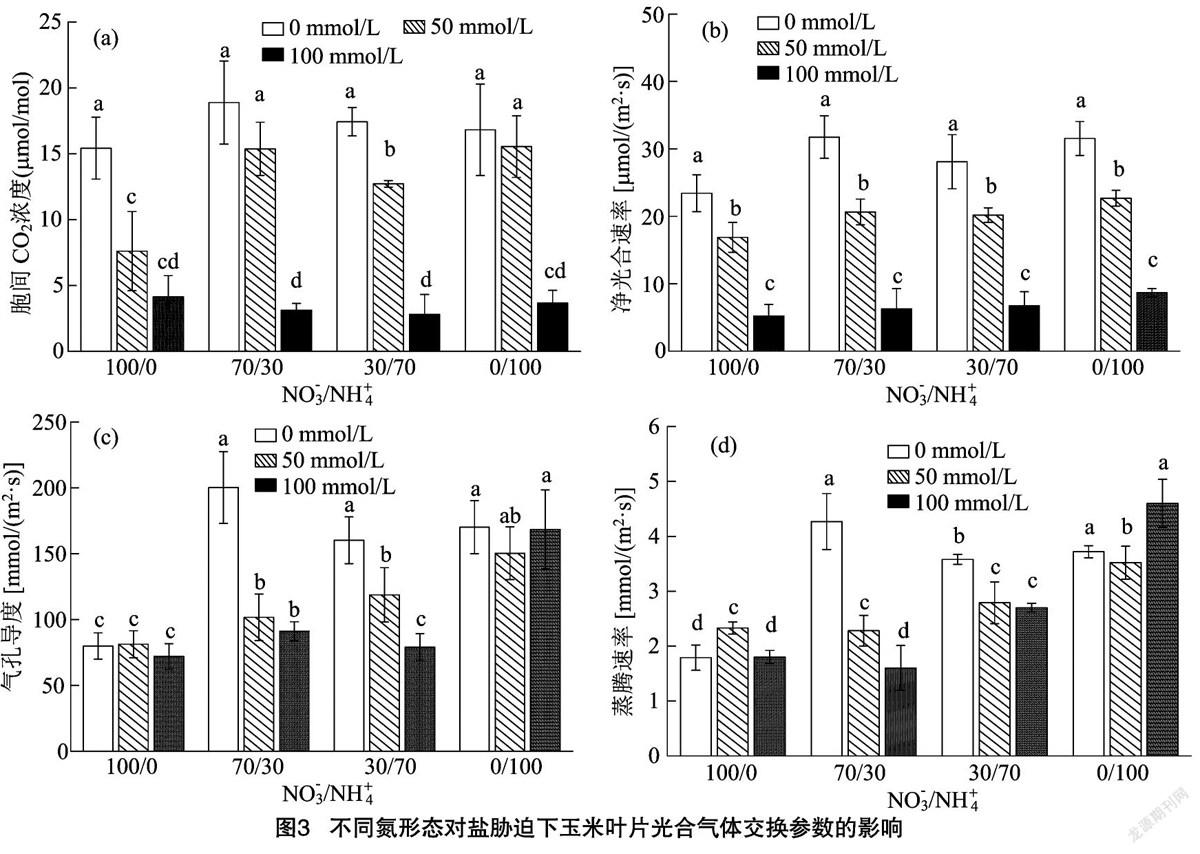
由图3-a可知,胞间CO2浓度(Ci)中,就NaCl浓度而言,各氮素形态处理中的NaCl浓度均表现为0 mmol/L处理>50 mmol/L处理>100 mmol/L处理,在无NaCl条件下,以NO-3/NH+4=70/30处理的Ci最高,NO-3/NH+4=30/70处理次之,但各氮素比例处理间差异不显著。而在50 mmol/L NaCl条件下,Ci以NO-3/NH+4=70/30、0/100处理最高,两者与NO-3/NH+4=30/70处理显著差异;在100 mmol/L NaCl条件下,各氮素形态处理差异不显著。在净光合速率(Pn)中,Pn与Ci规律基本趋于一致,但不同NaCl浓度的Pn值存在显著差异,以0 mmol/L NaCl处理最高(图3-b)。3EAFA25E-20A4-4A9A-8E10-ABB1D401EFA7
由图3-c可知,气孔导度(Gs)中,就氮素形态而言,从NO-3/NH+4=100/0、70/30、30/70、0/100的数据来看,Gs基本随NH+4比例的增加而增加。在 0 mmol/L NaCl条件下,各处理Gs以NO-3/NH+4=70/30处理最高;在50 mmol/L NaCl条件下,随着NH+4比例的增加,Gs呈明显增加趋势,以NO-3/NH+4=0/100处理最高,显著高于NO-3/NH+4=100/0处理;在100 mmol/L NaCl条件下,随着NH+4比例的增加,Gs也整体呈增加趋势,其中NO-3/NH+4=0/100处理显著大于其他氮素形态处理。各处理蒸腾速率(Tr)趋势与Gs规律基本趋于一致(图3-d)。
2.4 不同氮形态对盐胁迫下玉米荧光参数的影响
由图4可知,在氮素形态及胁迫复合处理下,各处理荧光参数间存在明显差异。PSⅡ最大量子效率(Fv/Fm)、PSⅡ实际量子效率(ΦPSⅡ)以及荧光猝灭光化学猝灭系数(qP)分别反映PSⅡ的原初光能转换效率、实际原初光能的捕获效率以及反应中心的开放与获取程度[16]。在图4-a、图4-b、图4-c 中,Fv/Fm、ΦPSⅡ、qP的规律基本一致,即就同一氮素形态的试验数据来看,随着盐浓度水平升高,上述3个指标数值皆表现为显著下降趋势;就同一盐浓度而言,其Fv/Fm、ΦPSⅡ、qP隨着NH+4供给的增加整体表现为略微增加趋势。非化学猝灭系数(NPQ)反映PSⅡ反应中心吸收的光能无法用于光合电子传递,而以热能形式损失掉的光能部分。试验数据表明,就同一氮素形态而言,随着盐水平增加,NPQ显著增加。就同一盐水平而言,在 0 mmol/L NaCl处理中,4个氮素处理间均无显著差异;50 mmol/L NaCl处理中,纯NO-3处理的NPQ显著高于纯NH+4处理;100 mmol/L NaCl处理中,纯NH+4处理显著低于其他氮素形态处理。
2.5 不同氮形态对盐胁迫下玉米叶片水分关系参数的影响
由图5-a可知,在叶片水势(Ψw)中,就NaCl浓度条件而言,随着NaCl浓度越大,Ψw就越大;在NaCl浓度为0、50 mmol/L条件下,随着NH+4比例升高,其Ψw呈整体升高趋势。仅从NaCl胁迫处理的数据来看,0、50 mmol/L NaCl条件下,各氮素比例处理之间的Ψw值均无显著差异,在100 mmol/L NaCl条件下,以NO-3/NH+4=70/30处理最高,显著大于NO-3/NH+4=100/0处理。
由图5-b可知,在溶质势(Ψs)中,就NaCl浓度处理而言,随着NaCl浓度提高,Ψs增加;就氮素形态而言,随着NH+4比例升高,其Ψs呈升高趋势。就氮素形态数据来看,各氮素形态处理中,50、100 mmol/L NaCl处理间多无显著差异,100 mmol/L NaCl处理均显著高于0 mmol/L NaCl处理(NO-3/NH+4=70/30氮素处理除外)。
由图5-c可知,在叶片膨压(Ψp)中,随着NH+4比例提高,各处理Ψp呈整体升高趋势,但在不同NaCl浓度处理中,Ψp变化规律不明显。在NO-3/NH+4=100/0处理中,以0 mmol/L NaCl处理的Ψp最高,但与50、100 mmol/L NaCl处理未达显著差异水平。在NO-3/NH+4=70/30处理中,以 50 mmol/L NaCl处理最高,与0、100 mmol/L NaCl处理未达显著差异水平。在NO-3/NH+4=30/70处理中,以50 mmol/L NaCl处理最低,与0、100 mmol/L NaCl处理未达显著差异水平。在NO-3/NH+4=0/100氮素处理中,随着NaCl浓度升高,Ψp增加,以100 mmol/L NaCl处理最大,显著大于 0 mmol/L NaCl处理。3EAFA25E-20A4-4A9A-8E10-ABB1D401EFA7
由图5-d可知,叶内温度中,各氮素比例处理差距较小,但就NaCl浓度处理的温度来看,均以100 mmol/L NaCl处理最高,且在NO-3/NH+4=100/0、70/30、30/70的氮素形态比例中,100 mmol/L NaCl处理均显著大于0、50 mmol/L NaCl处理,而在NO-3/NH+4=0/100时,各NaCl浓度处理均无显著差异。
2.6 不同氮形态对盐胁迫下玉米无机溶质浓度的影响
由表1可知,盆栽结束时各处理叶片无机离子(Na+、K+、NH+4、Ca2+、Mg2+、Cl-、NO-3)浓度存在一定差异。Na+浓度对氮素形态和NaCl浓度皆表现出一定的相关性,NaCl的存在使叶片细胞液中Na+含量逐渐增加,但其积累水平也与各形态氮素比例有关,在50 mmol/L NaCl 和100 mmol/L NaCl下,与纯NO-3处理相比,纯NH+4处理分别使叶片组织中Na+积累量减少了35.34%和80.96%。各处理K+浓度中,含较高NO-3比例的处理比含较高NH+4处理具有更高的K+浓度,同时NaCl的存在降低了K+的吸收,在纯NO-3培养条件下更是如此。在0 mmol/L NaCl条件下,当营养液中NO-3比例降低时,K+/Na+下降,相反,在50、100 mmol/L NaCl条件下,K+/Na+则呈升高趋势。在不同氮源处理下,Ca2+浓度均高于Mg2+,NaCl的存在使Ca2+濃度升高,Mg2+浓度降低。叶片NH+4浓度随供NH+4比例的增加而增加,叶片NO-3浓度随着NO-3比例的降低而降低,在单施NO-3的处理中,50 mmol/L NaCl使得叶片NO-3浓度增加了11.57%,相反,在100 mmol/L NaCl条件下,NH+4浓度比没有NaCl的处理提高了1.76倍。叶片中Cl-含量与Na+含量规律相似,然而,在氮素形态中NH+4的存在显著减少了叶片中Cl-的积累,且随着NH+4浓度增加,Cl-含量越低。
3 讨论与结论
植物对盐的耐受性取决于植物种类、盐胁迫强度、持续时间以及环境氮素形态和浓度[17]。NO-3和NH+4是大部分陆生植物主要氮素吸收的氮素形态,尽管植株吸收NO-3所耗的能量成本比其他氮形态更高,但一部分植物通常能很好地平衡吸收NO-3营养,且即便环境NO-3浓度比正常浓度高出几倍,仍很少出现植物NO-3中毒[18]。相比之下,即使环境中存在相对较低浓度的NH+4也会诱发植物叶片坏死、生物膜降解以及渗透状态紊乱[19]。一些耐盐植物可能同时耐NH+4胁迫以至于在NH+4下比在NO-3下生长得更好。本研究采用耐盐性玉米品种德玉4号,其植株干物质试验数据表明,该耐盐品种干物质累积量在单一NH+4供给下比单一NO-3氮素形态供应下更高,且对地上部的生物量累积影响更大;随着NaCl浓度升高,生物量累积显著减少,在100 mmol/L NaCl浓度下,根冠比最大,叶面积及SPAD值最小。说明无论氮素形态如何,NaCl的存在都对玉米生长存在一定的抑制作用,且随着NaCl浓度增加其抑制作用加剧,其中对地上部生长的抑制作用大于对根系生长的抑制作用,说明地上部对盐度的直接敏感性更高。此外,本研究发现,氮供给形态中,NH+4的存在可有效减轻植株的NaCl胁迫(如100 mmol/L)对叶片和根系生长带来的不利影响。几项研究报告显示,单独供给NH+4的植物对盐度的敏感性会明显增加[20],但在本研究中,单一供给NH+4的处理对NaCl的敏感度没有体现出明显变化,这可能是本研究对象为耐盐植物的缘故。3EAFA25E-20A4-4A9A-8E10-ABB1D401EFA7
植物生长受许多生理和分子过程的调控,特别体现在对光合作用的影响。盐胁迫对光合作用的影响很大程度上取决于氮素形态、植物种类以及胁迫强度[21]。本研究发现,在无NaCl胁迫情况下,净光合速率、胞间CO2浓度等光合参数变化与氮的形态无关,而单一NH+4处理的植株气孔导度和蒸腾速率较其他氮素形态处理更高,Gs和Tr的增加也意味着呼吸作用与净同化作用之间更为协调[22]。植物的绝大多数生物量和经济产量来源于光合作用产生的碳水化合物[23],叶绿素荧光参数是体现光合作用速率及其生产力的重要表征,其变化取决于植物自身的生物学特性,同时也受外界环境因素所影响[17,24]。本研究发现,各处理Fv/Fm、ΦPSⅡ以及qP的变化规律基本一致,即随着盐浓度水平升高,Fv/Fm、ΦPSⅡ及qP均表现为明显的下降趋势,同时随着NH+4供给比例的增加其参数总体表现为略微增加趋势。各处理的非光化学猝灭系数(NPQ)规律则与Fv/Fm、ΦPSⅡ、qP相反。说明盐胁迫可降低光合吸收效率,而供应NH+4可在一定程度上降低盐胁迫带来的不利影响。本研究中,无论氮素形态如何,在NaCl存在下,叶片水势均显著下降,在较高浓度NaCl(100 mmol/L)条件下其降幅进一步加大。叶温与植株水分状况密切相关,试验数据表明,盐胁迫程度越高,叶内温度越高,且溶质渗透势(Ψs)、膨压(Ψp)也呈下降趋势,表明盐胁迫下玉米难以维持细胞组织的水分。NaCl胁迫条件下,单一NH+4供应处理比单一NO-3供应或混合供应处理中下降更多。这表明面对盐胁迫,单一NH+4供应处理下耐盐玉米植株更加具备其他盐生植物相同的策略,即降低细胞渗透势、保持细胞膨压[10,17,25]。
尽管钠(Na+)和氯(Cl-)对大多数植物不是必需的,但对某些C4作物,例如甘蔗、玉米等却是有益的,甚至是细胞代谢所必需[26],因为在土壤水势较低时,这2种矿物质在细胞液泡中积极积累,从而调节细胞渗透,以降低渗透势和保持膨胀压,从而吸引水分进入细胞[10]。然而,高浓度的Na+和Cl-会对植物造成生理生化和分子干扰[17]。本研究中,单一NH+4形态供应下的植株比单一NO-3的植株生长得更好,即使根系暴露在100 mmol/L NaCl中 60 d,其叶片Na+浓度也保持在相对较低的水平。这表明耐盐性植物在单一NH+4或NO-3環境对盐浓度的生长策略不同,单一NH+4供给的玉米Na+含量较低可能是由于根系通过非特异性阳离子通道运输被占据从而降低对Na+的吸收[27]。单一NO-3供应的玉米Na+含量较高,可能是由于叶片累积Na+用以补偿土壤溶液中盐分造成的负水势的结果[17]。
环境盐浓度对植物吸收NO-3的影响尚存在争议,在某些C4植物中,其植株在吸收Na+的同时能特异地促进NO-3的吸收,这对植物的生长有积极作用[28]。然而,在其他植物类型中,NaCl处理会影响植株对NO-3的摄取,即高浓度Cl-会干扰根系吸收NO-3[2,17]。本研究中,在NaCl处理(50、100 mmol/L)中,以NO-3为唯一氮源处理的植株叶片Cl-积累增加,在100 mmol NaCl条件下叶片NO-3含量显著降低,表现出明显的缺氮症状,说明在根系吸收养分的过程中存在NO-3被Cl-广泛替代[29]。Cl-对NO-3的吸收抑制取决于植物种类和吸收介质中NO-3和Cl-的浓度,一般而言,盐敏感植物中Cl-和NO-3之间的竞争程度比耐盐植物中表现得更突出[10,17]。本研究中,100 mmol/L NaCl处理增加了以NO-3为唯一氮源的叶片NH+4浓度;参照Hessini等的试验结果[30],推测在根系养分吸收过程中NO-3被Cl-取代从而导致缺乏硝转运蛋白造成养分运输受限是盐胁迫抑制玉米植株生长发育的重要原因之一。3EAFA25E-20A4-4A9A-8E10-ABB1D401EFA7
对盐胁迫诱导的抗氧化反应是一种潜在的耐盐机制,它可为单一NH+4氮素供给的植物提供优势。植株组织NH+4水平取决于酶代谢消耗[谷氨酸合成酶(GS)、管氨酸脱氢酶(GDH)]和增强酶活[硝酸还原酶(NR)、亚硝酸还原酶(Nir)氨基酸分解代谢]铵之间的平衡,在盐胁迫条件下上述NH+4代谢可能会发生重大改变[30-31]。例如,在互花米中,超氧化物歧化酶(SOD)活性在单一NH+4供给处理的植株比单一NO-3处理高出近3倍,这与单一NH+4供给的植物发生电解质泄漏、丙二醛(MDA)和过氧化氢(H2O2)浓度较低有关[21]。一般而言,盐胁迫会影响植物的养分有效性、运输以及分配来干扰植物体内的矿质养分间的相互关系[10,32]。本研究中,也观察到NH+4和Na+可能也存在根系吸收竞争,与单一供应NO-3处理相比,100 mmol/L NaCl胁迫下,单一NH+4供应处理的K+/Na+增加,表明盐胁迫下单一NH+4供应的植株根系可能并不存在NH+4、Na+之间吸收位点竞争。有趣的是,本研究发现,在单一NH+4供给的处理中,Ca2+在叶片中浓度同样增加了,然而通过细胞转运蛋白转运的阳离子之间的竞争并不涉及Ca2+;由于Ca2+的本身是信号传递物质,推测当玉米植株受到胁迫时,Ca2+可能作为胁迫信号传递的次级信使[33],因此Ca2+增加。
综上,本研究表明,随着盐胁迫程度的增加,对植物生长及生理代谢越不利。盐胁迫下,较纯NO-3处理相比,铵态氮(NH+4)的存在对耐盐玉米品种的生长发育存在一定的缓解作用,提高NH+4供给水平可进一步促进植物干物质累积、叶片发育、光合交换及调节细胞水合度。这意味着通过培育耐盐性较高的作物品种和施用NH+4肥料,对于开发利用中度盐渍化土壤具有可行性。
参考文献:
[1]杨劲松. 中国盐渍土研究的发展历程与展望[J]. 土壤学报,2008,45(5):837-845.
[2]耿 杰,张琳捷,岳小红,等. 铵态氮和硝态氮调节盐胁迫豌豆幼苗生长和根系呼吸的作用[J]. 植物营养与肥料学报,2018,24(4):1001-1009.
[3]郑庆柱,谭海运,高 雪,等. 干旱、盐胁迫及盐旱复合胁迫对青稞幼苗生理生化特性的影响[J]. 江苏农业科学,2020,48(1):97-103.
[4]Xu G H,Fan X R,Miller A J. Plant nitrogen assimilation and use efficiency[J]. Annual Review of Plant Biology,2012,63:153-182.
[5]曹本福,姜海霞,劉 丽,等. 丛枝菌根菌丝网络在植物互作中的作用机制研究进展[J]. 应用生态学报,2021,32(9):3385-3396.
[6]薛 明,李玉玺,马 超,等. 氮素形态配比对白浆土活性有机碳的调控影响[J]. 江苏农业科学,2018,46(1):224-227.
[7]陶 爽,华晓雨,王英男,等. 不同氮素形态对植物生长与生理影响的研究进展[J]. 贵州农业科学,2017,45(12):64-68.
[8]黄 茹,吴玉萍,夏振远,等. 氮素水平对红花大金元烟叶游离氨基酸和蛋白质含量的影响[J]. 中国烟草科学,2017,38(5):50-55.
[9]Coleto I,Vega-Mas I,Glauser G,et al. New insights on Arabidopsis thaliana root adaption to ammonium nutrition by the use of a quantitative proteomic approach[J]. International Journal of Molecular Sciences,2019,20(4):814.
[10]Hessini K,Martínez J P,Gandour M,et al. Effect of water stress on growth,osmotic adjustment,cell wall elasticity and water-use efficiency in Spartina alterniflora[J]. Environmental and Experimental Botany,2009,67(2):312-319.3EAFA25E-20A4-4A9A-8E10-ABB1D401EFA7
[11]秦显艳,王春霞,何新林. 施氮对盐碱土入渗及水盐运移的影响[J]. 水土保持学报,2019,33(1):248-252.
[12]张海艳,赵海军. 不同品种玉米萌发期和苗期耐盐性综合评价[J]. 玉米科学,2016,24(5):61-67.
[13]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[14]孙云飞,张文明,巢建国,等. 盐胁迫对茅苍术叶绿素含量及叶绿素荧光参数的影响[J]. 江苏农业科学,2020,48(4):146-149.
[15]鲍士旦. 土壤农化分析[M]. 3版.北京:中国农业出版社,2000.
[16]马国礼,张国斌,强浩然,等. 水氮耦合对日光温室辣椒生长、光合特性及养分分配的影响[J]. 干旱地区农业研究,2018,36(5):130-141.
[17]李 明,冷冰莹,张晗菡,等. 盐胁迫下调控玉米胞内Na+/K+比稳定的主要机制与措施[J]. 山东农业科学,2021,53(6):133-138.
[18]张 鹏,张然然,都韶婷.植物体对硝态氮的吸收转运机制研究进展[J]. 植物营养与肥料学报,2015,21(3):752-762.
[19]刘 婷,尚忠林. 植物对铵态氮的吸收转运调控机制研究进展[J]. 植物生理学报,2016,52(6):799-809.
[20]Bybordi A. Effect of different ratios of nitrate and ammonium on photosynthesis,and fatty acid composition of canola under saline conditions[J]. Journal of Crop production and processing,2012,2(3):622-626.
[21]陳莎莎,兰海燕. 植物对盐胁迫响应的信号转导途径[J]. 植物生理学报,2011,47(2):119-128.
[22]徐 澜,高志强,安 伟,等. 冬麦春播条件下旗叶光合特性、叶绿素荧光参数变化及其与产量的关系[J]. 应用生态学报,2016,27(1):133-142.
[23]曹本福,陆引罡,刘 丽,等. 减施氮肥下聚天冬氨酸对烤烟生理特性及氮肥去向的影响[J]. 水土保持学报,2019,33(5):223-229.
[24]贾舟楫,董凯向,高 展,等. 葡光互补对吐鲁番葡萄叶片光合及叶绿素荧光特性的影响[J]. 山东农业科学,2019,51(5):47-51.
[25]Hessini K,Kronzucker H J,Abdelly C,et al. Drought stress obliterates the preference for ammonium as an N source in the C4plant Spartina alterniflora[J]. Journal of Plant Physiology,2017,213:98-107.
[26]Maathuis F J M. Sodium in plants:perception,signalling,and regulation of sodium fluxes[J]. Journal of Experimental Botany,2013,65(3):849-858.
[27]Ferchichi S,Hessini K,Dell Aversana E,et al. Hordeum vulgare and Hordeum maritimum respond to extended salinity stress displaying different temporal accumulation pattern of metabolites[J]. Functional Plant Biology,2018,45(11):1096-1109.
[28]孙敏红,谢深喜,卢晓鹏,等. 钨酸钠处理对枳幼苗生长及植株硝态氮含量的影响[J]. 经济林研究,2013,31(4):115-120.
[29]Bazihizina N,Colmer T D,Cuin T A,et al. Friend or foe?Chloride patterning in halophytes[J]. Trends in Plant Science,2019,24(2):142-151.
[30]Hessini K,Cruz C,Gandour M,et al. Do reactive oxygen species (ROS) induced by NaCl contribute to ammonium accumulation in Spartina alterniflora?[J]. Journal of Plant Nutrition and Soil Science,2009,172(6):851-860.
[31]徐晓鹏,傅向东,廖 红.植物铵态氮同化及其调控机制的研究进展[J]. 植物学报,2016,51(2):152-166.
[32]冯 梅,张世卿,曹亚军,等. 盐胁迫对红花种子萌发及幼苗的生理效应[J]. 江苏农业科学,2020,48(22):144-148.
[33]Hessini K,Hamed K B,Gandour M,et al. Ammonium nutrition in the halophyte Spartina alterniflora under salt stress:evidence for a priming effect of ammonium[J]. Plant and Soil,2013,370(1/2):163-173.3EAFA25E-20A4-4A9A-8E10-ABB1D401EFA7

