河南新育小麦品种多酚氧化酶活性基因的检测与分布
葛君 任德超 孟自力 李爱霞 陈杰


摘要:为了解多酚氧化酶活性基因在河南新育小麦品种中的分布情况,选用123份河南新育小麦品种为试验材料,利用功能标记PPO18、PPO16和PPO29对供试材料的Ppo-A1和Ppo-D1位点等位基因进行分子检测。结果表明,在Ppo-A1位点上共检测到2种等位基因Ppo-A1a和Ppo-A1b,分布频率分别为63.4%和36.6%,以与高多酚氧化酶活性相关的等位基因Ppo-A1a分布为主;在Ppo-D1位点上共检测到2种等位基因Ppo-D1a和Ppo-D1b,分布频率分别为78.9%和21.1%,以与低多酚氧化酶活性相关的等位基因Ppo-D1a分布为主。在Ppo-A1和Ppo-D1这2个位点上,共检测到4种等位基因组合Ppo-A1a/Ppo-D1a、Ppo-A1a/Ppo-D1b、Ppo-A1b/Ppo-D1a和 Ppo-A1b/Ppo-D1b,分布频率分别为52.8%、10.6%、26.0%和10.6%,以与中等多酚氧化酶活性相关的等位基因组合Ppo-A1a/Ppo-D1a分布为主。此外,本研究筛选出的偃高161、商麦188和厚德麦971等32份携带等位基因组合Ppo-A1b/Ppo-D1a(与低多酚氧化酶活性相关)的小麦材料,可以为一线育种人员进行小麦品质色泽改良提供参考信息。
关键词:小麦;多酚氧化酶;分子检测;功能标记;等位基因
中图分类号:S512.103 文献标志码:A
文章编号:1002-1302(2022)11-0037-06
收稿日期:2022-03-07
基金项目:国家现代农业产业技术体系建设专项(编号:CARS-03-31)。
作者简介:葛 君(1981—),女,河南商丘人,助理研究员,主要从事小麦遗传育种与栽培研究。E-mail:y2013g2015@163.com。
通信作者:李爱霞,高级农艺师,主要从事小麦遗传育种与栽培研究。E-mail:spsnlkxymzl@163.com。
小麦面粉在加工过程中容易产生褐变,这不仅影响面制食品的外观品相,而且还会对其营养价值造成一定影响。小麦籽粒中的多酚氧化酶是引起小麦面粉褐变的主要因素[1-3]。调控多酚氧化酶活性的基因主要位于小麦第2同源染色体上[4-7],Raman等在小麦2AL染色体上检测到的主效QTL基因位点可以解释82%~84%的表型变异[6];张立平等在小麦2DL染色体上检测到的主效QTL基因位点可以解释25.1%~29.1%的表型变异[7]。随后,Sun等克隆出位于2AL染色体上的Ppo-A1基因,并开发设计了分子功能标记PPO18用于检测等位基因Ppo-A1a和Ppo-A1b,其中等位基因Ppo-A1a与高多酚氧化酶活性相关,等位基因Ppo-A1b与低多酚氧化酶活性相关[8]。He等克隆出位于2DL染色体上的Ppo-D1基因,并开发设计了分子功能标记PPO16和PPO29用于检测等位基因 Ppo-D1a和Ppo-D1b,其中等位基因Ppo-D1a与低多酚氧化酶活性相关,等位基因Ppo-D1b与高多酚氧化酶活性相关[9]。标记PPO18、PPO16和PPO29的准确性和可靠性又先后在我国不同麦区的材料中得到了验证[10-12],随后国内学者利用上述标记又在新疆、陕西、甘肃、黑龙江、四川和贵州小麦材料中进行了检测应用[13-18]。
河南是我国小麦重要的生产省份之一,选育低多酚氧化酶活性的小麦品种有利于小麦面粉品质的色泽改良。本研究选用123份河南新育小麦品种为试验材料,利用功能标记PPO18、PPO16和PPO29对供试材料的Ppo-A1和Ppo-D1位点等位基因进行分子检测,以了解多酚氧化酶活性基因在河南新育成小麦品种中的分布情况,进而筛选出携带低多酚氧化酶活性基因的小麦资源材料,從而为河南省一线育种人员进行小麦品质色泽改良提供参考信息。
1 材料与方法
1.1 供试材料
供试材料为参加2020—2021年度河南省区域试验的小麦品种,共计123份(表1)。这些材料经过2年品种比较试验晋级而来,可以很客观地反映河南当前的小麦育种情况。
1.2 基因组DNA提取
提取基因组DNA所用试剂的配制以及提取均参考袁谦等[19]和陈杰等[20]的方法进行。
1.3 分子标记检测
选用标记PPO18对供试材料Ppo-A1位点的等位基因检测,扩增出685 bp条带的材料记为Ppo-A1a类型等位基因,扩增出876 bp条带的材料记为Ppo-A1b类型等位基因;选用标记PPO16和PPO29对供试材料Ppo-D1位点的等位基因检测,扩增出713 bp条带的材料记为Ppo-D1a类型等位基因,扩增出490 bp条带的材料记为Ppo-D1b类型等位基因。所选用标记的引物信息见表2。
利用ABI 9700型PCR仪器(美国伯乐公司生产)进行扩增,扩增产物用1.8%的琼脂糖凝胶电泳分离,用0.6%的溴化乙锭染色,最后用AlphaImager HP型凝胶成像系统(美国Protein Simple公司生产)扫描成像保存。
1.4 数据分析
用Excel 2003软件进行基础数据处理和表格制作。208899EF-BB0E-4B04-BFD8-DA6257A58E44
2 结果与分析
2.1 Ppo-A1位点等位变异的分子检测
针对Ppo-A1位点,利用标记PPO18对123份供试材料进行分子检测。检测结果(图1)显示,中农867、轮选128和苑丰16等78份材料可以扩增出685 bp的条带,记为Ppo-A1a类型等位基因,分布频率为63.4%;百农227、豫农526和郑麦189等45份材料可以扩增出876 bp的条带,记为Ppo-A1b类型等位基因,分布频率为36.6%。从检测结果分析可知:在123份供试材料的Ppo-A1位点上,以与高多酚氧化酶活性相关的等位基因Ppo-A1a分布为主。
2.2 Ppo-D1位点等位变异的分子检测
针对Ppo-D1位点,利用标记PPO16和PPO29对123份供试材料进行分子检测(图2、图3)。检测结果显示,育麦6号、育麦699和中农539等97份材料可以扩增出713 bp的条带,记为Ppo-D1a类型等位基因,分布频率为78.9%;偃高167、温育919和天民188等26份材料可以扩增出490 bp的条带,记为Ppo-D1b类型等位基因,分布频率为21.1%。从检测结果分析可知,在123份供试材料的Ppo-D1位点上,以与低多酚氧化酶活性相关的等位基因Ppo-D1a分布为主。
2.3 多酚氧化酶活性基因在河南小麦材料中的分布
在123份供试材料Ppo-A1和Ppo-D1位点上共检测到4种类型的等位基因组合(表1),与低多酚氧化酶活性相关的等位基因组合Ppo-A1b/Ppo-D1a共检测到32份,分布频率为26%;与高多酚氧化酶活性相关的等位基因组合Ppo-A1a/Ppo-D1b共检测到13份,分布频率为10.6%;与中等多酚氧化酶活性相关的等位基因组合Ppo-A1a/Ppo-D1a和Ppo-A1b/Ppo-D1b分别检测到65份和13份,分布频率分别为52.8%和10.6%。从以上内容分析可知,在123份供试材料的Ppo-A1和Ppo-D1位点上,以与中等多酚氧化酶活性相关的等位基因组合Ppo-A1a/Ppo-D1a分布为主。
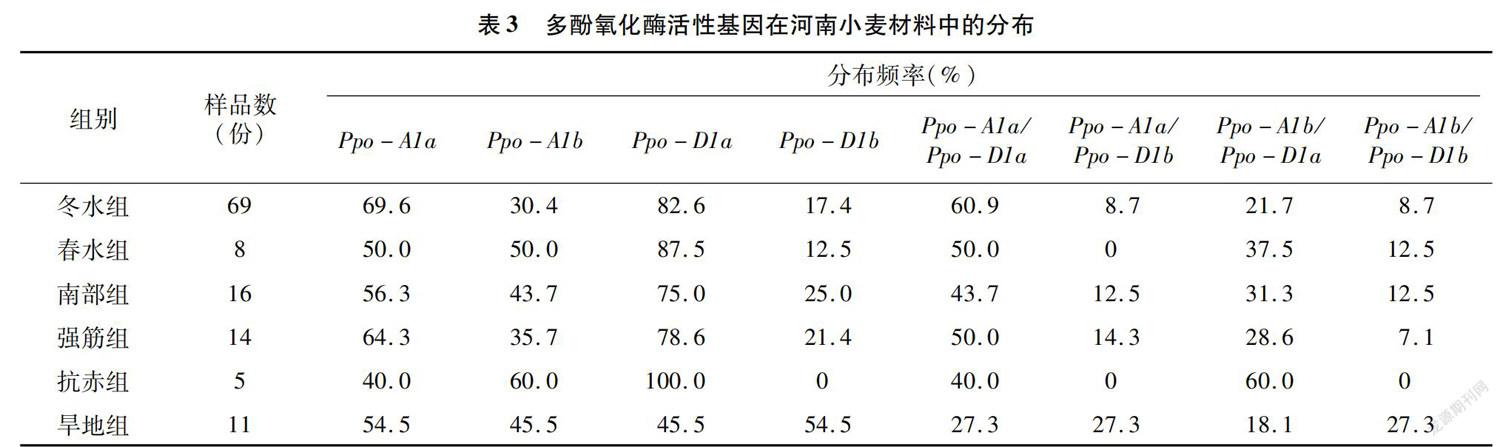
进一步分析不同類型河南小麦材料的多酚氧化酶基因的分布(表3)可知,与低多酚氧化酶活性相关的等位基因Ppo-A1b在来源于冬水组、南部组、强筋组、旱地组小麦材料中的分布频率分别为30.4%、43.7%、35.7 %和45.5%,均低于与高多酚氧化酶活性相关的等位基因Ppo-A1a,而在抗赤组小麦材料中则反之。与低多酚氧化酶活性相关的等位基因Ppo-D1a在来源于冬水组、春水组、南部组、强筋组、抗赤组小麦材料中的分布频率分别为82.6%、87.5%、75.0%、78.6 %和100.0%,均高于与高多酚氧化酶活性相关的等位基因Ppo-D1b,而在旱地组小麦材料中则反之。与低多酚氧化酶活性相关的等位基因组合Ppo-A1b/Ppo-D1a在来源于不同类型河南小麦材料中的分布频率的大小顺序为抗赤组(60.0%)>春水组(37.5%)>南部组(31.3%)>强筋组(28.6%)>冬水组(21.7%)>旱地组(18.1%)。从以上内容分析可知:与低多酚氧化酶活性相关的等位基因组合Ppo-A1b/Ppo-D1a在不同类型河南小麦材料中(除抗赤组)的分布频率仍然较低。
3 讨论与结论
了解多酚氧化酶活性基因的分布情况,可以为多酚氧化酶活性的遗传改良提供参考信息。诸位国内学者研究表明,等位基因Ppo-A1a、Ppo-A1b、Ppo-D1a和Ppo-D1b在贵州小麦中的分布频率分别为90.37%、9.63%、15.56%和84.44%,在四川小麦中的分布频率分别为47.6%、52.4%、74.3%和25.7%,在黑龙江小麦中的分布频率分别为60.8%、36.0%、48.0%和52.0%,在甘肃小麦中的分布频率分别为49.04%、50.96%、50.96%和49.04%,在陕西小麦中的分布频率分别为47.1%、52.9%、30.4%和69.6%,在新疆小麦中的分布频率分别为69.0%、31.0%、13.1%和86.9%[13-18]。本研究表明,等位基因Ppo-A1a、Ppo-A1b、Ppo-D1a和Ppo-D1b在123份河南新育小麦品种中的分布频率分别为63.4%、36.6%、78.9%和21.1%。综合以上数据分析可知,与低多酚氧化酶活性相关的等位基因Ppo-A1b和Ppo-D1a在我国不同省份之间的分布频率差异很大,等位基因Ppo-A1b在四川、甘肃和陕西小麦中的分布频率均高于50%,而在贵州、黑龙江、新疆和河南小麦中的分布频率均低于50%;等位基因Ppo-D1a在四川、甘肃和河南小麦中的分布频率均高于50%,而在贵州、黑龙江、陕西和新疆小麦中的分布频率均低于50%。今后在育种过程中应当对等位基因Ppo-A1b和 Ppo-D1a施加选择压力,淘汰携带等位基因Ppo-A1a和Ppo-D1b且综合农艺性状差的材料,选择携带等位基因Ppo-A1b和Ppo-D1a且综合农艺性状好的材料,以促进低多酚氧化酶活性小麦新品种的选育。
分子功能标记的开发及应用是小麦分子育种领域的研究热点。分子功能标记是根据不同位点等位基因内部的功能区开发设计,该功能区之间序列多态性的差异直接与所控制的性状表型相关。因此,利用此项技术可大大提高分子标记辅助育种的准确性和效率。本研究选用的3个功能标记PPO18、PPO16和PPO29稳定性好,扩增条带清晰,可以快速准确地检测出Ppo-A1和Ppo-D1位点的等位基因变异情况,可直接作为多酚氧化酶活性基因分子辅助选择的有效工具。此外,本研究筛选出了偃高161、商麦188和厚德麦971等32份携带等位基因组合Ppo-A1b/Ppo-D1a的小麦材料,在综合考虑抗病性和产量等农艺性状的前提下,可作为选育低多酚氧化酶活性品种的重点资源,在配置育种组合中加以利用。208899EF-BB0E-4B04-BFD8-DA6257A58E44
参考文献:
[1]Simeone R,Pasqualone A,Clodoveo M L,et al. Genetic mapping of polyphenol oxidase in tetraploid wheat[J]. Cellular & Molecular Biology Letters,2002,7(2B):763-769.
[2]Baik B K,Czuchajowska Z,Pomeranz Y. Discoloration of dough for oriental noodles[J]. Cereal Chemistry,1995,72(2):198-205.
[3]Fuerst E P,Anderson J V,Morris C F. Delineating the role of polyphenol oxidase in the darkening of alkaline wheat noodles[J]. Journal of Agricultural and Food Chemistry,2006,54(6):2378-2384.
[4]Jimenez M,Dubcovsky J. Chromosome location of genes affecting polyphenol oxidase activity in seeds of common and durum wheat[J]. Plant Breeding,1999,118(5):395-398.
[5]Demeke T,Morris C,Campbell K G,et al. Wheat polyphenol oxidase:distribution and genetic mapping in three inbred line populations[J]. Crop Science,2001,41:1750-1757.
[6]Raman R,Raman H,Johnstone K,et al. Genetic and in silico comparative mapping of the polyphenol oxidase gene in bread wheat (Triticum aestivum L.)[J]. Functional & Integrative Genomics,2005,5(4):185-200.
[7]張立平,葛秀秀,何中虎,等. 普通小麦多酚氧化酶活性的QTL分析[J]. 作物学报,2005,31(1):7-10.
[8]Sun D J,He Z H,Xia X C,et al. A novel STS marker for polyphenol oxidase activity in bread wheat[J]. Molecular Breeding,2005,16(3):209-218.
[9]He X Y,He Z H,Zhang L P,et al. Allelic variation of polyphenol oxidase (PPO) genes located on chromosomes 2A and 2D and development of functional markers for the PPO genes in common wheat[J]. Theoretical and Applied Genetics,2007,115(1):47-58.
[10]肖永贵,何心尧,刘建军,等. 中国冬小麦品种多酚氧化酶活性基因等位变异检测及其分布规律研究[J]. 中国农业科学,2008,41(4):954-960.
[11]左爱辉,陈 锋,尚晓丽,等. 河南小麦新品种(系)的多酚氧化酶基因等位变异[J]. 麦类作物学报,2012,32(6):1072-1077.
[12]陈 杰,陈 锋,詹克慧,等. 黄淮麦区小麦子粒多酚氧化酶活性基因等位变异的分子检测[J]. 植物遗传资源学报,2013,14(5):900-907.
[13]晏 权,任明见,李振华,等. 贵州小麦品种(系)籽粒低PPO活性种质资源筛选[J]. 南方农业学报,2020,51(3):512-519.
[14]李式昭,郑建敏,伍 玲,等. 四川小麦品种淀粉特性、多酚氧化酶活性和黄色素含量相关基因的分子标记鉴定[J]. 分子植物育种,2015,13(5):982-993.
[15]杨淑萍,张宏纪,张举梅,等. 俄引与黑龙江春小麦多酚氧化酶活性基因类型的比较[J]. 核农学报,2015,29(12):2268-2275.
[16]曹 东,张雪婷,王世红,等. 104份甘肃小麦品种脂肪氧化酶和多酚氧化酶活性基因等位变异的检测[J]. 麦类作物学报,2014,34(4):467-473.
[17]付晓洁,叶 石,吴学闯,等. 多酚氧化酶活性基因等位变异在陕西小麦品种中的分布[J]. 麦类作物学报,2009,29(2):236-240.
[18]王 亮,穆培源,徐红军,等. 新疆小麦品种中多酚氧化酶(PPO)活性基因等位变异的分布[J]. 麦类作物学报,2008,28(5):766-771.
[19]袁 谦,张 锋,张中州,等. 国审小麦品种漯麦18重要功能基因的KASP标记检测[J]. 江苏农业科学,2021,49(24):56-59.
[20]陈 杰,张星宇,张福彦,等. 黄淮麦区(南片)小麦新品系脂肪氧化酶活性分析及其等位基因检测[J]. 麦类作物学报,2021,41(10):1219-1227.208899EF-BB0E-4B04-BFD8-DA6257A58E44

